Summary
In deze studie werd een nano-microfluïdische stroom kamer gebruikt om te visualiseren en functioneel karakteriseren het trillen beweeglijkheid van Xylella fastidiosa, een bacterie die de ziekte van Pierce veroorzaakt in Grapevine.
Abstract
Xylella fastidiosa is een Gram-negatieve non-flagellen bacterie die een aantal economisch belangrijke ziekten bij planten veroorzaakt. De spiertrekkingen beweeglijkheid biedt X. fastidiosa een middel voor de lange afstand intra-fabriek beweging en kolonisatie, bij te dragen in de richting van pathogeniciteit in X. fastidiosa. Het trillen beweeglijkheid van X. fastidiosa wordt beheerd door type IV pili. Type IV pili van Xylella fastidiosa worden geregeld door pilG, een chemotaxis regulator in Pil-Chp operon dat codeert voor eiwitten die betrokken zijn bij signaaltransductie. Om de rol van pilG verhelderen in het trillen beweeglijkheid van X. fastidiosa, een pilG deficiënte mutant Xf ΔpilG en zijn complementaire stam XfΔpilG- C met inheemse pilG werden ontwikkeld. Een microfluïdische kamers geïntegreerd met een time-lapse beeldopname systeem werd gebruikt om spiertrekkingen beweeglijkheid observeren XfΔpILG XfΔpilG- C en de wild-type stam. Met behulp van deze opname systeem, het maakt het mogelijk de lange termijn ruimtelijke en temporele observaties van aggregatie, migratie van individuele cellen en populaties van bacteriën via trillen beweeglijkheid. X. fastidiosa wild type en complementaire XfΔpilG- C-stam toonde typische trillen beweeglijkheid kenmerken rechtstreeks waargenomen in de microfluïdische stroom kamers, terwijl mutant XfΔpliG tentoongesteld de spiertrekkingen deficiënt fenotype. Deze studie toont aan dat pilG bijdraagt aan het trillen beweeglijkheid van X. fastidiosa. De microfluïdische stroom kamer wordt gebruikt als een middel voor het waarnemen twitching beweeglijkheid.
Introduction
Xylella fastidiosa is een Gram-negatieve non-gegeseld, pathogene bacterie die een aantal economisch belangrijke gewassen ziekten, waaronder de ziekte van Pierce in wijnstok (Vitis vinifera L.) 1,2, 3 veroorzaakt. Deze bacterie is beperkt tot de watervoerende xyleem vaartuigen. Infectie van grapevine zorgt ervoor dat de blokkade van de houtvaten en resulteert in het water stress en voedingstekorten 3. Succesvolle kolonisatie is afhankelijk van het vermogen van de bacterie om van de oorspronkelijke plaats van infectie aan de rest van de plant 3. Spiertrekkingen beweeglijkheid is een middel om flagellaire-onafhankelijke bacteriële beweging door de uitbreiding, gehechtheid, en intrekken van de polaire type IV pili 4 die gekenmerkt is in X. fastidiosa 5,6,7.
De spiertrekkingen beweeglijkheid is waargenomen door laser pincet en atomic force microscopie (AFM) 8,9,10. Met behulp van deze technieken, tbeheksen motilities gegenereerd door type IV pilus van N. gonorrhoeae en P. aeruginosa werden gekenmerkt door fl uorescently etikettering pili en het vastleggen van hun bewegingen microscopisch. Hoewel beide methoden de kleefkracht van individuele bacteriën beschreven, de procedures ingewikkeld en tijdrovend 9,10. De micro fl uidic kamers werden gebruikt voor lange afstand migratie van afzonderlijke cellen en kleine aggregaten van bacteriecellen 5,6 waarnemen. Deze kamers zijn ontworpen als een microfabricated-nano-kanaal in een plaat geïntegreerd met een time-lapse beeldopname systeem 11,12,13,14. Micro fl uidic kamer apparaten bieden verschillende voordelen voor het bestuderen van verplaatsingsgedrag en cel-cel interacties bacteriën: (i) biedt een geïntegreerd platform meerkanaals vermogens; (Ii) het kan de bewegingen en combinaties van enkele cellen in de nano-schaal kenmerken van bacteriën te onderzoeken; (Iii) het zorgt voor directe microscopic beeldopname van bacteriële cellen en time-lapse analyse, (iv) indien langdurig ruimtelijke en temporele waarnemingen van afzonderlijke en / of populaties van bacteriën in een micro-omgeving; (V) de stroomsnelheid van kweekmedium in een kanaal kan nauwkeurig worden geregeld en (vi) in een zeer klein volume (1 ml) kweekmedium vereist voor elk experiment.
Onlangs heeft de micro fl uidic stroming systeem toegepast om het gedrag van bacteriële cellen onder verschillende micro-omgevingen 14,15,16 onderzoeken. De hechting en de bevestigingsoppervlak E. coli 15 X. fastidiosa 16 en Acidovorax citrulli 14 tot glasoppervlakken werden beoordeeld met behulp van micro fl uidic kamers. De vorming aggregatie en bio fi lm gemedieerd door type IV pili van Acidovorax citrulli werden geanalyseerd 14. Bovendien is de beweging van A. citrulli waargenomen onder fl ow caarden aangetoond dat de type IV pili een belangrijke rol kunnen spelen in de kolonisatie en de verspreiding van A. citrulli in houtvaten onder sap fl ow omstandigheden. De spiertrekkingen motilities van Pseudomonas aeruginosa en X. fastidiosa cellen werden met succes waargenomen tegen een vloeistof stroom in een microfabricated stromingskamer 5,6,17. Type IV pilus tekort pilB en pilQ mutanten van X. fastidiosa bleken de snelheid van spiertrekkingen motiliteit onder stroming omstandigheden micro fl uidic apparaten 5,6,18 ingrijpend gewijzigd. De onderzoeken uitgevoerd op bacteriële hechting en beweeglijkheid in micro fl uidic apparaten aangegeven dat de micro fl uidic kamers zijn bijzonder geschikt voor het analyseren van de twitching beweeglijkheid en migratie van pili-gemedieerde bacteriën in vitro. Deze resultaten verklaren de-spiertrekkingen gemedieerde migratie mechanisme dat cel-cel hechting, aggregatie en kolonisatie binnen faciliteertde gastheer, uiteindelijk leiden tot een systemische infectie.
Pil-Chp operon van X. fastidiosa bevat pilG, Pili, pilJ, pil, chpB en WKKC die coderen voor signaaltransductie 20. De transmembraan chemoreceptors binden chemische stimuli in de periplasmatische domein en activeert een signalerende cascade in hun cytoplasma deel om uiteindelijk onder controle bacteriële trillen beweeglijkheid. In de Pil-Chp operon van X. fastidiosa, een fosfo-shuttle eiwit PilG is een homoloog te CheY. In E. coli en P. aeruginosa, CheY is het antwoord regulator in chemotaxis systemen die interageren met de flagella motor-eiwitten 19, 21. Hoewel de bijdragen van de Pil-Chp operon in de richting van virulentie in X. fastidiosa zijn onlangs onderzocht 20, de rol van pilG in chemotaxis operon in reactie op de signalen uit de omgeving en gereguleerd / motor type IV pili X. fastidiosa is uncLear. Het inzicht van chemotaxis regulator pilG verhelderen de activiteit van twitching beweeglijkheid van X. fastidiosa, is een micro fl uidic kamer gebruikt om het trillen beweeglijkheid van X. beoordelen fastidiosa. De pilG van X. fastidiosa wordt gekenmerkt door het vergelijken van de fenotypes van een deletie mutant Xf ΔpliG, complementaire stam XfΔpliG -C en de wild-type in vitro. De resultaten benadrukken de rol van pilG in het trillen beweeglijkheid van X. fastidiosa.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. De Peripheral Fringe van Bacteriële Colony
- Grow X. fastidiosa (Xf) Temecula wildtype 22, pilG deletiemutant Xf ΔpliG (middels eerder beschreven deletie strategie 23), en de aanvullende XfΔpliG -C (middels eerder beschreven chromosoom gebaseerde genetische complementatie strategie 24) op PD2 medium agarplaten 25 bij 28 ° C gedurende 5-7 dagen.
- Autoclaaf cellofaan (1 x 1 cm 2) in water bij 121 ° C (249 ° F) gedurende 15 min. Pick-up een stuk van cellofaan, laat het water door het aanraken van een hoek van cellofaan op een lege petrischaal voorzichtig lag het cellofaan meer dan 15% van de agar oppervlak en de lucht drogen.
- Pick-up individuele X. fastidiosa kolonies met steriele tandenstokers en ronde vlek cellen aseptisch op een gesteriliseerde vel cellofaan overlay op de 15% agar oppervlak in de agarplaten. Incubeer de plaats bij 28 ° C gedurende 2-3 dagen.
- Bestudeer de rand morfologie van de kolonies met behulp van een dissectie microscoop met een 2X objectief en een 10x oculair lens. Fotografeer de perifere rand rond kolonies.
2. Microscopie en microfluïdische Flow Chambers
- Fabriceren microfluïdische apparaten met fotolithografische procedures zoals die eerder beschreven 5,18. Ontwerp van de vier parallelle kanalen met computergestuurde design software op de master silicium wafer met behulp van standaard lithografische methoden 26.
- Maak de microfluïdische kamers van silicium wafer master met polydimethylsiloxaan (PDMS). Pour gepolymeriseerd PDMS via siliciumwafel kapitein en genezen bij 60 ° C gedurende 1 uur. Trek het PDMS replica van de wafer-master en trim de PDMS replica met een mes in een 22 mm x 40 mm als dezelfde grootte van een glas dekglaasje.
- Blootstellen PDMS replica, een glazen dekglaasje (22 x 40 mm2), en een Microscope slide (51 x 76 mm 2) aan de lucht plasma bij 30 W gedurende 2 min 27. Sandwich de PDMS lichaam tussen het glas dekglaasje en het glas microscoop om de micro fl uidic kamer te bouwen.
- Een gat (5,5 mm diameter) door het PDMS aan elk uiteinde van het patroon-kanaal. Snijd de siliconen rubber slang in 12-20 cm lang. Verbind dan de siliconen rubber buis (5,1 mm buitendiameter, 2,1 mm binnendiameter, 0,8 mm wall) in elk uiteinde van de opening van de kanalen PDMS replica en verzegelt het met gepolymeriseerde PDMS bij 60 ° C gedurende 1 uur.
- Sluit andere uiteinde van de slang aan het einde van weerhaken plastic luer connectoren. Wikkel de verzamelde microfluïdische kamers met aluminiumfolie en autoclaaf ze gedurende 20 min.
- Verzamel bacteriecellen X. fastidiosa wild type, mutant Xf ΔpliG, en complementaire XfΔpliG -C via schrapen, met behulp van disposable entogen van PD2 medium platen. Pas celdichtheidtot een optische dichtheid van 0,05 bij 600 nm in PD2 bouillon zoals eerder 23 beschreven. Verzamel de bacteriële cel oplossing in een 1 ml spuit Gasdichte.
- Monteer de microfluïdische apparaat op een omgekeerde microscoop podium. Sluit een inlaatbuis aan de 5 ml Gasdichte spuit met PD2 bouillon. Breng de 5 ml Gasdichte spuit met de spuit pompen.
- Sluit de afvoerbuis naar een afvalreservoir. Handhaaf een gemiddelde stroomsnelheid van 0,2 gl -1 min gedurende 30 min om het te stabiliseren.
- Sluit side-inlaatbuizen een 1 ml spuit met Gasdichte de bacteriële cel oplossing. Spoel de bacteriële cel oplossing door de rubber slang totdat het kanaal is bereikt. Handhaven van een gemiddeld debiet van 0,2 pl min -1 voor nog eens 30 minuten om ongebonden cellen van de kamer voorafgaand aan het vastleggen van beelden te spoelen.
- Monteer de microscoop sluiter onder het veld aangepast deel van de microscoop om het licht te controleren. Sluit op de ontspanknop om de sluiter control systeem en sluit de sluiter besturingssysteem op de computer.
- Monteer een digitale camera aan op de video-poort van de microscoop en sluit deze aan op de computer. Voer de time-lapse-opname software, selecteer de "shutter" functie in het menu, en herkent automatisch de geïnstalleerde sluiter als standaard in de software om verbindingen tot stand om de sluiter met de software.
- Selecteer de functie "digitale camera" in het menu van de time-lapse-opname software voor de digitale camera herkent automatisch als standaard opname-apparaat in de software en de communicatie met de digitale camera met de software.
- Zoek de bacteriële cellen in een van de kanalen met behulp van 20X fase-contrast optiek, schakel dan over naar de 40X objectief voorafgaand aan het vastleggen van beelden.
- Voer de time-lapse-opname software, selecteert u de functie "beeldacquisitie" met behulp van standaard parameters in het menu om de beelden van de microscoop te verwerven.Open vervolgens de functie "Acquire time-lapse" en stel het tijdsinterval tot 30 sec 5,18,28 voor de duur van 6-24 uur, afhankelijk van het experiment moest trillen beweeglijkheid van X. te observeren fastidiosa 5,18,28. Klik op "OK" om de time-lapse-opname te starten. Klik op "Stack functie" van het menu, selecteer "opslaan als" om de afbeeldingen in de doelmap stack op de computer na het beëindigen van de opname.
- Voor meerdere kanalen, vastleggen time-lapse beelden van het eerste kanaal om de 30 sec voor 6 uur. Verplaats de objectieflens van de microscoop naar het volgende kanaal aan de doelcellen te lokaliseren. Herhaal de time-lapse functie zoals hierboven beschreven om beelden in elk van de vier kanalen achtereenvolgens onderscheppen experiment opgezet om vier kanalen te gebruiken. Voortzetting van de time-lapse beeld vast te leggen voor zo lang als drie opeenvolgende dagen. Alle experimenten werden uitgevoerd bij kamertemperatuur (23 ± 2 ° C).
- Compile de time-lapse beelden in eenvideobestand met behulp van de time-lapse-opname imaging software. Run time-lapse-opname software, klikt u op "Stack functie 'in het menu en selecteer' open stack functie" om de gestapelde bestanden van de computer.
- Start de functie "Maak film" van de stapel module, het selecteren van alle beelden en het kiezen van de "AVI" output formaat. Klik op "opslaan als" om het videobestand op te slaan in de doelmap op de computer.
- Selecteer de gecompileerde films van de doelmap op de computer en speel ze. Dan, let op de beweeglijkheid van de afzonderlijke cellen door middel van de resulterende visualisatie van de trekkingen beweeglijkheid activiteit van bacteriën cellen in de gegenereerde videobestanden.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
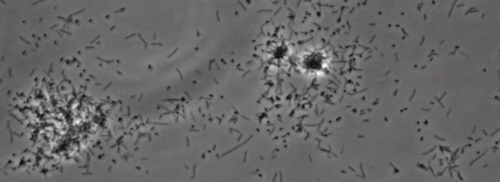
De aanwezigheid van een perifere rand kolonie indicatief type IV pilus-gemedieerde twitching beweeglijkheid, werd waargenomen in de kolonies van X. fastidiosa wildtype en complementaire Xf ΔpliG -C stam (figuur 1). Mutant XfΔpliG echter vertoonden geen franjes rond de omtrek van de kolonies (figuur 1). Time-lapse beeldvorming van bacteriële cellen in nano-microfluïdische stroom kamers bleek dat spiertrekkingen beweeglijkheid werd waargenomen in zowel wild-type X. fastidiosa en de complementaire XfΔpliG -C (Hulp V1, V3), terwijl XfΔpilG mutant cellen niet vertonen trillen beweeglijkheid gedurende het experiment (Aanvullende V2). Cellen van mutant XfΔpilG gevormd relatief kleine losse aggregaten in PD2 bouillon (Aanvullende V2). Daarentegen cellen van X. fastidiosa wild type en complementaire XfΔpilG- C d eveloped grotere aggregaten in PD2 bouillon (Figuur 2, (Supplemental V1, V3).

Marge kenmerken van X. Colony De perifere rand van bacteriële kolonie: Figuur 1. fastidiosa van wild type, mutant Xf ΔpilG, en complementaire XfΔpilG- C gekweekt op PD2 agar bedekt met een gesteriliseerde vel cellofaan. Met uitzondering van de mutant XfΔpilG, alle kolonies vertoonden een perifere rand, met vermelding van het type IV-pilus gemedieerde twitching beweeglijkheid. Plaatjes werden na 5 dagen kweek op kweekmedium. Vergroting bar, 0,5 mm. Klik hier om een grotere versie van deze figuur te bekijken.
_upload / 53816 / 53816fig2.jpg "/>
Figuur 2: De twitching beweeglijkheid van X. fastidiosa cellen in nano-microfluïdische stroom kamer. Het trillen beweeglijkheid van alle geteste stam cellen werd geregistreerd gedurende 6 dagen van waarneming. De evaluaties werden uitgevoerd van drie onafhankelijke video segmenten. Vergroting bar, 20 urn.
Opmerking: Het trillen beweeglijkheid van X. fastidiosa cellen wordt gekenmerkt door enkele cel verkeer over glasoppervlakken door de uitbreiding, gehechtheid, en intrekken van de polaire type IV pili. De enkele cel werd waargenomen in de migratie bij voorkeur tegen een vloeistof stroom in een microfabricated stromingskamer. Klik hier om een grotere versie van deze figuur te bekijken.
6 / 53816supfig1.jpg "/>
Aanvullende Figuur 1: Een vier-kanaals microfluïdische stroom kamer. Elk kanaal met media en media uit connectors aan elk uiteinde. Klik hier om een grotere versie van deze figuur te bekijken.
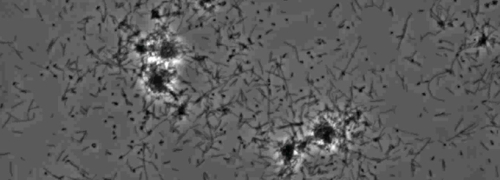
Aanvullende Movie 1: Spiertrekkingen beweeglijkheid. (Klik met de rechtermuisknop om te downloaden). Twitching van wild-type X. fastidiosa in een microfluïdische stroom kamer.
Aanvullende Movie 2: Verminderde Twitching beweeglijkheid. (Klik met de rechtermuisknop om te downloaden). Beweeglijkheid van Xf mutant. XfΔpilG waargenomen in amicrofluidic stroom kamer.
Aanvullende Movie 3: herstelde trillen beweeglijkheid. (Klik met de rechtermuisknop om te downloaden). Spiertrekkingen beweeglijkheid van Xf complementaire stam. XfΔpilG-C waargenomen in een microfluïdische stroom kamer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In deze studie hebben we karakteriseerde de beweging gedrag van X. fastidiosa PilG mutant Xf ΔpilG en zijn complementaire XfΔpilG- C-stammen in nieuw ontworpen meerdere parallelle-nano-kanaals micro fl uidic kamers. De nieuw ontworpen micro fl uidic kamers kunnen maximaal vier parallelle kamers met 100 micrometer nano-kanaal in de breedte ten opzichte van eerdere modellen met slechts een enkele 50 micrometer breed kanaal 18. De verbeterde brede nano-kanaal vergemakkelijkt de introductie van bacteriële cellen met het stromen van de media. Daarnaast is deze microfluidics kamer is 1) eenvoudig te bouwen en te monteren; 2) relatief goedkoop; en 3) gemakkelijk toepasbaar in verschillende experimentele eisen. Daardoor deze kamer ontwerp maakt het langetermijnwaarneming van de bewegingen van de bacteriële cellen onder soorten experimentele micromilieu.
Het stabiliseren van de stroming van de stromen through micro fl uidic kanaal is de kritische stap voor het creëren van een intact micro-flowing fl uidic micromilieu voor waarneming van de motiliteit van de bacteriële cellen onder verschillende experimentele omstandigheden. Het spoelen van micro fl uidic kamers en verbindingsslangen met de media voorafgaand aan de introductie van bacteriële cellen is een belangrijke stap om de stroming in de kamer te stabiliseren. Echter, de hoge snelheid van de stroming de bacteriële cellen uit de kamer te spoelen zonder behoud van cellen in de loop van de kamer. De juiste snelheid van de media die door de micro fl uidic kanalen moet worden aangepast met behulp van een injectiepomp. Tijdens de experimenten in deze studie werd de stromende ingesteld en gestabiliseerd door de pomp 0,2-1 ul min-1 gedurende ten minste 30 min voorafgaand aan het introduceren van de bacteriële cellen in het kanaal. Zodra de cellen in de micro fl uidic kanalen werden geïntroduceerd, het medium stroming werd 0,2 ul m onderhouden-1 30 tot 60 minuten om het systeem stabiliseren en nonattached cellen. Het is zeer belangrijk om de stroom te stabiliseren en de achtergrond duidelijk om de beweging van de bacteriecellen observeren houden. Beelden werden gevangen genomen elke 30 seconden om te bevestigen het trillen beweeglijkheid activiteit van de ingebrachte cellen handhaven van een constante stroom snelheid van 0,2 pl min -1. Als de experimenten het verzamelen van de bacteriecellen in de kamer vereist, kunnen de cellen worden gespoeld door geleidelijk verhogen van de stroming snelheden van media 0,2-110 pl min -1 door instelling van de injectiepomp snelheid.
De bacteriële cel activiteiten van de micro fl uidic kamers werden beoordeeld aan de geïnverteerde microscoop met 40x fase-contrast optica en time-lapse beelden die met een digitale camera, die werd geregeld door de beeldverwerkingssoftware. De stroomsnelheid en de interval tijd voor het vastleggen van beelden kan worden aangepast met experimental eisen. In de meeste gevallen, stroomsnelheid voor een gemiddelde stroomsnelheid is ingesteld op 0,2 pl min -1 met time-lapse beelden die elke 30 sec voor-pilus gemedieerde bacteriële cellen. In andere gevallen, wanneer het medium stroomsnelheid wordt verhoogd tot 0,1 pl min -1 tijdens experimenten, het gedrag van de bacteriële cellen wordt opgenomen door het vastleggen van beelden elke 10-15 sec dienovereenkomstig. De time-lapse beelden werden genomen om de 30 sec voor de duur van 6-24 uur en opgeslagen als een bron beeldbestanden voor elke geteste stam. De video's werden vervolgens voldaan uit de genomen 6-8 uur van elke stam, die contrasteren fenotypes getoond in spiertrekkingen motilities tussen mutant en wild type images / aanvulling stammen (Hulp V1, V2, V3).
De betekenis van de nano-micro fl uidic kamer apparaten op macroschaal parallelle plaat stroming kamers omvat de directe onderzoek van de bewegingen en de combinaties van zingenle cellen van bacteriën. Naast de low-cost 5 en lage reagens en monster volume-eisen, de voordelen van micro fl uidic kamers zijn het gemak van de bouw van een fl ow micro-omgeving voor bacteriële cultuur en nauwkeurige controle over fluïdum stroomsnelheid. De meerdere parallelle kanalen toestaan dat de observatie van differentiële bacteriestammen in een enkel experiment setup die verenigbaar gegevens levert voor analyse. Het flagellaire-onafhankelijke twitching motiliteit van de bacteriën met de polaire pili is bijzonder geschikt voor analyse in dit nano-, micro- fl uidic kamer. Echter, deze micro fl uidic kamer is minder geschikt voor flagellaire-afhankelijke bacteriële beweging, waarbij de beweging van bacteriën is meestal te snel en vertoont willekeurige richtingen. Deze beperking soms gepaard kan gaan met het aanpassen van het medium stroomsnelheid tot 0,05 pl min -1 en het veranderen van de time-lapse beeld vast te leggen snelheid elke 1 tot 2 seconden gedurende 1 uur tot AnalyZé de bewegingen van de flagellaire gemedieerde bacteriën in de nano-schaal omgeving.
Microfluïdische kamer apparaten hierin gebruikt directe visuele bewijs voor functionele evaluatie van de PilG die verantwoordelijk zijn voor beweging gedrag in vitro. Bovendien, deze studie blijkt ook dat cel naar cel aggregatie door het trillen beweeglijkheid is essentieel voor de vorming van biofilm, signalering en pathogeniciteit in X. fastidiosa. Visualisatie bacteriën twitching beweeglijkheid van microfluïdische inrichtingen verschaft een nieuwe benadering van genfunctie met gedrag bacteriën die niet gemakkelijk gemeten door andere bepalingsmethoden bestuderen. Deze benadering kan worden toegepast op andere bacteriële systemen. De microfluïdische kamer apparaten te voorzien van een stroom systeem voor het karakteriseren van de fysiologische gedrag van de bacteriële cellen geassocieerd met cel-cel-attachments, mobiele aggregaten, bewegingspatronen en de vorming van biofilm.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren dat ze geen concurrerende financiële belangen.
Acknowledgments
Deze studie werd ondersteund door de United States Department of Agriculture, Agricultural Research Service. Handelsnamen of commerciële producten in deze publicatie zijn uitsluitend genoemd voor het verstrekken van specifieke informatie en impliceert niet aanbeveling of goedkeuring door het Amerikaanse ministerie van Landbouw. USDA is een gelijke kans provider en werkgever.
Materials
| Name | Company | Catalog Number | Comments |
| Biology materials | |||
| X. fastidiosa (Xf) Temecula wild type | Costa, H. S., et al., 2004 22 | ||
| pilG deletion mutant XfΔpliG | Shi, X. Y., et al., 2007 26 | ||
| pilG complementary strain XfΔpliG-C | Davis, M. J., et al. 1998 23 | ||
| Physical materials and equipment | |||
| Disposable inoculating loops | VWR international, Radnor, PA | #22-363-607 | quantitative procedures such as bacterial collection |
| Polydimethylsiloxane (PDMS) | Dow Corning Corporation | #0002709226 | Sylgard 184 silicone Elastomeric Kits |
| AmScope MD2000 digital camera | AmScope, Irvine, CA | SE305R-AZ-E | Image, video recording and measurement |
| Tubes line | Edgewood, NY | #T4300 | Connected to the syringe and microfluidic chamber |
| Plastic luer connectors | Edgewood, NY | Connected to the syringe and microfluidic chamber | |
| Syringe pumps | Pico Plus, Harvard Apparatus, MA | #702209 | The flow rate can be adjusted while the pump is running. |
| Syringes | Gastight, Hemilton Company, Reno, NV | #1005 | Provide the flowing broth |
| Inverted Olympus IMT-2 microscope | Olympus | IMT-2 FLuoro PHase | Image observation and recording |
| SPOT-RT digital camera | Diagnostic Instruments, Inc., MI | RT230 | Image, video recording and measurement |
| Microscope Shutter | The UNIBLITZ, US | #LS2T2 | Control camera’s exposure time |
| Microscope Shutter Control system | The UNIBLITZ, US | VCM-D1 | VCM-D1 Single Channel CE/UL/CSA Approved Shutter Driver |
| MetaMorph Image software | Universal Imaging Corp., PA | Real-time super-resolution image processing |
References
- Purcell, A. H., Hopkins, D. L. Fastidious xylem-limited bacterial plant pathogens. Annu. Rev. Phytopathol. 34, 131-151 (1996).
- Purcell, A. H. Xylella fastidiosa, a regional problem or global threat. J. Plant Pathology. 79, 99-105 (1997).
- Hopkins, D. L. Xylella fastidiosa: Xylem-limited bacterial pathogen of plants. Annu. Rev. Phytopathol. 27, 271-290 (1989).
- Mattick, J. S. Type IV pili and twitching motility. Annu. Rev. Microbiol. 56, 289-314 (2002).
- Meng, Y., et al. Upstream migration of Xylella fastidiosa via pilus-driven twitching motility. J. Bacteriol. 187, 5560-5567 (2005).
- Li, Y., et al. Type I and type IV pili of Xylella fastidiosa affect twitching motility, biofilm formation and cell-cell aggregation. Microbiology. 153, 719-726 (2007).
- Simpson, A. J. G., et al. The genome sequence of the plant pathogen Xylella fastidiosa. Nature. 406, 151-157 (2000).
- Maier, B., Potter, L., So, M., Long, C. D., Seifert, H. S., Sheetz, M. P. Single pilus motor forces exceed 100 pN. Proc. Natl. Acad. Sci. USA. 99, 16012-16017 (2002).
- Touhami, A., Jericho, M. H., Boyd, J. M., Beveridge, T. J. Nanoscale characterization and determination of adhesion forces of Pseudomonas aeruginosa pili by using atomic force microscopy. J. Bacteriol. 188, 370-377 (2006).
- Skerker, J. M., Berg, H. C. Direct observation of extension and retraction of type IV pili. Proc. Natl. Acad. Sci. USA. 98, 6901-6904 (2001).
- Brown, D. C., Larson, R. S. Improvements to parallel plate flow chambers to reduce reagent and cellular requirements. BMC Immunol. 2, 9 (2001).
- Thomas, W. E., Nilsson, L. M., Forero, M., Sokurenko, E. V., Vogel, V. Shear-dependent 'stick-and-roll' adhesion of type 1 fimbriated Escherichia coli. Mol. Microbiol. 53, 1545-1557 (2004).
- Thomas, W. E., Trintchina, E., Forero, M., Vogel, V., Sokurenko, E. V. Bacterial adhesion to target cells enhanced by shear force. Cell. 109, 913-923 (2002).
- Bahar, O., Fuente, D. L., Burdman, S. Assessing adhesion, biofilm formation and motility of Acidovorax citrulli using microfluidic flow chambers. FEMS Microbiol. Lett. 312, 33-39 (2010).
- Thomas, W. E. Using a laminar flow system to explain shear-enhanced bacterial adhesion. Proceedings of ICMM2005, Third International Conference on Microchannels and Mini-channels. Toronto, Ontario, Canada, , 751-759 (2005).
- Fuente, D. L., et al. Assessing adhesion forces of type I and type IV pili of Xylella fastidiosa bacteria by use of a microfluidic flow chamber. Appl. Environ. Microbiol. 73, 2690-2696 (2007).
- DeLange, P. A., Collins, T. L., Pierce, G. E., Robinson, J. B. PilJ localizes to cell poles and is required for type IV pilus extension in Pseudomonas aeruginosa. Curr Microbiol. 55, 389-395 (2007).
- Fuente, D. L., Burr, T. J., Hoch, H. C. Mutations in type I and type IV pilus biosynthetic genes affect twitching motility rates in Xylella fastidiosa. J. Bacteriol. 189, 7507-7510 (2007).
- Ferandez, A., Hawkins, A. C., Summerfield, D. T., Harwood, C. S. Cluster II che genes from Pseudomonas aeruginosa are required for an optimal chemotactic response. J. Bacteriol. 184, 4374-4383 (2002).
- Cursino, L., et al. Identification of an Operon, Pil-Chp, That Controls Twitching Motility and Virulence in Xylella fastidiosa. Mol. Plant Microbe Interact. 10, 1198-1206 (2011).
- Hazelbauer, G. L., Falke, J. J., Parkinson, J. S. Bacterial chemoreceptors: High-performance signaling in networked arrays. Trends Biochem. Sci. 33, 9-19 (2008).
- Costa, H. S., et al. Plant hosts of Xylella fastidiosa in and near southern California vineyards. Plant Dis. 88, 1255-1261 (2004).
- Shi, X. Y., Dumenyo, C. K., Hernandez-Martinez, R., Azad, H., Cooksey, D. A. Characterization of regulatory pathways in Xylella fastidiosa: genes and phenotypes controlled by algU. Appl. Environ. Microbiol. 73, 6748-6756 (2007).
- Matsumoto, A., Young, G. M., Igo, M. M. Chromosome-Based Genetic Complementation System for Xylella fastidiosa. Appl. Environ. Microbiol. 75, 1679-1687 (2009).
- Davis, M. J., Purcell, A. H., Thomson, S. V. Isolation Media for the Pierce's Disease Bacterium. Phytopathology. 70, 425-429 (1980).
- Xia, Y. N., Whitesides, G. M. Soft lithography. Annu. Rev. Mater. Sci. 28, 153-184 (1998).
- Chaudhury, M. K., Whitesides, G. M. Direct measurement of interfacial interactions between semispherical lenses and flat sheets of poly-(dimethylsiloxane) and their chemical derivatives. Langmuir. 7, 1013-1025 (1991).
- Cruz, L. F., Parker, J. K., Cobine, P. A., De La Fuente, L. Calcium-enhanced twitching motility in Xylella fastidiosa is linked to a single PilY1 homolog. Appl. Environ. Microbiol. 80, 7176-7196 (2014).



