Summary
Бактериальные клетки пространственно высокоорганизованной. Следовать этой организации со временем в медленно растущих клетках Myxococcus xanthus , была разработана установка для флуоресценции клеток изображений с высоким разрешением пространственно-временных течение нескольких поколений. С помощью этого метода, может быть определена динамика пространственно-временных важных белков для хромосома сегрегации и деление клеток.
Abstract
Флуоресценции клеток изображений бактериальных клеток является ключевым методом анализа пространственной и временной динамики белков и хромосом, лежащие в основе центральной клеточного цикла событий. Однако визуализации этих молекул в медленно растущие бактерии представляет вызов из-за Фотообесцвечивание флуорофоров и Фототоксичность во время захвата изображений. Здесь мы опишем простой протокол для обхода этих ограничений в случае Myxococcus Ксанф (который имеет время поколения 4-6 ч). С этой целью м. xanthus клетки выращивают на толстый блокнот содержащих питательный агар в влажной среде с контролируемой температурой. В этих условиях мы определяем время удвоения отдельных ячеек, следуя роста одиночных клеток. Кроме того ключевым сотовых процессы, такие, как хромосомы сегрегации и деление клеток может быть imaged у Вообразимый флуоресценции клеток клеток, содержащих соответствующие дневно обозначенные маркер белки, например САПИ-рекламы ЯФП, FtsZ-GFP и mCherry-PomX над несколькими Мобильный циклов. Впоследствии приобретенные изображения обрабатываются, чтобы создавать фотомонтажи и/или фильмы.
Introduction
Бактериальные клетки пространственно высокоорганизованной многие белки, локализация асимметрично в пределах сотовой отсеков1,2,3,4. Эта локализация часто является очень динамичным и изменяется с течением времени в ответ на сигналы клеточного цикла или внешние сигналы. Одинаково бактериальной хромосомы пространственно высоко организованной с отдельных локусах, позиционируется в определенных местах субцеллюлярные до и во время сегрегации процесс5. Этот динамический пространственной организации имеет важное значение для роста, отдела, регуляции клеточного цикла, дифференциация, моторики, трансдукции сигнала, а также хромосомы Организации и сегрегации; Таким образом она затрагивает практически все аспекты бактериальных функции.
Пространственно-временных динамику этих клеточных процессов анализируются в целый ряд различных видов бактерий с кишечной палочки, Сенная палочка, холерный вибриони Caulobacter crescentus , выступающей как важный Модельные организмы. Однако эти четыре вида охватывают лишь небольшой спектр огромного разнообразия бактериальных и, возможно неудивительно учитывая большой филогенетических расстояние между этими видами, клеточных механизмов Организации и поляризации отличаются в этих бактерии. Это вызывает необходимость изучения дополнительных видов бактериальных сможет в конечном итоге извлечь общие принципы, лежащие в основе пространственно-временных динамика бактериальных клеток.
Грамотрицательные Дельта proteobacterium м. xanthus модельный организм в изучении социального поведения и сотрудничество в бактерии6. М. xanthus является строго аэробные и присутствии питательных веществ, он образует колоний, в которых клетки распространились наружу в высоко скоординированных, кишат моды и жертв других микроорганизмов7. В ответ на питательных голода, клетки инициировать программу развития, которая приводит к образованию плодовые тела, который состоит из тысяч клеток и внутри, подвижные клетки палочковидные дифференцировать до сферической диплоидные споры8. Оба типа поведения, т.е., роения и формирования плодовые тела, выполняются только на клетки, которые находятся на твердой поверхности. Кроме того оба питательных условиях клетки участвовать в процессах, которые включают прямые ячеек контактов, включая обмен липопротеинов внешней мембраны, которые могут стимулировать моторику или функционировать как токсины в получателя9,10 , Обмен LPS11, стимуляция моторики, экзополисахаридов на соседние клетки12и межклеточной сигнализации ячейки поверхности якорь сигнализация белка13,14.
Недавно м. xanthus также стал модельный организм для изучения механизмов базового моторики и его регулирование15, деление клеток16,17,18и хромосомы организации19 ,,2021. Критические шаги в м. xanthus клеточного цикла были проанализированы в деталях микроскопии флуоресцирования, используя-снимок изображения или короткий промежуток времени записи на штаммы, перевозящих соответствующих дневно обозначенные протеины16, 17,18,19,20. В идеале многие клетки следует использовать с одной ячейкой резолюции живой клеткой флуоресценции изображений для по крайней мере один полный цикл клетки для получения надежных количественных данных о параметрах клеточного цикла. Однако, это вызов в м. xanthus благодаря его время относительно долго поколения 4-6 ч при стандартных лабораторных условиях и Фотообесцвечивание флуорофоров и Фототоксичность во время захвата изображений.
Здесь мы описываем протокол следовать м. xanthus клетки с одной ячейке резолюции флуоресценции клеток изображений для по крайней мере 24 часа и охватывает несколько циклов клеток. Важно отметить, что во время всего протокола, клетки ведутся на площадку агар и в тесном контакт, позволяя для контакта зависимой деятельности существенно важное значение для социальной жизни стиль м. xanthus. Протокол также позволяет пользователям монитор форму, размер, отделов и флуоресцентных зондов с высоким временным разрешением и с резолюцией одну ячейку и таким образом, позволяет количественная оценка изменчивости в ячейке и корреляции событий клеточного цикла.
Protocol
1. Подготовка и рост м. xanthus штаммы
Примечание: См. в таблице 1 и таблице 2.
- Подготовка 1% casitone бульон (СТТ) рост средних 1% (w/v) поджелудочной железы дайджест казеина (например, Bacto casitone), 10 мм трис-HCl рН 8,0, 1 мм х2PO4 рН 7,6, 8 мм4MgSO22, дополнена канамицин (50 мкг/мл) или Окситетрациклин (10 мкг/мл). Добавить гентамицина (10 мкг/мл) для всех средств массовой информации для снижения риска загрязнения с другими бактериями, поскольку м. xanthus клетки естественно устойчивы к нему.
- Прививать 5 мл 1% СТТ, содержащие соответствующие antibiotic(s) с одной свежезаваренным выращенных колонии диких типа DK1622 (WT) 23, SA4420 (Δмгла)24, SA4797 (Δмгла, ΔpomX/ppomZ mCherry-pomX )16, SA8241 (Δмгла, ftsZ+/pnatftsZ-gfp), или SA4749 (Δмгла, САПИ+/pnatСАПИ-рекламы ЯФП) в утром первого дня.
- Ресуспензируйте единый м. xanthus колонии в 500 мкл 1% CTT дополнена антибиотиков в стерильную пробирку и передать 50 мл колбу Эрленмейера, содержащих по 5 мл 1% всей подвески СТТ.
Примечание: Используйте колбу Эрленмейера объемом 10 раз культуры гарантировать достаточную aeriation и оптимального роста.
- Ресуспензируйте единый м. xanthus колонии в 500 мкл 1% CTT дополнена антибиотиков в стерильную пробирку и передать 50 мл колбу Эрленмейера, содержащих по 5 мл 1% всей подвески СТТ.
- Вырастить клетки для восьми поколений (приблизительно 40-48 h с временем поколения 4-6 ч) при температуре 32 ° C, пожимая на 220 rpm, в темноте. Сохранить клетки в фазы экспоненциального роста (ОД550 < 1.2) и предотвращения их от достижения неподвижной фазой. При необходимости разбавить клетки в свежие 1% CTT носитель, содержащий соответствующие antibiotic(s) ОД550 0.1 - 0.2.
Примечание: Оптимальный ОД550 для одной ячейки микроскопии — 0,5 - 0,7. На этом ОД550достаточное количество клеток присутствует на изображение, чтобы дать количественную оценку, а также статистический анализ клеточных параметров.
2. Подготовка микроскопия образцов
Примечание: Клетки должен быть видимым для микроскопии на Микроскоп coverslip и затем покрыть площадку агарозы, содержащие питательные вещества. Coverslip приклеивается к пластиковый или металлический каркас для обеспечения механической поддержки. В рамках подготовки для микроскопии большой pad 1% agarose/TPM/0.2% СТТ должны быть готовы заранее, как описано в шагах 2.1-2.3. Также обратитесь к Таблице материалов для конкретных продуктов, используемых здесь.
- Подготовка 500 мл буфера TPM (рН 7,6, 1 мм х2PO4 рН 7,6, MgSO 8 мм410 мм трис-HCl) и автоклаве или фильтр стерилизации с помощью фильтра Топ бутылку.
Примечание: Стерильные буфер может храниться несколько месяцев при комнатной температуре. - Приготовляют раствор микроскопии агарозы 1%, содержащие 0,2% CTT (микс 1 g агарозы с 80 мл буфера TPM и 20 мл 1% CTT среды). Нагреть в микроволновой печи до тех пор, пока агарозы расплавленного.
Примечание: 0,2% CTT является достаточным, чтобы позволить клетки растут и предотвращения голода. Более высокие концентрации СТТ в среде микроскопии приведет к высокой фоновой флуоресценции. - Заполните чашку Петри с расплавленной агарозы до толщины 0,5 см (для площади 11.5 x 11.5 см Петри, примерно 60 мл расплавленного агарозы требуется) и дайте ему остыть до комнатной температуры.
Примечание: Панель агарозы могут храниться при температуре 4 ° C во влажной среде до 2 дней.- Предварительно теплой CTT pad 1% agarose/TPM/0.2% на 32 ° C, по крайней мере 15 минут до использования.
Примечание: Чтобы подготовить клетки для микроскопии, выполните шаги 2.4-2.8.
- Предварительно теплой CTT pad 1% agarose/TPM/0.2% на 32 ° C, по крайней мере 15 минут до использования.
- Место стерильных стеклянных coverslip (60 x 22 мм, толщина: 0,7 мм) на пластиковый или металлический кадр, который имеет отверстие в середине (рис. 1А); Этот кадр служит механической опорой для тонких coverslip и помогает уменьшить дрейф при микроскопии. Исправьте coverslip к раме с лентой.
- Для подготовки кадров, вырезают рамку 75 мм × 25 мм от металлической пластине толщиной 1 мм, а затем вырезать отверстие нужного размера (20 × 30 мм в этом эксперименте) в середине.
- Добавить 10-20 мкл экспоненциально вырос м. xanthus клеток на coverslip.
- Добавьте флуоресцентные 0,5 мкм микросферы в качестве фидуциальный маркеров клеток, чтобы упростить отслеживание ячеек или белков в промежуток времени записи.
- Разбавьте 1: 100 микросфер в буфере TPM и хранить при 4 ° C до нескольких месяцев. Перед использованием тщательно встряхнуть и добавить 5-10 мкл разбавленного микросфер в клетки.
Примечание: Здесь микросферы, флуоресцентные в всех общих синий, зеленый, желтый и красный, флуоресцентный каналы были использованы.
- Разбавьте 1: 100 микросфер в буфере TPM и хранить при 4 ° C до нескольких месяцев. Перед использованием тщательно встряхнуть и добавить 5-10 мкл разбавленного микросфер в клетки.
- Вырежьте небольшой блокнот примерно размер coverslip большой подогретым 1% agarose/TPM/0.2% СТТ pad и поместите его на верхней части клетки (рис. 1Б). Место coverslip на вершине 1% agarose/TPM/0.2% СТТ агарозы площадку для предотвращения испарения и поддержания клеток во влажной среде.
Примечание: Только coverslip предотвратит значительного испарения для минимум 2 ч. Для больше покадровой записи 1% agarose/TPM/0.2% СТТ pad и coverslip сэндвич должны быть запечатаны с парафином пленкой для предотвращения испарения. - Инкубируйте микроскопия образцов на 32 ° C в течение 15-20 минут прикрепить к нижней части панели агарозы клетки. Затем запустите покадровой микроскопии записей.
3. Микроскоп Set-up и промежуток времени приобретения
Примечание: Для Перевернутый widefield микроскопом с автофокусом, 100 X был разработан протокол, описанные здесь / 1,30 NA масло PH3 цель, X, Y моторизованные стадии, sCMOS камеру, источник света, фильтры для Грин люминесцентные, красный люминесцентные или желто люминесцентные протеины и температуре под контролем Палаты инкубации. Эта камера сохраняет клетки защищены от света и при постоянной температуре.
- Нагрейте зале инкубации и микроскопа до 32 ° C ~ 1-2 ч до начала микроскопии.
Примечание: В зависимости от настройки Микроскоп, Отопление может занять больше времени. Подогрев существенно сократить дрейфа и стабилизирует автофокусом системы управления. - Переключиться на микроскопе и запустить программное обеспечение управления микроскопом. Выберите правильные цели и правильный зеркала и фильтры, чтобы приобрести фазы контрастность изображения, а также образы Грин люминесцентные, красный люминесцентные или желто флуоресцентные белки.
Примечание: Обычно микроскоп поставляется с предпочтительным программным обеспечением для управления и изображений приобретение микроскопа. Здесь коммерчески доступного программного обеспечения (см. Таблицу материалов) был использован для управления приобретение микроскопа и изображения. - Добавить каплю масла высокого качества погружения на линзу цели и в нижней части образца, предварительно инкубируют при температуре 32 ° C. Разместите цель в низком возможных-позиции Z во избежание повреждения объектива, когда образец помещается на микроскопа. Место металл рама с образца на сцену микроскоп и «отверстие стороне» к цели. Надежно закрепите образца в держателе стадии.
- Фокус на клетки, перемещая сцене в Z-направлении ближе к цели. Двигаться медленнее стадии, когда нефть падает на нижней стороне образца и объектива сделать контакт. Переместить сцену в X / Y направлении до нескольких единичных клеток являются видимыми в регионе зрения, когда клетки находятся в фокальной плоскости. Убедитесь, что, по крайней мере один флуоресцентные микросфер в регионе зрения чтобы позднее согласовать полученные изображения.
Примечание: При оптимальных условиях, должна быть достигнута плотность клеток 15-30 ячеек каждого региона (2048 x 2048 пикселей или 133.1 x 133.1 мкм). - Открытие мастера Многомерного приобретения программного обеспечения управления микроскопом создать эксперимент промежуток времени, который позволяет Микроскоп, чтобы получить изображения на нескольких длинах волн и стадии позиции, если требуется.
- На вкладке Главная активируйте Timelapse и Нескольких длинах волн. В левой части окна появятся дополнительные вкладки.
- Нажмите на вкладку Сохранение и Выбор каталога выберите пустую папку на жестком диске компьютера сохранить полученные изображения. Активируйте приращения базовое имя, если файл существует , чтобы убедиться, что последовательных наборов данных не перезаписывают предыдущие. Затем назовите эксперимент с Дата и штамм имя или название эксперимента.
- Нажмите на вкладку Timelapse , чтобы настроить промежуток времени параметров. Установить Продолжительность до 24 ч и задать Интервал времени до 20 мин. Число моментов времени изменится автоматически.
Примечание: Оптимальный интервал времени зависит от эксперимента и клеточную функцию для анализа. Часто изображения приобретений может привести к Фотообесцвечивание. Таким образом компромисс между временным разрешением и Фотообесцвечивание должны быть найдены эмпирически. Удвоение одновременно 4-6 ч изображения могут быть легко приобретены с интервалом 5 минут (или даже меньше интервалов при необходимости) для фазово-контрастной микроскопии. Если микроскопии флуоресцирования течение времени-24 h желаемого изображения должны быть записаны с интервалом примерно 15-30 мин. - Нажмите на вкладку длин волн выберите количество волн приобретать для каждого изображения в каждой точке времени, изменив число.
Примечание: для каждой длины волны, появится новая вкладка на левой стороне многомерного приобретение « Мастер и длин волн будут приобретаться в порядке сверху вниз. Для каждой длины волны приобретение параметры можно изменять отдельно. - Щелкните вкладку первой волны от вершины. Выберите в раскрывающемся списке освещения фазового контраста. Выберите 100 мс для экспозиции и Время каждый пункт в раскрывающемся списке приобретать . Отключите Автоматическое разоблачить никогда , выбрав в раскрывающемся списке.
- Повторите шаг 3.5.5 для каждой длины волны, которая должна быть приобретены в каждый момент времени. Для экспериментальной установки и дневно обозначенные протеины описано здесь, используйте следующие параметры для воздействия: 250 мс для mCherry синтез белков, 200 мс для рекламы ЯФП синтез белков и 1000 мс для GFP синтеза белков.
Примечание: Настройки оптимального освещения для каждого штамма и флуоресцентный белок должны определяться заранее путем изменения интенсивности лампы и время приобретения изображения для каждой длины волны. Слишком долго изображения приобретение раз увеличит фототоксических эффект и в конечном итоге привести к росту арест и клеток смерти. Таким образом должен быть достигнут компромисс между изображения качества и клеток жизнеспособности. - Получение изображений с нескольких позиций стадии увеличить количество клеток, записан в том же эксперимент.
- Чтобы получить изображения с нескольких позиций, стадии, активируйте Несколько стадии позиции на вкладке Главная . Затем нажмите на вкладку стадии и нажмите кнопку Live , чтобы взглянуть на поле зрения.
- Переместите сцену в X/Y-направлении региона интерес (ROI) находится в поле зрения. Сохранить X - и Y-координаты, нажав «+» в закладке стадии этапа снова двигаться в X/Y-направлении пока не будет найден новый ROI и сохранить координаты снова, нажав «+». Продолжайте до тех пор, пока сохраняется требуемое количество регионов.
Примечание: В случае приобретения флуоресценции изображения, убедитесь, что регионы интереса (ROI) являются не слишком близко к друг другу, чтобы свести к минимуму Фототоксичность.
- Проверьте еще раз, что клетки находятся в фокусе, нажав на различные сохраненные X - и Y-позиции и начать оборудования автофокусом, нажав АФК удерживайте держать сохраненные позиции Z постоянной в течение эксперимента.
- Старт покадровой записи программного обеспечения управления микроскопом, нажав приобретать в мастере Многомерного приобретения .
Примечание: Одно окно для каждой длины волны, которая приобретается и дополнительное окно появится, показывающий количество приобретенных время точек и отрезок времени до следующего приобретения картину. - Убедитесь, что клетки по-прежнему в центре внимания после первых нескольких время очки в покадровой записи для максимального качества изображения и переориентировать при необходимости.
4. поколение покадровой фильмов и выравнивание изображения
Примечание: Некоторые коммерческие и бесплатные программные пакеты доступны для захвата изображений и анализа изображений. Мы используем коммерчески доступного программного обеспечения (см. Таблицу материалы) с несколько предустановленных плагинов и дополнительные инструменты.
- Сохранение отдельных изображений от покадровой записи на компьютере установлено программное обеспечение анализа/обработки изображений.
- Запустите программу и откройте изображения как стек, нажав Обзор многомерных данных | Выберите базовый файл | Выберите каталог. Откройте папку с многомерных данных. Проверка набора данных и нажмите кнопку Просмотр; набор данных будет показан как отдельные изображения, время от времени один до конца. Активировать волны (для создания стека), выберите все изображения, которые должны быть в стеке и нажмите кнопку Загрузка изображений. Повторите этот шаг для всех длин волн и сохранить заполненные стеки.
- (Необязательно) Открыть все изображения, необходимых для фильма, с помощью файла | Открытые.
Примечание: Рекомендуется для открытия изображения, один из приобретенных волны одновременно, чтобы не замедлить компьютер если вычислительной мощности ограничен. Если некоторые части покадровой записи, например, начало, конец или несколько моментов времени должны быть пропущены, то это может быть изменено в завершенных кино. - Активируйте стек изображений, которые необходимо исправить для дрейфа. Откройте инструмент выравнивания, Apps | Автоматическое выравнивание... Проверка стека как источник для изображения и впервые плоскости точку плоскости отсчета. Выберите стек с кнопкой источник стека и нажмите кнопку Применить.
Примечание: Автоматическое выравнивание займет некоторое время и вычислительной мощности, но является хорошим способом исправить большие стеки для дрейфа Микроскоп set-up. Это автоматическое выравнивание работает хорошо, если микросферы включены, но может также работать и без них. - Сохраните соответствие стека.
- Используйте ROIs.
Примечание: Флуоресцентной микроскопии покадровой легко создает большие наборы данных файлов, которые занимают много вычислительной мощности и замедлить глубокой переработкой этих фильмов. Поэтому мы настоятельно рекомендуем для выявления трансформирования и изолировать клетки для работы с небольшими файлами.- Выберите инструмент « Прямоугольная область ». Создайте ROI вокруг клетки интереса, вручную рисования ROI на этапе контраст изображения. Убедитесь, что клетки интереса являются видимыми и в центре внимания на протяжении всей промежуток времени фильма.
- Откройте покадровой фильм второй волны того же набора данных. Передать флюоресценция ROI от фазы контраст изображения изображения второй волны используйте средство Передачи регионы с регионы | Передачи регионов. Выберите набор данных контраст фазы Исходного изображения , а второй волны dataset в виде Образа назначения. Выберите Все регионы и нажмите кнопку ОК.
- Повторите шаг 4.6.2 для каждой длины волны, приобретенных для того же набора данных.
- Выберите ROI и дублировать его как в стеке с Edit | Дублировать | Стек... или нажмите клавиши Shift + Ctrl + D . Затем сохранить повторяющиеся стека с файл | Сохранить в ту же папку исходных данных.
- Повторите шаг 4.6.4 для каждого ROI каждой длины волны, приобретенных для того же набора данных
- Чтобы создать фильм в формате AVI или MOV, открыть функцию Сделать фильм через стек | Сделать фильм. Выберите промежуток времени записи с кнопкой Источник стека . Выберите формат вывода, частота кадров, количество кадров и нажмите кнопку сохранить.
Representative Results
М. xanthus это медленно растущая бактерия, которая перемещает на твердых поверхностях. Чтобы протестировать наши экспериментальные установки, мы провели покадровый эксперимент с подвижные клетки DK1622 WT. Фаза контрастность изображения были приобретены с интервалом 5 минут 24 h (рис. 2A, B). Большинство клеток выровнены в группах. Как и ожидалось, клетки отображаются моторики и преимущественно переехал в группах. Мы далее отметил, что клетки иногда вспять направление движения. Эти результаты показывают, что WT клеток в условиях испытания ведут себя нормально с точки зрения подвижности клеток. Однако даже когда клетки записываются каждые 5 мин, идентификации отдельных клеток трудно. Кроме того потому что клетки подвижные, многие клетки бежать или введите поле зрения, что делает его трудно следовать клетки для продолжительных периодов времени.
Для того, чтобы проследить то же м. xanthus клетки для нескольких раундов клеточного цикла, клеток, отдельные штаммы могут быть удалены для мгла ген, который имеет важное значение для подвижности25. Это предотвращает перемещение из поля зрения при визуализации протокола клетки. В кадр удаления создаются как описано Ши и др. 26
Как и ожидалось, в фазе контраст клеток изображений с не подвижные Δмгла клеток (рис. 3), клетки не показало активные движения. Мы были в состоянии следить за рост и деление отдельных клеток во время формирования microcolony. Основываясь на покадровой записи, в которых изображения были приобретены с интервалом 5 минут, 24 часа, можно было дать количественную оценку interdivision время (время между двумя событиями деление клеток) с одной ячейке резолюции. Клетки мутантамгла Δ успел Межучрежденческого отдела 235 ± 50 мин (n = 97 клетки). С приблизительно 4 ч interdivision время похож на удвоение время, измеренное в подвеска культур клеток WT. Это обеспечивает доказательства того, что м. xanthus клетки растут оптимально в этих экспериментальных условиях.
Для расследования, позволяет ли наша клетки, чтобы нормально расти отслеживая помечены рекламы ЯФП белки в течение длительного периода времени, мы провели флуоресценции покадровой изображений с м. xanthus клетки, которые выражают протеин тегами рекламы ЯФП. С этой целью мы следовали САПИ-рекламы ЯФП как отметка о происхождении репликации (Ори). САПИ является как компонент системы ПарабS в м. xanthus и привязывает к сайтам Парс проксимальнее Ори; Таким образом дублирования и хромосомы сегрегации происхождения может быть после19,,2021. С Видеосъемка (Фазовый контраст и флуоресценции, 200 мс приобретение время в канале рекламы ЯФП) каждые 20 мин, клетки выросли, разделены и отображается роста даже в 24 ч (рис. 4A). В начале записей САПИ-рекламы ЯФП сформированы две группы в приполярных регионах в большинстве клеток (рис. 4A). Незадолго до или после деления клеток Приполярный САПИ-рекламы ЯФП кластера на старых клеток полюс дублируется. Один из двух кластеров оставался на старых клеток полюс во время второй копии перемещен на новый полюс клеток, достигнув своей окончательной позиции приполярных после примерно 40-60 мин (рис. 4A, B). Эти наблюдения согласуются с предыдущих данных, сформированных из короткий промежуток времени записи, используя тонкие агар колодки19. Мы заключаем, что эта экспериментальная установка позволяет покадровой микроскопии флуоресцирования для отслеживания хромосомы сегрегации в течение нескольких циклов клеток в медленный рост м. xanthus клеток, без отмерена рост клеток или механизмы сегрегации хромосомы.
Аналогичный эксперимент мы стремились следовать маркеры для деления клеток покадровой флуоресцентной микроскопии. Похож на почти всех других бактерий, м. xanthus требует FtsZ, бактериальный ГТФазы тубулин как, для деления клеток16,17,18. FtsZ формирует структуру кольцо как на midcell, так называемая Z-кольцо, которая помогает привлечь всех других белков, необходимых для клеточного деления27,28. В м. xanthus, формирование Z-кольцо и его позиционирования на midcell стимулируется три PomXYZ белки16,17. Эти три белки образуют комплекс, связанные хромосомы, который передает через nucleoid с сайта клеточного деления в ячейке «мать» в середине nucleoid в двух клетках дочь. В середине nucleoid совпадает с midcell, до хромосома сегрегации и здесь PomXYZ комплекс новобранцев FtsZ и стимулирует формирование Z-кольцо.
Здесь мы сначала последовали за не подвижные клетки, выражая ftsZ-gfp. Потому что FtsZ-GFP общий слабее флуоресценции сигнал чем САПИ-рекламы ЯФП, мы увеличили время экспозиции 5 раз показывает 1 s в канале GFP. Как и ожидалось, сильное накопление FtsZ-GFP наблюдалось только в midcell и этой локализации продиктовал положение деления клеток сужения (рис. 5A). FtsZ-GFP преимущественно сформирован кластер на midcell в клетке дольше. Было также очевидно, что этот кластер увеличение интенсивности с течением времени. После деления клеток мы наблюдали, что FtsZ-GFP повторно накопленных на midcell в двух дочь клетки примерно 2 h позже (рис. 5B). Это согласуется с выводом, что примерно 50% клеток в популяции отображения FtsZ локализации на основе анализа снимок16,17midcell.
В втором эксперименте мы следовали за не подвижные Δмгла клеток для 24 h, которые выражают mCherry-pomX. В рамках системы PomXYZ PomX помогает направлять Z-кольцо формирования и позиционирования, тем самым стимулируя деление клеток в midcell16. Флуоресценции сигнал mCherry-PomX сильна и позволяет время экспозиции в канале флуоресценции 250 г-жа важно, все клетки увеличился в размерах и отображается событие деление клеток в течение эксперимента, образуя microcolonies после 24 ч ( Рисунок 6A). Как сообщалось ранее,16почти все клетки содержат mCherry-PomX кластер. Большинство из них локализованы в midcell и кластеров от midcell, перемещен к midcell в ходе эксперимента. Во время клеточных делений mCherry-PomX кластеры были разделены, с каждой ячейкой дочь получает кластера. В отличие от FtsZ-GFP mCherry-PomX локализованы в midcell 80-90% клеточного цикла и достиг этой позиции вскоре после деления клеток (рис. 6B).
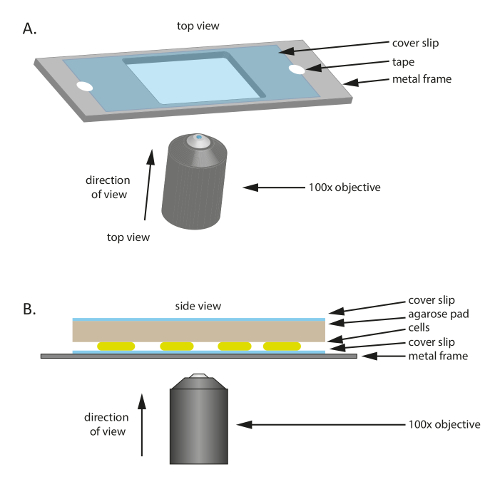
Рисунок 1 : Схема экспериментальной установки, используемые в настоящем исследовании. (A) A металл или пластик кадр служит опорой для образца. Coverslip крепится к металлической раме с лентой, чтобы уменьшить движение образца. (B) сторона вид set-up экспериментальный образец. Клетки монтируются на coverslip, показано в (A). Агарозы площадку, которая поставляет питательные вещества и влажности в клетках помещается на верхней части клетки. Агарозы колодки покрыта дополнительные coverslip для уменьшения испарения. Для высокого качества изображения используется 100 X нефти погружения фазы контраст цель. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Фаза контраст покадровой микроскопии WT м. xanthus клетки. Клетки были последовал за 24 часа и изображения были приобретены каждые 5 минут (A) показаны представителя изображения же поле зрения каждые 5 мин. Цветные стрелки указывают направление движения отдельных клеток. Тот же цвет знаменует ту же ячейку с течением времени. Цифры показывают время в минутах. Линейки: показаны 5 мкм. (B) изображения же поле зрения после каждый час. Обратите внимание, что показан тот же поле зрения, но потому, что клетки двигаются, клетки постоянно въезде и выезде из поля зрения. Цифры показывают время в часах. Линейки: 5 мкм. PH: фаза контраст. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3 : Фаза контраст покадровой микроскопия не подвижные м. xanthus клетки. Δмгла клетки последовали за 24 ч. изображения были приобретены каждые 5 мин и показаны представитель изображений после каждый час. Выбранный деление клеток перетяжек отмечены оранжевые стрелки. Цифры показывают время в часах. PH: Фазовый контраст. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
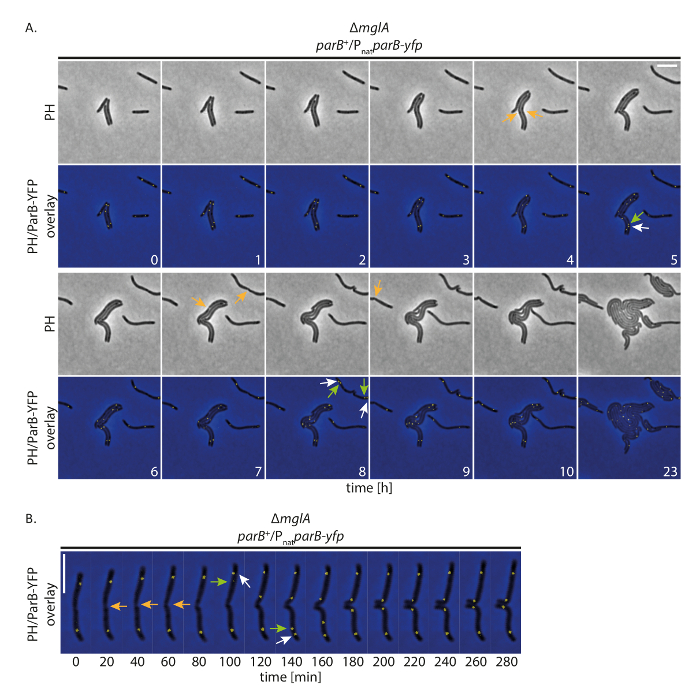
Рисунок 4 : Промежуток времени микроскопии флуоресцирования САПИ-рекламы ЯФП в не подвижные м. xanthus клеток. Клетки Δмгла мутантвыражая САПИ-рекламы ЯФП присутствии родной САПИ (SA4749; Δмгла; САПИ +/PnatСАПИ-рекламы ЯФП) последовал этап контраст и флуоресцентной микроскопии за 24 ч. (A) изображения были приобретены каждые 20 мин и представитель изображений каждый час до 10 h показываются вместе с те же клетки после 24 ч. изображения отображаются в Фазовый контраст (PH) и как наложение фазового контраста и рекламы ЯФП сигнала. Выбранные ячейки дивизий, помечены оранжевые стрелки. Белые и зеленые стрелки указывают САПИ-рекламы ЯФП кластера дублирования мероприятий, с зеленой стрелки маркировки translocating кластер. Цифры показывают время в часах. Линейки: 5 мкм. (B) изображения были приобретены как (A), но отображаются с высоким временным разрешением. Цифры показывают время в минутах. Стрелки, как (A). Линейки: 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Покадровый микроскопии флуоресцирования по FtsZ-ГФП в не подвижные м. xanthus клетки. Клетки Δ мутантмгла , выражая ftsZ ГФП в присутствии родной ftsZ (SA8241; Δмгла; ftsZ +/PnatftsZ-gfp) последовал этап контраст и флуоресцентной микроскопии за 24 ч. (A) изображения были приобретены каждые 20 мин и представитель изображений каждый час до 10 h показываются, вместе с те же клетки после 24 ч. изображения показаны в Фазовый контраст (PH) и как оверлей фазового контраста и GFP сигнала. Выбранные ячейки дивизий, помечены оранжевые стрелки. Белые стрелки указывают FtsZ-GFP кластеров на midcell. Цифры показывают время в часах. Линейки: 5 мкм. (B) изображения были приобретены как (A), но отображаются с высоким временным разрешением. Цифры показывают время в минутах. Зеленые и белые стрелки Марк FtsZ-GFP кластеров в левой и правой ячейки, соответственно. Оранжевые стрелки указывают клеточных делений. Линейки: 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Покадровый микроскопии флуоресцирования mCherry-PomX в не подвижные м. xanthus клетки. Non подвижные ΔpomX клетки накапливают mCherry-PomX (SA4797; Δмгла; ΔpomX/ppomZ mCherry-pomX) для 24 h последовал этап контраст и флуоресцентной микроскопии каждые 20 минут (A) представитель изображения показываются каждый час до 10 h, вместе с те же клетки после 24 ч. изображения показаны в Фазовый контраст (PH) и как оверлей фазового контраста и mCherry сигнал. Выбранные ячейки дивизий, помечены оранжевые стрелки. Белые и зеленые стрелки указывают mCherry-PomX кластеров до и после разделения события, соответственно. Цифры показывают время в часах. Линейки: 5 мкм. (B) изображения были приобретены как (A) и отображаются с высоким временным разрешением. Стрелки, как (A). Линейки: 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Бактериальный штамм | Соответствующие генотипа1 | Ссылка |
| DK1622 | Wildtype | 23 |
| SA4420 | Δмгла | 24 |
| SA4749 | Δмгла; САПИ+/attB:: PnatСАПИ-рекламы ЯФП (pAH7) | Это исследование |
| SA4797 | Δмгла; ΔpomX / attB::PpomZ mCherry-pomX (pAH53) | 16 |
| SA8241 | Δмгла; ftsZ+/ mxan18-19::PnatftsZ-gfp (pDS150) | Это исследование |
| Плазмид в скобках содержат указанные гена сплавливания и были интегрированные на указанных участках генома. Плазмиды интегрированы на сайте attB или mxan18-19 intergenic региона были высказаны от их родные промоутер (Pnat) или родной промоутер pomZ (pomZP). |
||
Таблица 1: Список бактериальных штаммов, используемые в данном исследовании.
| Плазмиды | Соответствующие характеристики | Ссылка |
| pAH7 | PnatСАПИ-рекламы ЯФП; Mx8 attP; ТетR | 19 |
| pAH53 | PpomZ mCherry-pomX; Mx8 attP ; КмR | 16 |
| pDS150 1 | PnatftsZ-gfp ; mxan18-19 ; ТетR | Это исследование |
| pMR3691 | Плазмиды для экспрессии генов vanillate индуцибильный | 18 |
| pKA51 | PnatftsZ-gfp ; Mx8 attP; ТетR | 17 |
| 1 pDS150: pDS150 является производным от pKA51, в котором Mx8 attP сайт был заменен на mxan18-19 intergenic региона. Для этого mxan18-19 intergenic региона был усилен от pMR3691 с праймерами, Mxan18-19 fwd BsdRI (GCGATCATTGCGCGCCAGACGATAACAGGC) и Mxan18-19 BlpI (GCGGCTGAGCCCGCGCCGACAACCGCAACC) и клонированных в pKA51. |
||
Таблица 2: Список плазмид, используемые в данном исследовании.
Discussion
Флуоресценции клеток изображений стала мощным инструментом для изучения динамики пространственно-временных бактериальных клеток. Покадровой флуоресцентной микроскопии подвижные и медленно растущих бактерий, таких как м. xanthus, однако, был сложным и была выполнена только на короткое время длительности. Здесь мы представляем easy-to-use и надежный метод для жить Клеточная томография м. xanthus по микроскопии флуоресцирования промежуток времени. Этот метод позволяет пользователю следовать клетки и дневно обозначенные протеины для нескольких раундов клеточного цикла с резолюцией одну ячейку.
Существует несколько предварительных условий, которые влияют на успех клеток изображений медленно растущих м. xanthus клеток включая: 1) твердой поверхности клетки вложения; 2) доступность питательных веществ и кислорода; 3) постоянной влажности и температуры; и 4) оптимизация экспериментальных условий такие воздействия времени и изображения приобретение частоты.
В нашей экспериментальной установки мы используем прокладки толщиной агарозы дополнена питательных веществ. Использование толстых агарозы колодки в отличие от microfluidic приборы следовать одной клетки имеет некоторые основные выгоды, но также некоторые недостатки. Во-первых, агарозы pad не только предоставляет поверхность для м. xanthus клетки вложений и движения, но и достаточного количества питательных веществ для роста по крайней мере 24 часа. Во-вторых оснастки выстрел анализы, обычно используется для изучения внутриклеточной локализации дневно обозначенные белков ранее было сделано на тот же тип агарозы колодки16,17,29. Таким образом данные из оснастки выстрел анализа может быть непосредственно по сравнению с данных, полученных с методом, описанным здесь. В-третьих может быть легко изменена и дополнена антибиотики или другие добавки, такие как CuSO4 агарозы колодки и vanillate, которые широко используются для ген выражение индукции18,30. Наконец потому, что клетки могут microcolonies формы в ходе эксперимента, эта настройка также позволяет, изучая эффект прямых ячеек взаимодействий на определенный параметр анализируется. Этот аспект имеет особенно важное значение в случае из м. xanthus потому что эта бактерия отображает несколько контакт зависимые взаимодействия. Основным недостатком этого метода является, что экспериментальные условия заданы в течение всего эксперимента. Напротив microfluidic приборы, как правило, позволяет, изменяя экспериментальных условий в ходе эксперимента, например добавляя антибиотики31.
Свободное программное обеспечение пакеты (например, MicrobeJ, Oufti) доступны для автоматически анализировать рост одиночных клеток и белков локализации в отдельных ячейках. Однако, эти программы являются лишь хорошо подходит для анализа единичных клеток или небольших групп клеток. Таким образом она остается проблемой для автоматически анализировать данные, полученные для записи 24 h, описанный здесь.
В резюме, мы описали, easy-to-use и воспроизводимые протокол для выполнения визуализации клеток с медленно растущей м. xanthus бактерий. Мы покажем, что простое дополнение питательных агарозы подушечки достаточно для поддержания роста для по крайней мере 24 часа и позволяют для наблюдения и анализа белка локализации и роста с одной ячейке резолюции течение нескольких поколений.
Disclosures
Авторы заявляют, что они не имеют никаких финансовых интересов.
Acknowledgments
Эта работа была поддержана немецкого Совета исследований (DFG) в рамках Transregio 174 »пространственно-временных динамики бактериальной клетки» и Общество Макса Планка.
Materials
| Name | Company | Catalog Number | Comments |
| DMI6000B with AFC | Leica microsystems | 11888945 | Automated inverted widefield fluorescence microscope with adaptive focus control |
| Universal mounting frame | Leica microsystems | 11532338 | Stage holder for different sample sizes |
| HCX PL FLUOTAR 100x/1.30 oil PH3 | Leica microsystems | 11506197 | Phase contrast objective |
| Orca Flash 4.0 camera | Hamamatsu | 11532952 | 4.0 megapixel sCMOS camera for picture aquisition |
| Filter set TXR ET, k | Leica microsystems | 11504170 | Fluorescence filter set, Ex: 560/40 Em: 645/75 |
| Filter set L5 ET, k | Leica microsystems | 11504166 | Fluorescence filter set, Ex: 480/40 Em: 527/30 |
| Filter set YFP ET, k | Leica microsystems | 11504165 | Fluorescence filter set, Ex: 500/20 Em: 535/30 |
| ProScan III | Prior | H117N1, V31XYZEF, PS3J100 | Microscope automation controller with interactive control center |
| EL 6000 light source | Leica microsystems | 11504115 | External fluorescence light source |
| Incubator BLX Black | Pecon | 11532830 | Black incubation chamber surrounding the microscope |
| Tempcontrol 37-2 digital | Leica microsystems | 11521719 | Automated temperature control for incubation chamber |
| Gentmycin sulphate | Carl Roth | 0233.4 | Gentamycin |
| Oxytetracylin dihydrate | Sigma Aldrich | 201-212-8 | Oxytetracyclin |
| Kanamycin sulphate | Carl Roth | T832.3 | Kanamycin |
| Filtropur BT25 0.2 bottle top filter | Sarstedt | 831,822,101 | Bottle top filter for sterilization of buffers |
| Deckgläser | VWR | 630-1592 | Glass cover slip (60 x 22 mm, thickness: 0.7 mm) |
| Seakem LE agarose | Lonza | 50004 | Agarose for microscopy slides |
| Leica Metamorph AF | Leica microsystems | 11640901 | Microscope control software and software for picture analysis |
| Tetraspeck Microsperes, 0.5 µm | ThermoFisher | T7281 | Fluorescent microspheres |
| petri dish | Greiner Bio-one | 688102 | 120 mm x 120 mm x 17 mm squared petri dish for agarose pads |
| BD Bacto Casitone | Becton Dickinson | 225930 | Casitone |
| Parafilm M | VWR | 291-1213 | Parafilm |
| Tris(hydroxymethyl)-aminomethane | Carl Roth | AE15.2 | Tris |
| Magnesium sulphate heptahydrate | Carl Roth | P027.2 | Magnesium sulphate |
| Potassium dihydrogen phosphate p.a. | Carl Roth | 3904.1 | Potassium dihydrogen phosphate |
| 1% CTT medium: 1 % (w/v) BD Bacto™ casitone, 10 mM Tris-HCl ph 8.0, 1 mM potassium phosphate buffer pH 7.6, 8 mM MgSO4 | Cultivation medium for M.xanthus | ||
| TPM buffer: 10 mM Tris-HCl ph 8.0, 1 mM potassium phosphate buffer pH 7.6, 8 mM MgSO4 | Buffer for preparation of microscopy slides for M.xanthus |
References
- Shapiro, L., McAdams, H. H., Losick, R. Why and how bacteria localize proteins. Science. 326 (5957), 1225-1228 (2009).
- Treuner-Lange, A., Søgaard-Andersen, L. Regulation of cell polarity in bacteria. J Cell Biol. 206 (1), 7-17 (2014).
- Laloux, G., Jacobs-Wagner, C. Spatiotemporal control of PopZ localization through cell cycle-coupled multimerization. J Cell Biol. 201, 827-841 (2013).
- Rudner, D. Z., Losick, R. Protein subcellular localization in bacteria. Cold Spring Harb. Perspect. Biol. 2 (4), 000307 (2010).
- Badrinarayanan, A., Le, T. B. K., Laub, M. T. Bacterial chromosome organization and segregation. Annu Rev Cell Dev Biol. 31 (1), 171-199 (2015).
- Munoz-Dorado, J., Marcos-Torres, F. J., Garcia-Bravo, E., Moraleda-Munoz, A., Perez, J. Myxobacteria: Moving, Killing, Feeding, and Surviving Together. Front Microbiol. 7, 781 (2016).
- Berleman, J. E., Kirby, J. R. Deciphering the hunting strategy of a bacterial wolfpack. FEMS Microbiol Rev. 33 (5), 942-957 (2009).
- Konovalova, A., Petters, T., Søgaard-Andersen, L. Extracellular biology of Myxococcus xanthus. FEMS Microbiol. Rev. 34, 89-106 (2010).
- Nudleman, E., Wall, D., Kaiser, D. Cell-to-cell transfer of bacterial outer membrane lipoproteins. Science. 309, 125-127 (2005).
- Vassallo, C. N., et al. Infectious polymorphic toxins delivered by outer membrane exchange discriminate kin in myxobacteria. eLife. 6, 29397 (2017).
- Vassallo, C., et al. Cell rejuvenation and social behaviors promoted by LPS exchange in myxobacteria. Proc Natl Acad Sci USA. 112 (22), 2939-2946 (2015).
- Li, Y., et al. Extracellular polysaccharides mediate pilus retraction during social motility of Myxococcus xanthus. Proc. Natl. Acad. Sci. USA. 100, 5443-5448 (2003).
- Kim, S. K., Kaiser, D. Cell alignment required in differentiation of Myxococcus xanthus. Science. 249, 926-928 (1990).
- Lobedanz, S., Søgaard-Andersen, L. Identification of the C-signal, a contact dependent morphogen coordinating multiple developmental responses in Myxococcus xanthus. Genes Dev. 17, 2151-2161 (2003).
- Schumacher, D., Søgaard-Andersen, L. Regulation of cell polarity in motility and cell division in Myxococcus xanthus. Annu Rev Microbiol. 71 (1), 61-78 (2017).
- Schumacher, D., et al. The PomXYZ proteins self-organize on the bacterial nucleoid to stimulate cell division. Dev Cell. 41 (3), 299-314 (2017).
- Treuner-Lange, A., et al. PomZ, a ParA-like protein, regulates Z-ring formation and cell division in Myxococcus xanthus. Mol Microbiol. 87 (2), 235-253 (2013).
- Iniesta, A. A., Garcia-Heras, F., Abellon-Ruiz, J., Gallego-Garcia, A., Elias-Arnanz, M. Two systems for conditional gene expression in Myxococcus xanthus inducible by isopropyl-beta-D-thiogalactopyranoside or vanillate. J Bacteriol. 194 (21), 5875-5885 (2012).
- Harms, A., Treuner-Lange, A., Schumacher, D., Søgaard-Andersen, L. Tracking of chromosome and replisome dynamics in Myxococcus xanthus. reveals a novel chromosome arrangement. PLoS Genet. 9 (9), 1003802 (2013).
- Iniesta, A. A. ParABS system in chromosome partitioning in the bacterium Myxococcus xanthus. PLoS One. 9 (1), 86897 (2014).
- Lin, L., Osorio Valeriano, M., Harms, A., Søgaard-Andersen, L., Thanbichler, M. Bactofilin-mediated organization of the ParABS chromosome segregation system in Myxococcus xanthus. Nat Commun. 8 (1), 1817 (2017).
- Hodgkin, J., Kaiser, D. Cell-to-cell stimulation of movement in nonmotile mutants of Myxococcus. Proc Natl Acad Sci U S A. 74 (7), 2938-2942 (1977).
- Kaiser, D. Social gliding is correlated with the presence of pili in Myxococcus xanthus. Proc Natl Acad Sci USA. 76 (11), 5952-5956 (1979).
- Miertzschke, M., et al. Structural analysis of the Ras-like G protein MglA and its cognate GAP MglB and implications for bacterial polarity. EMBO J. 30 (20), 4185-4197 (2011).
- Hodgkin, J., Kaiser, D. Genetics of gliding motility in Myxococcus xanthus. (Myxobacterales): Two gene systems control movement. Mol Gen Genet. 171, 177-191 (1979).
- Shi, X., et al. Bioinformatics and experimental analysis of proteins of two-component systems in Myxococcus xanthus. J Bacteriol. 190 (2), 613-624 (2008).
- Bi, E. F., Lutkenhaus, J. FtsZ ring structure associated with division in Escherichia coli. Nature. 354 (6349), 161-164 (1991).
- Lutkenhaus, J., Pichoff, S., Du, S. Bacterial cytokinesis: From Z ring to divisome. Cytoskeleton. 69 (10), 778-790 (2012).
- McLoon, A. L., et al. MglC, a Paralog of Myxococcus xanthus GTPase-Activating Protein MglB, Plays a Divergent Role in Motility Regulation. J Bacteriol. 198 (3), 510-520 (2015).
- Gomez-Santos, N., et al. Comprehensive set of integrative plasmid vectors for copper-inducible gene expression in Myxococcus xanthus. Appl Environ Microbiol. 78 (8), 2515-2521 (2012).
- Treuner-Lange, A., et al. The small G-protein MglA connects to the MreB actin cytoskeleton at bacterial focal adhesions. J Cell Biol. 210 (2), 243-256 (2015).



