Summary
ここで集中治療室、すなわちセフェピム、メロペネム、シプロフロキサシン, モキシフロキサシン, リネゾリドのピペラシリンで頻繁に使用される抗生物質の定量化のためのタンデム質量分析を用いたプロトコルを提案する.
Abstract
特に病院抗菌薬の管理プログラムの実施に関し、多くの臨床施設における抗生物質の治療薬物モニタリングのためにますます需要があります。
現在の仕事で提案するセフェピム、メロペネム、シプロフロキサシン, モキシフロキサシン、リネゾリド、ピペラシリン、一般的に使用されるの定量化のための多重化、高性能液体クロマトグラフィー-タンデム質量分析 (hpcl ペ ・ MS/MS) プロトコル集中治療室における抗生物質。メソッドは、欧州医薬品庁のガイドラインによると総合的に検証以前されました。
急速なサンプルのクリーンアップ後、検体を 4 分以内 C8 逆相 HPLC カラムに分離して対応する安定同位体標識内部基準に複数反応におけるエレクトロ スプレー イオン化 (ESI +) 質量分析法で定量時間 (MRM) を監視します。提案手法は、制服のクロマト グラフ条件設定、臨床検査の毎日で堅牢な抗生物質薬剤モニタリングを可能にする単純なインストルメンテーションを使用してください。検量線にまたがる感受性菌と、食塊が得られるピーク濃度 (Cmax) の最小発育阻止濃度 (MIC) に近い抗生物質の量を含む薬物濃度範囲投与レジメン。サンプルのクリーンアップ前に、血清の希釈の必要のない複数の測定値を投与した抗生物質の曲線下面積が得られます。
Introduction
抗生物質は、医学の実践に革命をもたらしたが重篤な細菌感染症罹患率と重大な病気の1の死亡率の主要な原因のまま。この点で、適切な用量で適切な対策のプロンプトの管理は病気制御2の最重要です。
証拠の成長するボディは、広域スペクトル抗生物質による経験的治療が患者集団は複雑な問題がより深刻になっているを示します。これは集中治療室 (ICU)、特に重要な薬物動態 (PK) パラメーターの途方もない個体間変動はよく3,4を観察しました。したがって、ICU 患者不足治療成功5,6の危険とサブ治療レベルの差し迫った危険があります。再度、患者は臨床的利点7で重篤な有害事象があります過度の抗生物質濃度に不必要に公開されます。抗生物質の誤用と不十分な投与の両方はまた公衆衛生8に増え脅威となりつつある抗生の抵抗の普及を煽っています。
抗生物質の使用を改善するために、彼らの effectivenessas を維持するためには、可能な限り世界保健機関は 2015年9抗菌剤耐性に関する地球的行動計画を立ち上げた。抗菌薬の管理プログラムは、国立公衆衛生戦略10臨床医が患者ケア11のと同時に品質の大幅向上を支援に慎重な抗菌薬使用の本質的な基礎を構成します。12抗生物質耐性を削減します。抗菌治療薬のアプリケーションを通じて個々 の患者の投薬モニタリング (TDM) はこのコンテキスト13キー楽器です。
までに、市販の TDM アッセイ、糖ペプチド抗生物質やアミノグリコシド系抗生物質の利用のみ。他のクラスの物質の定量化は、社内法の開発や検証が面倒なことに通常必要です。、したがって、提案の詳細、臨床関連性の高い濃度の範囲14内 ICU で最も関連性の高い抗生物質の定量化のために使用できる堅牢な質量分析を用いた試金のためのプロトコル。メソッドは、最近私たちの質量分析施設で確立されたし、以来 ICU における TDM のルーチンに適用されています。手順は、質量分析機能を備えた多くの施設における抗菌薬の TDM の迅速な実装を可能にする均一サンプル クリーンアップ簡単解析設定を使用します。
ここで説明されているプロトコルはセフェピム、メロペネム、シプロフロキサシン, モキシフロキサシン、リネゾリドのタンデムとの組み合わせで同位体希釈液体クロマトグラフィー (LC) を用いる血清中ピペラシリンの定量化のために最適化された質量分析 (MS/MS)。同位体希釈 - LC/MS MS 方法論、安定同位体標識化合物が特定のマトリックス (例えば血清) と利子のサンプルに追加されます。同位体標識の基準は、そのラベルのない相手、すなわち天然分子と親イオン-娘イオン転移と呼ばれる、その断片化製品の異なる分子量のための興味の analyte と区別できます。同位体標識化合物があると比べて、そのラベルのないほぼ同じ全体的な物理化学的現象は、彼らがの高度でほぼ行列に依存しない試料の定量を許可する MS/MS の理想的な社内基準精度15。最近では、市販されている多く安定同位体標識内部標準小分子の定量化, 抗菌薬の TDM を含めて使用することができます。
分析 C8 アルキル鎖長逆相カラム (100 mm x 2.1 mm、3 μ m 粒子径) と抗生物質の分析記述プロトコルにクロマト グラフの分離が実行されます。メソッド開発時にすべての検体の内部標準正規化行列因子は 94.6%、105.4%、≤8.314の変動係数との間でした。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
注: メタノールなどの有機溶剤を取り扱う際、発煙のフードで動作するようにそれをお勧めします。メスフラスコですべてのバッファーと移動相を準備します。明記のないソリューションは準備の後は、1 ヶ月の室温で保存することができます。
1. 校正器および品質管理サンプルの準備
注: 対応するデータ分析シート ストックとスパイク溶液の調製の補足のファイルで与えられます。トレーサビリティの理由は、対応する列のメーカー、カタログ番号、および各抗生剤のロット番号を挿入します。4 ° c の低温貯蔵のすべての抗生物質を溶解し、可能な限り短い作業時間を保ちます。
- 100 mL の水に 25% メタノールの準備: 絶対メタノール 25 mL で 100 mL のメスフラスコを自動設定し、それに蒸留水 100 mL を埋めます。
- 水 200 mM 酢酸 10 mL を準備: HPLC グレードの水 9 mL を 10 mL のメスフラスコを自動設定、氷酢酸 (純度 99.5%、17.4 M) の 115 μ L を追加し、追加蒸留水 10 mL。
- 20 mM 酢酸と水で 25% メタノール 25 mL を準備: 水溶液 200 mM 酢酸溶液 2.5 mL を 25 mL のメスフラスコを自動設定、絶対メタノールの 6.25 mL 追加し、蒸留水 25 ml フラスコを埋めます。
- 精密スケールを使用すると、列初期重量補足ファイルの指示に従って 15 mL の円錐管に抗生物質の適切な量の重量を量る。
- フルオロキノロン、シプロフロキサシン、モキシフロキサシン 20 mM 酢酸を含む 25% メタノール - 水の貯蔵液を準備します。これを行うには、列「最終巻」の補足ファイルの指示に従って加重量に対応するボリュームを追加します。強烈なボルテックス、2 分間超音波槽におけるフルオロキノロン抗生物質を急速に溶解します。
- セフェピム、メロペネム、リネゾリドの 25% メタノール-水でピペラシリンの貯蔵液を準備します。これを行うにはするには、列最終巻の補足のファイルで説明されているように加重量に対応するボリュームを追加し、強烈なボルテックスによって抗生物質を急速に溶解します。最後の物質としてメロペネムを溶解します。
- 補足ファイルを 10 倍濃厚スパイク溶液の原液量に応じたグラフで説明したようにすべての抗生物質の溶液を組み合わせます。
- 薬物のない血清血清キャリブレータ 0-7 を取得する 10 倍濃縮スパイクの解決の 1 つのボリュームで 9 巻のスパイクし、品質管理 (QC) A – d.たとえば、4.5 mL 血清 10 mL ポリプロピレン チューブにスパイク溶液 0.5 mL を追加し、冷蔵 50 回転ローラー ミキサーに 4 ° c で 15 分間インキュベートします。
- 1.5 mL ポリプロピレン チューブにキャリブレータの QCs 100 μ 因数を生成するのに反復的なピペットを使用します。
- 6 ヶ月間、キャリブレータ、品質コントロール、および-80 ° c の抗生の貯蔵液を格納します。
- 各抗生物質のため単一抗生物質の 1,000 mg/L を含むきちんとしたソリューションを用意します。(例えばシプロフロキサシン、使用 25% メタノール-水 20 mM 酢酸を含むため) に適切な希釈と対応する原液を希釈します。
注: きちんと抗生物質ソリューション、機器調整のため必要なだけ。
2. 社内基準ミックスの準備
注: 内部基準は、サンプルのクリーンアップ中に、サンプルに追加される興味の analytes の対応する同位体標識です。内部基準は、ラベルのない相手にほぼ同一の全体的な物理化学的性質を持っている、彼らはある特定のサンプルのマトリックスの影響を補正します。
- 絶対メタノール 5 mL を 10 mL のシェイク フラスコに追加することによって水の 50% メタノール 10 mL を準備し、それに蒸留水 10 mL を埋めます。
- 20 mM 酢酸を含む水で 50% メタノール 10 mL を準備します。これを行うには、200 mM 酢酸 1 mL を 10 mL のフラスコに追加、絶対メタノール 5 mL を追加し、それに蒸留水 10 mL を埋めます。
- 1,000 mg/l、製造元から提供されたバイアルに直接内部規格 (IS) の原液を生成します。セフェピム-13C12D3硫酸蒸留水、メロペネム D6リネゾリド D3ピペラシリン D5 50% 水-メタノール溶液中で溶解します。シプロフロキサシン D8を 20 mM アセテートおよびモキシフロキサシン塩酸塩-13C1D3 20 mM アセテートの蒸留水で 50% メタノール-水に溶解します。
- 5 倍濃縮の内部標準的なミックスをもたらす 1.5 mL ポリプロピレン チューブには原液を組み合わせます。セフェピム-13C12D3メロペネム D6シプロフロキサシン D8、モキシフロキサシン塩酸塩 -13C1D3リネゾリド Dの 2 μ L の 2 μ L の 1 μ L の 10 μ L の 10 μ L を追加します。3とピペラシリン D5 25% メタノール-水の 965 μ L に 10 μ L。
- 内部標準溶液と-80 ° C で 5 倍濃縮はミックスを保存します。
3. 患者検体の保管
注: は、血清が早く得られること凍結試料のコールド チェーンが維持されていることを確認します。
- 血清採血管で全血を収集します。
- 室温で 20-30 分の血の塊ができます。
- 2,000 x gで 10 分間遠心分離によって血液から血清を分離します。
- きれいなポリプロピレン チューブに上清を転送します。
- それは試金されるまで、血清を-80 ° C で 6 ヶ月間に蓄えます。また、-20 ° C で 3 日間にサンプルを蓄える
4 クロマトグラフィー用バッファー準備
- 水でギ酸アンモニウム 1 M を準備するには、ギ酸アンモニウム 100 mL シェイク フラスコを用いた HPLC グレード水の 100 mL の 6.306 g を溶かします。4 ° C で 1 ヶ月にソリューションを蓄える
- 携帯電話の準備フェーズは [10 mM ギ酸アンモニウム水ギ酸 (99.9:0.1 v/v)]。HPLC グレードの水約 500 mL と 1,000 mL のメスフラスコを自動設定ギ酸の 1 mL と 1 M, ギ酸アンモニウム溶液の 10 mL を追加し、1,000 mL に HPLC グレードの水でそれを埋めます。きれいなガラスのボトルに移動相 A を転送し、HPLC システムに接続します。常温で 2 週間まで、移動相を格納します。
- きれいなガラス瓶の中に移動相 b. HPLC グレード絶対メタノールを準備し、HPLC システムに接続します。
- 使用針として絶対メタノール溶媒を洗浄し、移動相 b. を含んでいるガラス瓶に対応するチューブを接続
- シールとパージ溶媒はメタノール水ギ酸 (7:92.9:0.1、v/v/v) を生成します。約 500 mL の蒸留水を 1,000 mL のメスフラスコを自動設定、絶対メタノール、ギ酸、1 mL の 70 mL を加えて 1,000 mL に蒸留水を追加します。きれいなガラスのボトルに溶媒を転送し、高速液体クロマトグラフィー システムと接続します。
注: さまざまなオートサンプラー システムは、強い、弱い針洗浄溶剤を使用します。このような場合は、メーカーの推奨事項に従って洗浄溶液を準備します。例えば、メタノール-水-isopropylic アルコール (70:20:10, v/v/v) で強力な洗浄および水-メタノール (95:5, v/v) と弱い洗浄を行います。
5. 楽器のチューニング
注: この手順は、特定質量分析装置に関するメソッドの設定に対して実行されます。
- きちんとした 1,000 mg/L の試料や内部標準溶液 1:10 検出器信号強度に応じて移動相 A と B (50: 50、v/v) の混合物で 1: 100 希釈します。オートチューン機能と質量分析計を調整するか、次の親の娘イオン遷移14の手動チューニング: セフェピム (4,810億 > 167.0/395.7)、セフェピム-13C12D3 (485.1 > 167.1/400.0)、メロペネム (384.1 > 114.0/141.0)、メロペネム D6 (3,901億 > 114.0/147.2)、シプロフロキサシン (332.0 > 231.0/245.0)、シプロフロキサシン D8 (340.1 > 235.1/249.3)、モキシフロキサシン (402.0 > 261.0/383.9)、モキシフロキサシン13C1D3 (406.1 > 265.1/388.0)、リネゾリド (3,380 > 235.0/296.0)、リネゾリド D3 (341.1 > 235.1/297.1)、ピペラシリン (518.0 > 143.0/358.9)、ピペラシリン D5 (5,231億 > 142.8/364.1)。
- オート チューニング付け器、探知機を電圧と MS 入口の設定を自動的に調整するのにオート チューニング機能を使用します。
- マニュアル ・ チューニング、楽器最適 (通常最大) まで (例えば、衝突電圧および衝突エネルギー) の設定を調整するには、各親と娘イオン検出器では信号強度が得られ。たとえば、ミキシング ティーをプラグ、0.5 mL/min で移動相 A と B (50: 50、v/v) を提供、継続的に 0.1 mL/min の流速できちんとした抗生物質や内部標準を吹き込みます。
6. 高速液体クロマトグラフィー ・ MS/MS セットアップ
注: 機能質量分析計、高速液体クロマトグラフィー システム (オートサンプラーを含む)、および対応するソフトウェアの製造元によって異なります。質量パラメーターとメーカーの推奨事項に従って洗浄手順を適応します。
- 対応する質量パラメーターを保存 'MS チューニング ファイル'。肯定的なモード (ESI +) ですべての検体にエレクトロ スプレー イオン化を使用します。使用楽器のイオン ソース設定を適応させる (例えば、キャピラリー電圧 1.5 kV、120 ° C のソースの温度、溶媒温度 400 ° C、600 L/h の脱溶媒ガス流量、RF レンズ電圧 0.1 V の 80 ms の滞留時間)。
- 内部基準となり, チューニング パラメーター (例えば、キャピラリー電圧、衝突エネルギー) を指定する 'MS ファイル'。
- オートサンプラー条件を次のように設定、'入口ファイル ': サンプル温度 10 ° C ± 5 ° C の制限1 x パージ-洗浄-パージ 600 μ L での洗浄シーケンス削除ボリューム交換です。
- 上記の '入口ファイル'、設定、流量 0.4 や 0.5 mL/min に実行時間を 4 分、345 バーに圧力上限と限度額の ± 30 ° C にカラム温度 5 ° C移動相 A と B の溶媒名を追加し、それぞれ、7 %b/93% にそれらを設定します。
- プログラムのクロマト グラフの勾配、'入口ファイル '次のように: 0.00-0.10 7% 移動相 B/93% は、0.11-0.60 分 65% 移動相 B/35% は、0.61-2.10 分 95% 移動相 B/5% は、2.11-4.00 分 7% 移動相 B/93% A. と分
注: は、余分な列ボリューム、インストゥルメンタル プラットフォームおよび USP < 621 > クロマトグラフィー ガイドライン16に従って試料保持要因のホールド アップ量を計算します。
7. サンプル測定マスター ファイル
: 注 'サンプル測定マスター ファイル'、患者のサンプルが指定されて、高速液体クロマトグラフィー/タンデム質量分析を開始し、データの評価を実行します。低-高品質コントロールのペアを含む 2 つの別個のテンプレート ファイルが生成されます。1 つのテンプレートに QC ペア A および C、他 1 つ QC のペア B および D が含まれています
- 新規作成 'サンプル測定マスター ファイル'。上記を選択 'MS チューニング ファイル'、'MS ファイル 'と'入口ファイル' (セクション 6)、各サンプル ラインを挿入し、15 μ L で注入量を指定します。
- 昇順の順序、0-7 のキャリブレータと品質管理 (QC) ペア A/C または QC ペア B/D の「サンプル テキスト」を追加します。
- サンプルの種類を指定します。品質管理のペアのキャリブレータと「QC」のサンプル型「標準」を選択します。
- 対応するキャリブレータと品質コントロール (濃度 [μ g/mL] Cal 7-Cal 0 QC A/C または B/D、スプレッドシートを参照) の各抗生物質物質の濃度を指定します。
- プログラム、「データ評価手法 '.計測器のチューニング (セクション 5) の間に最適化されたトランジションを使用します。対応する同位体標識標準 (例えばメロペネム - メロペネム D6) と各抗生物質に一致します。
8. クリーンアップと高速液体クロマトグラフィー/タンデム質量分析をサンプルします。
注: 各サンプル バッチ対品質管理 (QC A/C または QC B/D) 低高抗生物質濃度設定は処理や、分析します。代替シーケンスの異なるバッチ間ペアの QC サンプルを使用 (例えば1 日目を選択、'サンプル測定マスター ファイル ' QC を含むペアの A/C; 2 日目、1 つ含む QC ペア B/D を選択。血清検体の処理を図 1に示します。
- 準備の沈殿剤 10% メチル-tert-ブチル エーテル (10: 90, v/v) はメタノール中で (例えばメチル -tert2.5 ml prefill 25 mL メスフラスコ-ブチル エーテル絶対メタノール 25 mL にそれを埋める)。
- 列チャンバーに C8 逆相を配置します。高速液体クロマトグラフィーと質量分析計の流れの方向に接続します。
- サンプル リストを生成します。該当する 'サンプル測定マスター ファイル'テンプレート、患者サンプル リストを処理するためのものを追加。最大 20 の患者サンプル群を生成および品質管理の対応するペアでフランクのそれら。
- ウェット総理 hpcl ペ システムを使用して、'入口ファイル '制御ソフトウェア: 50% 移動相 A/50% B に「ウェット プライム」関数を設定と 1 mL/分の流量で 2 分間ウェット首相。
- 注射器を更新します。これを行うには、するには、制御ソフトウェアで 600 μ L の 6 ストロークを実行します。
- C8 逆相カラムを平衡します。流れをオンに、ソフトウェアを使用して、'入口ファイル 'それをフラッシュ モバイル 7% で最低 5 分、確認の 0.5 mL/分の流量を使用しての B/93% A 相カラム温度は 30 ° C
- 患者のサンプル、キャリブレータ 0-7 の 1 つの因数と品質コントロールのペアを解凍 (どちらか A/B または C/D)。
- 反復的なピペット 100 μ L キャリブレータ、QC サンプルまたは 1.5 mL ポリプロピレン チューブ、および渦管の患者血清中に数秒間の内部標準的なミックスの 25 μ L を追加します。
- ベンチトップ シェーカー (例えば、1,200 rpm) で室温で 5 分間混合物を孵化させなさい。
- 反復的なピペットでサンプル内部の標準的なミックスに沈殿試薬の 150 μ L を追加します。
- 再び、渦いくつかのチューブは秒し、ベンチトップ シェーカー (例えば、1,200 rpm) で室温で 5 分間インキュベートします。
- 4 ° C で 10 分間卓上遠心分離機で 20,000 × gの懸濁液を遠心分離します。
- ガラス小瓶を用いた微細インサート HPLC グレード水上清 1:3 を希釈、オートサンプラー、加工サンプルを読み込みます。
- 手動で高速液体クロマトグラフィー/タンデム質量分析を開始、'測定のサンプル制御ファイル '。
注: 長期貯蔵相崩壊を防ぐために [例えば、0.5 mL/min メタノール-水 (50: 50、v/v)] 製造元の推奨に従って分析カラムが徹底的にフラッシュします。

図 1: サンプルのクリーンアップの略図。高遠心力で蛋白質の沈殿物が高密度のペレットを与えるし、その蛋白質の沈殿物が完了した上澄みを示す。全体の処理時間が約 30 分、サンプルのクリーンアップ、クロマト グラフ分離/タンデム質量分析など。この図の拡大版を表示するのにはここをクリックしてください。
9. 品質評価と定量
- サンプルを処理する対応するを開く '測定のサンプル制御ファイル'、キャリブレータ、品質コントロール、および患者のサンプルを選択し、それらを評価、'抗生物質数量化 '.
- 特定の試料のピークを適切に統合するかどうかを確認します。キャリブレータ、QC、および患者検体のピークを点検し、必要に応じて手動でのベースラインに復帰します。
- 検量線を検討し、次の品質基準を満たしているかどうかを調べる: a) 全体の校正範囲、b) の校正係数 r2 > 0.995、c) 各校正標準の ± 15% 以内の偏差を直線性、公称値、下限数量 (LLOQ) ± 20% は必要なを除いて。
- 上記の条件を満たしていない校正標準を拒否して回帰分析を含む校正曲線を再評価します。
- 品質管理を研究し、偏差、公称値の ± 15% 以内かどうかを調べます。
- 患者検体の濃度は、最も高いキャリブレータの濃度を超えた場合、1:5 に (例えば血清の 100 μ L 加え、400 μ L の蒸留水) サンプル クリーンアップする前に、蒸留水、サンプルまでを薄くしなさい。テナンス手順 8.8-8.14 その特定のサンプルとそれを再処理します。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
記述のプロトコルを使用して、典型的なクロマト グラムは図 2で描かれています。米国薬局方 (USP) クロマトグラフィーのガイドライン16によると現在のシステムで列のデッド ボリュームが ~0.22 mL ~0.08 ml、余分な列ボリューム (インジェクター、チューブ、コネクタを含む) と決定されたこと~0.30 mL のホールド アップ量。すべての検体の計算された保持因子であった (用セフェピム) - 2.8 4.2 (ピペラシリン) のため。
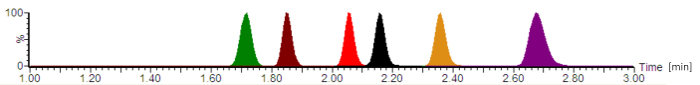
図 2: 正規化された信号強度を持つ典型的な分析クロマト。抗生物質は次の順序で溶出性: セフェピム (緑)、メロペネム (ブラウン)、シプロフロキサシン (赤)、モキシフロキサシン (黒)、リネゾリド (オレンジ)、ピペラシリン (紫)。保持時間は、分単位で与えられるかどれと試料ピーク対称性は、移動相、流量、クロマトグラフィー管、分析カラム年齢の正確な構成によって異なります。この図の拡大版を表示するのにはここをクリックしてください。
図 3 a にはキャリブレータ 0 - 7 を含むサンプル加工品のサンプル グラフのリストが含まれています ("0 Kalibrator"-"Kalibrator 7")、品質コントロール、および注入番号で示されている患者の血清 (#);サンプル識別テキスト (サンプル テキスト);測定濃度 mg/l (濃);サンプルの種類、空白、標準、品質管理、または患者サンプル (型) であります。公称濃度 mg/l (標準濃度); キャリブレータ分析の保持時間 (RT);検体/ピーク面積のピーク面積の比は、応答は (応答);公称濃度値 (% 開発) からの偏差バイアル位置 (バイアル);捕捉時間 (Acq.Time)。定量化に使用されるキーのパラメーターです応答、追加同位体標識内部標準物質の一定の量のため、試料濃度と徐々 に増加します。
図 3 bは、較正曲線を示しています。回帰, 定量 r2の係数は > 0.995 をする必要があります。次の校正モデルを使用してこのメソッドに記載されているすべての analytes の: 曲線タイプ = 線形;起源 = 含まれている;重み = 1/x;軸変換 = なし。特定の例では、較正曲線と品質管理は、すべての品質条件を満たす: r2 > 0.995 較正曲線のキャリブレータ (、LLOQ を含む)、および QC サンプル偏差の公称値の ± 15% 以内です。
測定された親の娘イオン遷移 (MRM)図 3で与えられている同じ保持時間で 4 つのピークを示す: 2 つの上部のピーク興味の analyte の測定される 2 つの遷移を描く、下の 2 つのピークを表す、対応する同位体標識内部標準の遷移。品質評価のためそれぞれリテンション タイム ウィンドウで試料のピークが視覚的にチェックし、基準、必要なときに手動で再統合します。
最小発育阻止濃度 (MIC) は、対象薬物動態/薬力学 (PK/KD) 比13,17を達成するために必要な薬物動態学的露出を定義する抗菌薬の TDM の中心的なコンポーネントです。したがって、抗菌薬の TDM の濃度レベルの目標は、原因菌の MIC に関連して表現されます。4 x-5 MIC を超える治療濃度の達成を通じてその有効性を最大化 β-ラクタム系抗生物質の作用は、時間依存は、x (fT >マイク × 4-5)。未知の感染性病原体に直面するとき無料 (タンパク質非連結) ピペラシリンの目標トラフ濃度範囲は、したがって、64 mg/L、約 90 mg/L 合計ピペラシリン18に対応します。
(サンプル #11) の最初の患者はまた問題病原体、緑膿菌などのため十分な 83.4 mg/L ピペラシリンの満足の高い血清トラフ レベルがあります。2 番目の患者 (サンプル #12) 約 0.2 mg/L、最低キャリブレータ (LLOQ) 以下であるものの濃度があります。おそらく患者さんが回復した、ピペラシリン投与が中止されました。結果「< 0.5 mg/L」は、病院情報システムで報告されますしたがって、。第三の患者 (サンプル #13) 病原体の過半数のために十分ではないことをのみ 5.3 mg/L の低ピペラシリン トラフ濃度があります。効果的な抗菌化学療法、医師によって投与量を増やしてください。
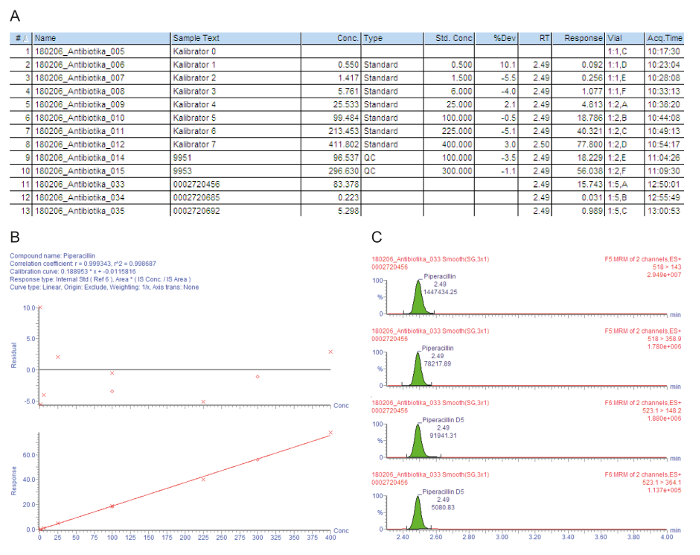
図 3: 評価の模範的な質と検体ピペラシリンの定量化します。これらのパネルは、質量分析データの分析を表します。(A) このパネル キャリブレータ (標準サンプル 8 #1-#)、品質管理 (QCサンプル #9 #10)、患者血清 (サンプル #11-#13) など、サンプル一覧が表示されます。キャリブレータ 0 は内部標準添加ではなく、検体ブランクを指します。9951 9953 表します QC + (B) このパネルは、ピペラシリンの校正曲線を示しており、QC B を表します。公称キャリブレータ濃度から割合偏差が上のグラフで与えられている (y-軸:残留)、下のグラフは、直線性範囲を示しています。(C) このパネルは、ピペラシリンと対応する内部標準ピペラシリン D5患者血清サンプルについては #12 の監視 (MRM) 複数の反応時間を示しています。2 つの親の娘イオン遷移は保持時間とそれぞれの信号強度が表示されます。この図の拡大版を表示するのにはここをクリックしてください。
補足ファイル。このファイルをダウンロードするここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本稿で報告する ICU の19セフェピム、メロペネム、シプロフロキサシン, モキシフロキサシン、リネゾリドの頻繁に使用される抗生物質の定量化のためのシンプルで堅牢なタンデム質量分析を用いた方法のためのプロトコルとピペラシリン14。スプレッドシートは、抗生物質の純度と、ポリマーの分子量を考慮して、品質管理、キャリブレータ、抗生の貯蔵液の準備のため原稿を伴います。抗生物質の濃度はかなり高いが、その定量化の分析の観点から特定の課題必要がありますできません。したがって、このプロトコルはさまざまな MS 機器プラットフォームに適用できると確信しております。メソッドの転送でユーザーは余分な列ボリュームを定量化することをお勧めし、ホールド アップ ボリューム ガスクロマト グラフ システムのグラデーションの開始に合わせて時間に応じて16。方法セットアップ中にシステムは、キャリー オーバーの評価すべきし、抗生物質濃度が高い最高のキャリブレータと患者のサンプルの後必要に応じて、空白のサンプルを組み込む必要があります。ユーザーはまた余りにも多くのイオンはタンデム質量分析計を入力するときに発生する検出器の飽和の可能性を考慮しなければなりません。関連する検出器の飽和は、小さい注入量、サンプルのクリーンアップおよび/またはターゲット試料 (例えば、最適な電圧設定をダウン グレード) の離調時より高い検体希釈と除去ことができます。
その他の方法に反して校正範囲は両方、ボーラス投与が得られるピーク濃度 (cmax) と同様、影響を受けやすい病原体のマイクに近い濃度の定量化をことができます。最高 Cmax-値は大人で報告される対応する専門的な情報シート FDA 薬剤安全性データベースで次のように: セフェピム20163.9 mg/L、メロペネム21112 mg/L、シプロフロキサシン22 4.6 mg/L、モキシフロキサシン234.1 mg/L、リネゾリド24、21.2 mg/L、ピペラシリン25298 mg/L。抗生物質濃度モニタリング患者の血液循環に関与する病原体への感受性、投与量の調整と複数の採血による曲線の下の薬物動態学的領域を取得することも、指定しました。プロトコル。
多くの抗生物質 (特に β-ラクタム系メロペネム) は化学的に安定して一度解散ではありません。このプロトコルでは最も重要なステップは、したがって、原液、校正器、寒冷条件26,27品質コントロールの準備です。その点でまた患者サンプルをできるだけ早く固定するのには不可欠であるとしてます。26は-80 ° c の血清保管して下さい、サンプルを表示することができます私たちの安定性実験は-20 ° C (トラフ レベル) でも抗生物質濃度の任意の重要な減少なしで 3 日間格納しました。
前に (例えばキャリブレータ 3 の) 患者のサンプルのそれぞれの高速液体クロマトグラフィー/タンデム質量分析システム適合性試験を実行することをお勧めします。一般的に、システム適合性試験は、- LC/MS MS システムの再現性を確認し、それがまた行われる分析の適切な使用されます。したがって、例えば、信号強度の減少は、有機溶剤での洗浄を必要とする MS スイープ コーンの汚染によって引き起こされます。MS ソースをきれいに保つために、質量分析計に届く前に、無駄に移動相の「検体自由」な部分を演出、クロマトグラフィーのコラムの後迂回弁を導入できます。 されます一方、圧力の全体的な増加は、時間をかけて目詰まり列を指定できます。列を増やしてコスト プレカラム フィルターの寿命使用はお奨めします。圧力は問題がまだ続く場合、0.4 mL/min の流量はこのプロトコルのクロマト グラフの勾配で使用もできます。
この技法のマイナーな制限はサンプルのクリーンアップの 3 つの別々 の手動の手順が必要です、約 30 分の合計所要時間、同位体標識内部標準を加える沈殿物エージェントが節約できるかもしれません処理時間。ただし、これだけされるべき高いサンプル スループット レートのと降水量とエージェントも社内基準として (例えば-20 ° C で)、寒さに格納されて体外で高温低下します。
記述されていたプロトコル サンプル標準 1.5 mL ポリプロピレン チューブで処理しました。高スループット レートは抗生物質 TDM に必要なする必要があります、手順は、適切なの遠心分離機の挿入またはフィルター プレートを用いた真空マニホールド ウェル プレート形式にアップグレードできます。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
貴重な入力のための博士 Zoller について適切な校正範囲と著者は提案手法を確立する彼の助け博士 Schütze を感謝します。著者はまた質量分析施設の技術的なスタッフを認めます。
Materials
| Name | Company | Catalog Number | Comments |
| cefepime hydrochloride | Sigma-Aldrich | 1097636 | USP Reference Standard |
| meropenem trihydrate | Sigma-Aldrich | Y0001252 | EP Reference Standard |
| ciprofloxacin | Sigma-Aldrich | 17850 | |
| moxifloxacin hydrochloride | Sigma-Aldrich | SML1581 | |
| linezolid | Toronto Research Chemicals | L466500 | |
| piperacillin sodium salt | Sigma-Aldrich | 93129 | |
| cefepime-13C12D3 sulfate | Alsachim | C1297 | Isotope labelled internal standard for cefepime |
| meropenem-D6 | Toronto Research Chemicals | M225617 | Isotope labelled internal standard for meropenem |
| ciprofloxacin-D8 | Toronto Research Chemicals | C482501 | Isotope labelled internal standard for ciprofloxacin |
| moxifloxacin-13C1D3 hydrochloride | Toronto Research Chemicals | M745003 | Isotope labelled internal standard for moxifloxacin |
| linezolid-D3 | Toronto Research Chemicals | L466502 | Isotope labelled internal standard for linezolid |
| piperacillin-D5 | Toronto Research Chemicals | P479952 | Isotope labelled internal standard for piperacillin |
| methanol | JT Baker | 8402 | |
| HPLC grade water | JT Baker | 4218 | |
| formic acid | Biosolve | 6914132 | |
| acetic acid | Biosolve | 1070501 | |
| ammonium formate | Sigma-Aldrich | 70221-25G-F | |
| tert-Butyl methyl ether | Merck | 101845 | |
| Fortis 3 μm C8 100 * 2.1 mm | Fortis | F08-020503 | |
| Ti-PEEK-encased Prifilter (2 μm) | Chromsystems | 15011 | |
| 2795 Alliance HPLC system | Waters | 176000491 | |
| Quattro micro API Tandem Quadrupole System | Waters | 720000338 | |
| QuanLynx 4.1 software | Waters | / | Data evaluation software provided by the mass spectrometer manufacturer |
| Supplemental File | Stock Solutions |
References
- Fleischmann, C., et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. American Journal of Respiratory and Critical Care Medicine. 193 (3), 259-272 (2016).
- Dellinger, R. P., et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Medicine. 39 (2), 165-228 (2013).
- Lodise, T. P., Drusano, G. L. Pharmacokinetics and pharmacodynamics: optimal antimicrobial therapy in the intensive care unit. Critical Care Clinics. 27 (1), 1-18 (2011).
- Macedo, R. S., Onita, J. H., Wille, M. P., Furtado, G. H. Pharmacokinetics and pharmacodynamics of antimicrobial drugs in intensive care unit patients. Shock. 39, Suppl 1. 24-28 (2013).
- Petersson, J., Giske, C. G., Eliasson, E. Standard dosing of piperacillin and meropenem fail to achieve adequate plasma concentrations in ICU patients. Acta Anaesthesiologica Scandinavica. 60 (10), 1425-1436 (2016).
- Abdul-Aziz, M. H., Lipman, J., Mouton, J. W., Hope, W. W., Roberts, J. A. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Seminars in Respiratory and Critical Care Medicine. 36 (1), 136-153 (2015).
- Imani, S., Buscher, H., Marriott, D., Gentili, S., Sandaradura, I. Too much of a good thing: a retrospective study of beta-lactam concentration-toxicity relationships. Journal of Antimicrobial Chemotherapy. 72 (10), 2891-2897 (2017).
- Ventola, C. L. The antibiotic resistance crisis: part 1: causes and threats. Pharmacy & Therapeutics. 40 (4), 277-283 (2015).
- World Health Organization. Global Action Plan on Antimicrobial Resistance. , Available from: http://www.who.int/antimicrobial-resistance/global-action-plan/en (2015).
- Pulcini, C. Antibiotic stewardship: update and perspectives. Clinical Microbiology and Infection. 23 (11), 791-792 (2017).
- Cairns, K. A., et al. The impact of a multidisciplinary antimicrobial stewardship team on the timeliness of antimicrobial therapy in patients with positive blood cultures: a randomized controlled trial. Journal of Antimicrobial Chemotherapy. 71 (11), 3276-3283 (2016).
- Baur, D., et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infectious Diseases. 17 (9), 990-1001 (2017).
- Roberts, J. A., Norris, R., Paterson, D. L., Martin, J. H. Therapeutic drug monitoring of antimicrobials. British Journal of Clinical Pharmacology. 73 (1), 27-36 (2012).
- Paal, M., Zoller, M., Schuster, C., Vogeser, M., Schutze, G. Simultaneous quantification of cefepime, meropenem, ciprofloxacin, moxifloxacin, linezolid and piperacillin in human serum using an isotope-dilution HPLC-MS/MS method. Journal of Pharmaceutical and Biomedical Analysis. 152, 102-110 (2018).
- Vogeser, M., Seger, C. Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory. Clinical Chemistry. 56 (8), 1234-1244 (2010).
- United States Pharmacopeia and National Formulary. Chapter <621>. CHROMATOGRAPHY (USP 37-NF 32 S1). , United Book Press, Inc. Baltimore, MD. 6376-6385 (2014).
- Wong, G., Sime, F. B., Lipman, J., Roberts, J. A. How do we use therapeutic drug monitoring to improve outcomes from severe infections in critically ill patients? BMC Infectious Diseases. 14, 288 (2014).
- EUCAST: European Committee on Antimicrobial Susceptibility Testing. Information on clinical breakpoint tables. , Available from: http://www.eucast.org/clinical_breakpoints/ (2017).
- Surveillance der Antibiotika-anwendung und der bakteriellen Resistenzen auf Intensivstationen. SARI information for antibiotic consumption 2016 of all intensive care units participating at SARI. , Available from: http://sari.eu-burden.info/auswertung/down/AD-ZEIT.pdf (2016).
- Cefepime hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/050679s040lbl.pdf (2016).
- Meropenem: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2008/050706s022lbl.pdf (2006).
- Ciprofloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2016/019537s086lbl.pdf (2016).
- Moxifloxacin hydrochloride: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2010/021277s038lbl.pdf (2010).
- Linezolid: Highlights of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2012/021130s028lbl.pdf (2011).
- Piperacillin and Tazobactam: Highlighs of prescribing information. , Available from: https://www.accessdata.fda.gov/drugsatfda_docs/Label/2017/050684s88s89s90_050750s37s38s39lbl.pdf (2017).
- Zander, J., et al. Effects of biobanking conditions on six antibiotic substances in human serum assessed by a novel evaluation protocol. Clinical Chemistry and Laboratory. 54 (2), 265-274 (2016).
- Zander, J., et al. Quantification of piperacillin, tazobactam, cefepime, meropenem, ciprofloxacin and linezolid in serum using an isotope dilution UHPLC-MS/MS method with semi-automated sample preparation. Clinical Chemistry and Laboratory. 53 (5), 781-791 (2015).



