ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Her presenterer vi en protokoll som beskriver den fabrikasjon av elastisk, dual channel, orgel chip microfluidic celle kultur enheter for recapitulating organ-nivå funksjonalitet i vitro.
Abstract
Et betydelig antall føre forbindelser mislykkes i farmasøytiske rørledningen fordi dyrestudier ofte ikke forutsi kliniske tiltak i menneskelige pasienter. Human Organ-on-a-Chip (orgel Chip) microfluidic celle kultur enheter, som gir en eksperimentell i vitro plattform for å vurdere effekt, giftighet og farmakokinetiske (PK) profiler i mennesker, kan være bedre prediktorer av terapeutiske effekten og sikkerhet i klinikken sammenlignet dyrestudier. Disse enhetene kan brukes å modellere funksjonen av nesten alle orgel type og fluidically kan kobles gjennom felles endotelet linjert microchannels å utføre i vitro studier menneskelige organ-nivå og hele kroppen-nivå fysiologi uten å utføre eksperimenter på folk. Disse Organ Chips består av to parfyme microfluidic kanaler med en gjennomtrengelig cellegummi membran organ-spesifikke parenchymal celler på den ene siden og mikrovaskulær endothelium, som kan strekkes syklisk å gi organ-spesifikke mekanisk signaler (f.eks puste bevegelser i lunge). Denne protokollen detaljer fabrikasjon av fleksible, dual channel, orgel Chips gjennom deler med 3D trykt formene, slik at kombinasjonen av flere støping og etterbehandling trinnene. Porøse poly (dimethyl siloxane) (PDMS) membraner er støpt med mikrometer store gjennom-hullene ved hjelp silisium pilar matriser under komprimering. Fabrikasjon og samlingen av orgel Chips innebærer utstyr og skritt som kan gjennomføres utenfor en tradisjonell renrom. Denne protokollen gir forskere med tilgang til orgel Chip teknologi for i vitro orgel - og body-nivå studier i stoffet funnet, sikkerhet og effekt testing, samt mekanistisk studier av grunnleggende biologiske prosesser.
Introduction
Her beskriver vi fabrikasjon tokanals, Stangeriaceae Organ-på-Chip (orgel Chip) microfluidic kultur enheter bruker en skalerbar protokoll mottakelig for bruk av forskningsgrupper mangler tilgang til renrom og tradisjonelle myk litografi verktøy. Disse enhetene er utviklet for å recapitulate human organ-nivå funksjoner for forståelse normal og sykdom fysiologi, samt stoff svar i vitro1,2. Kritisk til engineering denne funksjonaliteten er to parfyme microfluidic kanaler med et halvt gjennomtrengelig membran (figur 1). Denne utformingen kan rekreasjon av vev-vev grensesnitt mellom minst to typer vev, vanligvis organ parenchymal celler på én side av porøs membran og vaskulære endotelet på den andre, samt sin eksponering væskestrøm. I tillegg fordi den elastiske polymer, poly (dimethyl siloxane) (PDMS), brukes til å dikte Organ Chip kroppen og membran komponenter, syklisk mekanisk belastning kan brukes på hele konstruert vev-vev grensesnitt via elastiske membran å etterligne den naturlige fysisk microenvironment av levende organer, som bevegelser i lungene og peristalsis i tarmen.

Figur 1: orgel Chip tverrsnitt. Orgel Chips består av to kanaler med en porøs, elastisk membran som kan være plantet med celler på begge sider. Topp kanalen tverrsnitt er 1 mm bred x 1 mm høy, bunnen kanal tvers delene er 1 mm bred x 0.2 mm høy, og vakuum kanaler i både og nedre deler er 0,3 mm bred 0,5 mm høy og linjeavstand 0.3 mm fra fluidic kanalene. Klikk her for å se en større versjon av dette tallet.
Disse elastisk, dual kanal, orgel Chips har blitt brukt for å vise virkningen av puste bevegelse hydrogenion absorpsjon i lungene og narkotikainduserte lungeødem3,4; effekter av peristaltiske bevegelser på differensiering5 og bakteriell overgrowth i tarmen5,6,7; og påvirkning av syklisk forvrengning på grunn av pulsering hjertets på differensiering og modning av glomerular podocytes i nyre8. I tillegg, disse to-lumen enheter som inneholder en endotelet linjert vaskulær kanal atskilt med en ekstracellulær matrix (EFM)-belagt membran fra parenchymal celler i en separat tilgjengelig kanal er godt egnet for karakteristikk av narkotika PK parametere og nye mål funn, som har vært begrenset i enkelt perfusjon kanal systemer. Dessuten flere Organ Chips kan kobles sammen via deres vaskulær kanaler effektivt opprette en menneskelig kropp-på-chips, som kan tilby en attraktiv menneskelige i vitro plattform for therapeutics utvikling9, 10. I motsetning til de fleste mikro-fysiologiske systemer (MPS)11,12,13inneholde orgel Chips to microfluidic kanaler med en porøs membran som forenkler vaskulær-parenchymal vekselsvirkningene til recapitulate i vivo organfunksjon. Dette forenkler ikke bare kobling av ulike organer sammen ved perfusing en vanlig medium kanalene vaskulær, men compartmentalization av vev og væsker etterligner i vivo funksjoner og støtter farmakokinetiske eksperimentering og modellering og i vitro-i vivo ekstrapolering9,10 som er vanskelig eller umulig i enkeltkanals MPS14,15,16. Populariteten til PDMS i microfluidic enheter har ført til utvikling av verktøy å overvinne materialets iboende evne til å absorbere små molekyler10,17. Men nødvendiggjør det store antallet sjetonger som kreves for å støtte biologiske studier der bruk av mikrobielle agens og PDMS-absorberende forbindelser gjør gjenbruk av orgel Chips vanskelig en skalerbar produksjonsprosess for små forskningsgrupper. Protokollen beskrevet her presenterer en metode for enheten fabrikasjon egnet for bruk i akademiske laboratorier, inkludert de mangler tilgang til renrom og myke litografi. Denne protokollen skal utvide tilgang til orgel Chips med et bredt spekter av forskere søker å bruke elastisk, tokanals enhetene for å utforske grunnleggende biologiske prosesser samt translasjonsforskning terapeutiske utvikling.
Leveraging beste praksis fra micromanufacturing felt kombinert med design for produksjon, ble en robust tilnærming utviklet for fabrikasjon Organ Chip enheter i store mengder med høy reproduserbarhet og avkastning. Fabrikasjon protokollen beskrevet her gir en skalerbar metode for orgel Chip produksjon. Vi beskriver bruk av en valgfri Mold-på-plass Jig (MiP, designdetaljer i Tilleggsresultater materialer) kombinert med pakning strimler aktivere skalere opp Casting PDMS komponenter. Den skinnende siden av polyuretan strimler produserer optisk glatt PDMS deler mens teksturerte siden forenkler demolding. Vi beskriver også bruk av en valgfri automatisert membran Fabricator (AMF) som gir ensartet komprimering av membran wafer muggsopp ved herding fabrikere opptil 24 membraner per satsvis. Designen er bredt aktuelt for studier av organer som består av vev som mekanisk belastning og perfusjon og disse brikkene kan produseres med lave chip til chip variasjon i mengder som kreves for å møte behovene til små og store forskning grupper. Arbeidsflyten er mottakelig for et parti- eller samlebånd format og lett kompatibel med kvalitet vurdering protokoller for kontroll over produksjonsprosessen, opplæring og forståelsesfull feilsøking. Vi håper at denne protokollen vil utvide tilgang til funksjonene i tokanals, elastisk, orgel sjetonger for grunnleggende og translasjonsforskning forskning.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. generelle forberedelser
- For å unngå rusk, rengjøring arbeidsområdet med pakking tape og tørke ned området med renrom tørke og isopropylalkohol.
- Alle trinnene krever PDMS, å blande PDMS i 10:1 forholdet (10 g av tvers linking agent, 100 g av elastomer base). Bland for hånd eller med en kommersielt tilgjengelig mikser. Bruke en planetarisk sentrifugal blandebatteri her: blande i 2 minutter på 2000 rpm, så avgassing PDMS i 2 minutter på 2200 rpm.
- Rengjør alle former med air gun å blåse ut rusk før å bruke.
Forsiktig: Ikke bruk metall pinsett fjerne rusk som det vil skade overflaten av formene.
2. topp kanal forberedelse
- Tørk den blanke siden av hvert polyuretan stykke med etanol og renrom wipes. Kontroller at alle gjenværende etanol tørket fra polyuretan overflaten.
- Legg den blanke siden av polyuretan over åpen av MiP mold lage et segl på den åpne siden av mold, forlater bare en vel som åpning på toppen av mold for helle PDMS.
Merk: Kontroller at hver mold er dekket sikkert av polyuretan eller PDMS vil lekke fra former under pouring. - Sett mugg og polyuretan samlingene i en MiP gigg, med teksturerte siden mot slutten av MiP dekopaj. Fortsett å gjøre dette til alle formene er plassert i dekopaj.
- Stram MiP dekopaj ved å slå håndtaket bruke en fastnøkkel til jig avstanden er 25 mm i bredden.
- Lage en båt med aluminiumsfolie rundt MiP dekopaj å forhindre overflødig PDMS lekker på overflater.
- Hell PDMS i hver av muggsopp godt til full.
Merk: Hver brikke topp komponenten krever ca 3 mL av PDMS. - Når hele jigg er fylt, plassere dekopaj i vakuum desiccator. Trekk vakuum ved-80 kPa 1t å degas PDMS.
- Etter 1 h, fjerne MiP dekopaj fra desiccator og sted i 60 ° C ovnen minst 4 h å kurere PDMS.
- Demontere MiP dekopaj med en skiftenøkkel, løsne dekopaj ved å slå håndtaket mot klokken. Når muggsopp er gratis komprimeringen, fjerne mugg fra jig.
- Fjerne polyuretan striper fra hver mold og kast.
- Forsiktig mold de PDMS deler fra sine former og lå funksjonen side opp.
- Linje opp blad av flis skraper på slutten kategorien hakk og kuttet bort hver ende til singulate øverste komponentene.
- Når deler av de følgende feilmodi og kast noen tilfredsstillende deler: riper i viktigste kanalen, store løsmasser over kanalen området, store bobler, deformert vakuum kanaler.
- Lagre ferdige deler i kvadrat Petri retter i trykk positiv skap ved romtemperatur.
3. bunnen kanal forberedelse
- Hell ca 10,5 g PDMS i formene til PDMS når toppen av hulrom.
- Undersøk bunnen kanal mold for PDMS kurert til bunnen av mold.
- Hvis skitne, skrape gamle PDMS fra bunnen av mold siden en ujevn overflate på bunnen av mold kan forårsake ujevn tykkelsen på den endelige deler.
Merk: For små < 2 cm2 områder som er avdekket, luften gevær kan brukes svært forsiktig å flytte PDMS over plassen.
- Sett mugg i vakuum desiccator 1t.
- Etter 1 h, flytte formene til en nivå 60 ° C ovn for > 4 h.
- Sett mugg på bordet i laminær strømning hette. Løsne PDMS fra en kant av mold.
- Grip et hjørne og forsiktig skrelle tilbake PDMS fra mold overflaten.
- Når fjernet, lå på arbeidsflaten, slik at kanalen funksjoner er ansiktet opp.
- Kuttet deler langs ytterkantene med flis cutters, plassere flisen cutter blad i hakk PDMS som i trinn 2.12.
- Lå deler funksjonen side på tape til fjern rusk.
- Fjern en del fra pakking tape. Dra den løse enden av delen over lysbildet. Den løse enden vil laminat med glass.
Merk: Det er viktig å unngå å strekke delen mens du legger det ned. Hvis boblen er fanget mellom del og glass, forsiktig løfte delen med tang og igjen lå. - Utføre kvalitetskontroll inspeksjon av deler. Sjekk deler til alle feilmodi og kast noen tilfredsstillende deler, inkludert de som inneholder riper i hovedkanalen, stort avfall, store bobler eller deformert vakuum kanaler.
- Dekk funksjonene med tape.
- Lagre deler i et positivt trykk skap ved romtemperatur.
4. PDMS membran forberedelse
- Kontroller at wafere er gratis PDMS på baksiden.
- Plass hver membran wafer i utpekte sporene i AMF magasinene.
- Bruk 1 mL sprøyte vil plassere 0.09 mL av PDMS på midten av hver membran wafer innlegget matrise. La PDMS sitte i minst 5 minutter å tillate PDMS å spre seg gjennom innlegg av membran kjeks.
Merk: Ikke Fortsett til neste steg til minst 75% av innlegget matrisen er dekket av PDMS. Det forbedrer kvaliteten av membraner jo lenger PDMS tillates å veken i innlegget området så lengre ventetider i dette trinnet foretrekkes. - Plasma behandle polykarbonat stripen på 20 W for 45 s, O2 gass på 0.80 mbar i en plasma maskin.
- Fjern polykarbonat arket fra plasma maskinen og bruk saks til å klippe polykarbonat arkene i 45 x 45 mm firkanter.
Merk: Minimere kontakt med plasma behandlet overflaten for å hindre støv fra stikker til polykarbonat. - Forsiktig legge plasma behandlet siden av polykarbonat rutene på den flytende PDMS sentrert på membran kjeks. Kontroller at polykarbonat og PDMS er i kontakt.
Merk: Unngå luftlommer mellom polykarbonat og PDMS. - Plass pre-cut PDMS mellomlegget på midten av polykarbonat.
- Plass pre-cut teksturerte polykarbonat arket på PDMS blokken å holde forsamlingen fra binding til komprimering plate.
- Sett inn skuffen slik at skuff 3 er i ryggen, skuff 2 er i midten og skuff 1 er i front. Skuff 1 har et hakk for justering.
- Åpne output press ventilen og veldig sakte åpne input trykket ventilen. Bare Lukk utgang trykket ventilen.
Merk: Dette er slik at utdataene 4 kg av makt brukes gradvis hver membran wafer i motsetning til umiddelbart, som kan ødelegge wafere. - Vend bryteren AMF on å starte herding syklusen. Kurere wafer under 4 kg (16 kPa) komprimering og en gradvis kroppstemperatur syklus oppført i tabell 1.
| Trinn | Temperatur (° C) | Varighet for |
| 1 | 20 | 20 |
| 2 | 35 | 10 |
| 3 | 45 | 10 |
| 4 | 50 | 60 |
| 5 | 60 | 120 |
| 6 | 20 | Hold |
Tabell 1 - membran herding forhold
- Lukke ventilen input press og åpne output press ventilen for å slippe trykket fra luft sylindere.
- Fjern skuffene og bringe dem til laminær strømning panseret.
- Nøye skrelle av strukturert polykarbonat og fjern forsiktig PDMS mellomlegget.
Merk: Se PDMS mellomlegget for å sikre det ikke også skrelle av polykarbonat transportøren, hvis dette skjer start peeling fra et annet hjørne.- Kontroller PDMS membranen gjennom polykarbonat bærer for områder med gjennom hull og bruke en markør for å spore omrisset av området gjennom hull og merke alle hullene eller feil membraner.
- Bruker wafer håndtering tang, løsne wafere fra skuffen.
- Fjerne hver membran fra kjeks og plasser i Petriskål.
Merk: PDMS membranen vil de mold fra membranen kjeks og vil bli overholdt polykarbonat støtte. Hvis PDMS starter frakobling fra polykarbonat transportøren, Skrell fra forskjellige regioner. - Lagrer membraner og wafere i Petri retter i et positivt trykk skap ved romtemperatur.
5. topp montering og forberedelse
- Bruker Matt tape, rense PDMS membraner samt innsiden av Petriskål å fjerne rusk.
- Grundig bånd funksjonen siden av hver topp komponent å fjerne rusk.
- Plasser øverste kanal del ("topp") funksjonen side opp i Petriskål med PDMS membran.
Merk: Vær oppmerksom på at noen membraner kan brukes for en eller to øverste deler avhengig av størrelsen av brukbare området. Den viktigste kanalene på hver toppen skal passe innenfor det markerte området av membranen. - Legg Petri retter i plasma maskinen.
- Plasma behandle membran og topp 20 W for 45 s, O2 gass på 0.80 mbar.
- Når bånd sykluser er ferdig, Fjern retter og legge aktivert deler funksjonen side ned over membranen og sikre del er fullt laminert med membran med noen bobler.
- Plassere deler i 60 ° C ovnen i minst 2 timer å anneal.
- Bruker en skalpell, spore rundt omkretsen av limt toppen skille topp-membran montering fra polykarbonat transportøren.
Merk: Ikke klippe transportøren. - Når delen er spores, Skrell samlingen fra polykarbonat. PDMS membranen som er limt til toppen bør Skrell fra transportøren.
- Bruker skarpe tippet pinsett, fjerne membranen fra portene som får tilgang til bunnen kanalen, og fjerne rusk eller støv med tang under en stereoscope.
Merk: Ikke la noen del av membranen som dekker tilgangsportens.
6. chip montering
- Funksjonen side opp, plasma behandle samlinger med bunnen komponenter med betingelsene i trinn 5.5.
- Under en invertert mikroskop, justere topp samlingen med microscope skyve til bunnen halvparten.
- Sett i 60 ° C ovnen i minst 2 timer.
- Chip kvalitetskontroll inspeksjon
Merk: Betale hensyn til de viktigste havnene og kanal chip. Sjekk for feilmodi av øyet, og også under mikroskopet.- For å sjekke at chip er limt fullt, rykk lett på hvert hjørne av chip etter delaminating deler.
- Se på kanalen av chip etter en krøllete eller sagging membran, som vises som et bølgemønster eller en lett deflection i kanalen.
- Utføre et mikroskop inspeksjon å inspisere for rusk i den viktigste kanalen.
Merk: Rusk i ikke-kritiske områder, slik som vakuum kanalene er akseptabelt. - Med chip fortsatt på invertert mikroskopet, inspisere hovedkanalen og vakuum kanaler for delaminering.
Merk: Delaminering i ikke-kritiske områder (f.eks kanten av chip) er akseptabelt. - Kontroller at den viktigste kanalene er justert til innen 50-60 µm (1-2 membran porene).
Merk: Det er viktig at de ikke overlapper med vakuum kanaler. - Kontroller at membranen mellom de viktigste kanalene og kanaler innløp og utløp er intakt uten noen tilsynelatende hull.
Merk: Noen hull i membranen kan føre til en lekk chip eller cellevekst utenfor kanalene.
- Store chips i Petri retter i et positivt trykk skap ved romtemperatur.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Protokollen presenteres her beskriver skalerbar fabrikasjon av PDMS Organ Chips. Disse enhetene kan kultur av to forskjellige perfused vev på en elastisk porøs membran (figur 1). PDMS kanalene er støpt med 3D trykt formene, som akselererer prototyper av nye design (figur 2A og 2B). Øverste kanalene er støpt i mugg under komprimering mot en kompatibel pakning for å produsere komponenter med støpte porter (figur 2C) mens bunnen kanal komponentene er i skuffer og håndteres på microscope skyve oppbakking (figur 2D). Denne fabrikasjon kombinerer multi-skala mønster av deler i ett enkelt trinn, som sparer tid, forbedrer reproduserbarhet og sporbarhet og reduserer rusk generert av port stansing og flere kutte trinn. Porøse membraner er avgjørende for funksjonen av orgel Chip, og fabrikasjon tilnærming basert på casting mot mønstret silisiumskiver resultater i membraner av konsekvent tykkelse og overflatebehandling (Figur 3). Håndtering via polykarbonat bærere gir større batch produksjon og lagring.
Samlet Organ Chip (Figur 4) består av to perfusjon kanaler i en optisk gjennomsiktig pakke. I regionen overlappende muliggjør en porøs membran PDMS vev-vev interaksjon metabolitter, proteiner, therapeutics, patogener, og cellene recapitulate chip organfunksjon mens to parallelle kanaler på hver side brukes til mekanisk belastning bruker syklisk vakuum aktivering. Porøsitet av PDMS membran biomimetically støtter fluks av metabolitter og vekstfaktorer også celler mellom blodkar og orgel parenchyma (figur 5). Tilsynelatende permeabilitet (Papp, cm/s) av membranen identifiserte med fargestoff konsentrasjonen i stikkontakt kanaler med og uten Caco2 gut celler. Gut chip celle lagene gir en betydelig økt barriere til permeabilitet. Orgel Chip kan være trukket ut ved hjelp av parallelle vakuum kanalene gjelder kvantitativt og reproduserbar syklisk belastning lasting membranen og derfor kulturperler vev (figur 6). Denne sykliske belastningen kombinert med media perfusjon støtter differensiering å bedre etterligne i vivo orgel fysiologi, som dannelsen av villi i Gut Chip.

Figur 2 : Kanal fabrikasjon med 3D trykt muggsopp. Orgel chip deler er kastet mot høyoppløselig 3D trykt muggsopp (A og B), som gir større fleksibilitet i design og prototyper enn tradisjonelle myk litografi. Topp kanal deler (C) er kurert under komprimering slipper punching porter i de ferdige delene. Hvert tre eksemplarer avstøpning er singulated med et enkelt snitt. Bunnen kanal deler (D) plasseres på glass lysbilder å lette brukervennlighet og bildebehandling. Skala barer er ca 1 cm i alle bilder. Klikk her for å se en større versjon av dette tallet.

Figur 3 : Porøse PDMS membranen stoper bruke DRIE mønstret silisiumskiver. (A) gjengivelse av 7 µm diameter, 50 µm høye micropillars etset med DRIE i en silicon wafer. (B) PDMS er herdet på denne matrisen under 4 kg av komprimering (16 kPa) for å opprette en 50 µm tykk membran med en rekke 7 µm diameter om hull linjeavstand hexagonally 40 µm fra hverandre. Klikk her for å se en større versjon av dette tallet.

Figur 4 : Bilde av en samlet PDMS Organ Chip. Rød farge fyller den større apikale kanalen brukt for parenchymal celler mens blått fargestoff høydepunkter basale kanalen brukes vanligvis for vaskulære endotelet. Klikk her for å se en større versjon av dette tallet.

Figur 5 : Permeabilitet av inert tracer Cascade blå gjennom mikroporøs PDMS membran. Gjennomgripende blå hydrazide fargestoff i medium ble lastet inn i øvre kanalen av orgel Chip og parfyme på 60 µL/t å måle fluks av fargestoff over membranen i bunnen kanalen som inneholder mediet. Tom chips ble sammenlignet med Gut Chips med Caco2-BBe1 celler i apikale kanalen og menneskelige vaskulær endotelial celler (HUVEC) i den basale kanalen kultivert for 6 dager. Feilfelt viser standard feil av gjsnitt. Klikk her for å se en større versjon av dette tallet.

Figur 6 : Bruk av membran belastning bruker vakuum-siden kanaler. Handlingen angir lineær belastning modulering av membranen som svar på en brukt vakuum press. Syklisk uniaxial belastning påføres jevnt kultur regionen Organ Chip bruker brukt vakuum til parallell siden kanaler. Belastningen korrelerer lineært med vakuum trykket på ca 1% belastning for hver-10 kPa endring i tomrommet trykket reduseres (R2 = 0.992). Feilfelt viser standardavviket for gjennomsnittet. Klikk her for å se en større versjon av dette tallet.
Tilleggsresultater materialer: Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Fabrikasjon prosessen er avhengig av høyoppløselig 3D trykt former for mønster PDMS øverst og nederst Organ Chip kroppen komponentene sammen med micromolded porøse PDMS membraner. Denne kritiske tilnærming ble valgt grunn å prototyping kombinert med rask overgang inn skalert opp fabrikasjon og utskifting av verktøy. Topp komponent formene er utformet for mønster porter i nøyaktig steder med definerte vertikale profiler under støping trinnet. Dette ikke bare unngår arbeidskraft involvert i manuelt punching tilgangsporter, men også reduserer rusk på arbeidsplassen, aktiverer reproduserbar port justering grensesnitt manifolder eller instrumentering, og produserer deler med kontroll over passform og tetting av settes inn rør eller pinner fluidic og pneumatisk. Formene er stablet oppå hverandre i en komprimering gigg, atskilt med kompatible polyuretan ark å forenkle gjennom hullet støping av porter. Ved stabling flere deler i en enkelt gigg, kan en enkeltbruker kaste store mengder komponenter med porter i ett enkelt trinn. Valg av materialer og produksjon metode for formene er avgjørende for å gi nødvendig funksjonen oppløsning, lav overflateruhet og høy grad av flathet for enheten forsamlingen og påfølgende tenkelig søknadene. Stereolitografi kan møte disse kravene, selv om materialer med høy nedbøyning temperaturer (> 80 ° C) og kompatibilitet med PDMS herding redusere tilgjengelig polymer området. Ulike kommersielt tilgjengelig harpikser, inkludert glass fylt harpikser, oppfyller disse kriteriene.
Elastisk porøse PDMS membranen er uten tvil det mest unike og kritiske komponenten av en Organ Chip samtidig de mest komplekse å dikte. En dyp reaktive ion etches (DRIE) prosessen outsourcet til en leverandør til å microfabricate 50 x 50 mm Sekskantet matriser av (7 µm diameter, 40 µm apart, 50 µm høye, C4F8 belagt) som brukes til mønster porene i membranen PDMS. Kvaliteten på pilar arrayene er kritisk for å oppnå robust membran avstøpning. Spesielt må søylene være etset å stramme toleransegrenser med glatte vertikale profiler å unngå undercuts eller overdreven sideveggen råhet som kan føre til mugg feil. Forsiktighet bør utvises å unngå "grassing" på bunnen av etset regionen, som kan påvirke membran demolding og celle vedlegg. Membran fabrikasjon med vellykket gjennom hull mønster og enhet integrering er enkelt mest komplekse delen av protokollen. Kritisk, er å plassere 0.09 mL av PDMS på hver kjeks og tilstrekkelig tid å spre viktig å unngå ufullstendig gjennom hull molding. Riktig er plasma behandling av polykarbonat backing nødvendig for å oppnå robust støtte av membranen for demolding og liming trinnene uten rynker eller strekke. Sikkerhetskopiering er en robust demolding kastet membranen fra skjøre silisium kjeks.
Kompresjons belastningen på hver kjeks er også avgjørende for uniform gjennom hull fabrikasjon. Tidligere innsats med vekter hindret membran produksjon og resulterte i dårlige avlinger på grunn av ikke-uniform force distribusjon. For å overvinne produksjon flaskehalsen, vi optimalisert tidligere publiserte membran fabrikasjon protokollen18 og bygget en automatisert membran Fabricator (AMF) å parallelize prosessen. AMF består av 24 pneumatiske stempler støttes over en programmerbar kokeplate å gi kontrollert kompresjons kraft gjennom et programmert PDMS herding prosessen. En polykarbonat støtte filmen er plassert på den uherdet PDMS og deretter komprimert jevnt med pneumatiske stempler av AMF mens oppvarming til danner PDMS. Kritisk, den gradvise herding prosessen beskrevet i protokollen fører til høyere kvalitet membraner enn et enkelttrinn til maksimum temperatur, der uttoning mønstre fra boble utvikling i herding prosessen ble observert. Mens valgfritt, øker AMF gjennomstrømningen betydelig utover det som er mulig med vekter i en ovn.
Feilsøking resulterende Organ Chips foregår på to nivåer: under fabrikasjon prosessen og under Organ Chip kultur. Vi har utviklet en visuell metode for kvalitetssikring (QA) gjennom hull-formasjonen i støpt membraner som sterkt akselererer prosessen mens forbedre kvaliteten og påliteligheten av samlet Organ Chips. Denne QA metoden gjør prosessen feilsøking, og vi anbefaler holder oversikt over prosessforhold aktivere sporing fabrikasjon problemer som kan oppstå under celle kultur. Under Organ Chip kultur er inert tracer fargestoffer den enkleste metoden å måle barriere-funksjonen for å feilsøke fabrikasjon prosessen og celle kultur trinnene. Lucifer gule har blitt brukt historisk pga liten molekylær masse og medfødte fluorescens, men Cascade blå tilbyr lignende egenskaper med en smalere utslipp spektrum som er mindre sannsynlig å forstyrre nedstrøms analyser. Større molekyler, som poly-ethyleneglycol (PEG)- eller dekstran-konjugerte fluorophores er større og dermed resulterer i lavere permeabilitet samlet og lavere følsomhet. Tilsynelatende permeabilitet (Papp, cm/s) av tracer fargestoffer kan brukes til å bestemme funksjonen barriereegenskaper av organer eller vev (Figur 4). Denne formelen kan brukes til å beregne Papp mellom dosering kanalen og mottar kanalen og er avledet fra formler brukes primært til Transwell studier19,20 og korrigerer for tracer fargestoff tap forårsaket av absorpsjon i PDMS ved å sammenligne de to utgang renn og ikke stole på masse balanse forutsetninger ved utløpet.

Vr er volumet i mL mottar kanalen avløpsvann etter tiden t; VD er volumet i mL dosering kanal avløpsvann etter tiden t; Er området av membran gjennom hull regionen i cm2 (0.167 cm2 for denne enheten); t er tiden av avløpsvann samling i sekunder. CR er målt endring i konsentrasjonen av tracer fargestoff i mottar kanalen avløpsvann; CD er målt konsentrasjonen av tracer fargestoff i dosering kanal avløpsvann. Viktige forutsetninger for denne ligningen gyldig inkluderer: 1) jevn tracer fargestoff dosering konsentrasjon over tiden t2) konsentrasjonen av Cr er liten i forhold til Cdog 3) permeabilitet av systemet er fordelt hele kultur regionen. Selv om dette kan brukes for statisk systemer, må utvises sjekke at forutsetningene gjelder. Elektrisk metoder, inkludert trans-epitelial motstand (TEER) er vanligvis gjennomført i Transwell studier og nylig har blitt innlemmet i PDMS Organ sjetonger for umiddelbar og kontinuerlig barriere funksjonen målinger samt21 ,22.
Begrensninger av denne protokollen inkludere elastisitet i PDMS samt den manuelle støping og samlingen prosessen som begrenser produksjonen. PDMS er en allsidig polymer som er godt egnet for orgel Chips krever mekanisk belastning aktivering, men sin elastisitet kan hindre produksjon. Deler kan være vanskelig å håndtere uten deformasjon og membraner krever støtte filmer for manipulasjon. Som et resultat, være automatisering av orgel Chip produksjon begrenset. Støpeprosessen, i motsetning til varme embossing eller injeksjon molding brukes for termoplastisk polymerer, er batch-baserte og derfor begrenser også gjennomstrømming.
Orgel Chips aktivere i vitro studier av human organ - og body-nivå funksjoner i vivo ved perfusing en vanlig medium vaskulær kanalene. Av gjenoppbygge fysiologiske vev-vev grensesnitt, fluks av molekyler mellom vaskulær og parenchymal rom, mekanisk signaler, og fluidic skjær og transport, disse enhetene fremme histodifferentiation og er i stand til recapitulating i vivo-like funksjoner både normal og syke organer. Compartmentalization av vev og væsker i to kammre etterligner deres i vivo funksjoner og orgel Chip studier er mottakelig for tid-løst farmakokinetiske eksperimentering og modellering samt i vitro-i vivo ekstrapolering9,10 som er vanskelig eller umulig i enkeltkanals MPS14,15,16. Microchannel-strukturer kan utnyttes for andre programmer, inkludert undersøke virkningen av dynamisk tobakksrøyk eksponering med toveis puste i menneskelig små luftveier epitel å utvikle romanen biomarkers lungen skade23. Definerte plasseringen av Plane membraner og høy optisk klarhet av enhetene gjør dem unikt egnet for avbildningsbasert analyser og integrering av innebygde sensorer. Mekanisk stimulering aktiveres av integrert vakuum kanaler og elastiske materialer gir funksjonalitet ikke mulig i Transwell systemer. Vi har vist at mekanisk belastning er avgjørende for recapitulation av visse i vivo fysiologiske funksjoner, inkludert hydrogenion absorpsjon i lunge4, lungeødem3 og differensiering av modne iPS-avledet glomerular podocytes8.
Fremtidige anvendelser av denne protokollen kan inkludere integrering av ulike sensing modaliteter som kan brukes til å gi sanntids readouts Organ Chip respons på stimuli som narkotika, giftstoffer eller stråling. Protokollen presenteres her kan utvides til ikke-PDMS materialer med ulike optisk, mekaniske og kjemiske egenskaper, inkludert biologisk nedbrytbart materiale. Orgel Chip protokollen presenteres her bør aktivere forskere å dikte enheter som tilbyr en høy grad av kontroll over microenvironment av sunn og pathophysiologic vev og organer, som kan utnyttes for terapeutisk utvikling, inkludert målrette oppdagelsen, giftighet og farmakokinetiske vurderinger, samt for personlige medisin.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
D.E.I. er grunnlegger og holder egenkapital i etterligne, Inc., og stoler dens vitenskapelige advisory board. J.P. er for tiden ansatt i etterligne, Inc. R.N., Y.C., J.P., og D.E.I. er oppfinnere på intellektuell eiendom som er lisensiert til etterligne, Inc.
Acknowledgments
Vi takker M. Rousseau og S. Kroll for hjelp med fotografering og videography og M. Ingram, J. Nguyen, D. Shea og N. Wen for bidrag til første fabrikasjon protokollutvikling. Denne forskningen ble sponset av Wyss Institutt for biologisk inspirert i Engineering ved Harvard University og Defense Advanced Research Projects Agency under samarbeidende avtaler #W911NF-12-2-0036 og #W911NF-16-C-0050 og FDA gi # HHSF223201310079C, NIH tilskudd #R01-EB020004 og #UG3-HL141797-01, og Bill og Melinda Gates Foundation gir #OPP1163237 og #OPP1173198 til DEI. Synspunkter og konklusjoner finnes i dette dokumentet er de av forfatterne, og bør ikke tolkes som representerer de offisielle politikk, enten direkte eller indirekte, av Defense Advanced Research Projects Agency, Food and Drug Administration, den National Institutes of Health, eller den amerikanske regjeringen.
Materials
| Name | Company | Catalog Number | Comments |
| Personal Protective Equipment | |||
| Hairnet | VWR | 89107-770 | |
| Tyvek lab coat | VWR | 13450-506 | |
| Extended cuff gloves | VWR | 89521-898 | |
| Equipment | |||
| Cutting mat | VWR | 102096-430 | |
| Tile cutter | McMaster-Carr | 26765A31 | |
| Mold-in-place (MIP) top molds | Protolabs, Inc. | custom | printed in Prototherm 12120 |
| Mold-in-place (MIP) bottom molds | Protolabs, Inc. | custom | printed in Prototherm 12121 |
| Duckbill curved forceps | VWR | 63041-864 | |
| Sharp tipped forceps | Electron Microscopy Sciences | 72700-D | |
| Metal spatula | VWR | 82027-528 | |
| Deep reactive ion etch (DRIE) pillar array wafers | Sensera, Inc. | custom | Four 50 x 50 mm pillar arrays per wafer; pillars 7 um wide, 50 um tall, spaced hexagonally 40 um apart |
| Textured polycarbonate .01” thick | McMaster-Carr | 85585K33 | cut to 45 mm square |
| PDMS blocks (40 x 40 x 5 mm) | n/a | custom | |
| Laminar flow hood | Germfree | BVBI | cast in-house |
| Air gun | |||
| 60°C level oven | |||
| Vacuum desiccator | |||
| Mass balance | accuracy to 0.1 g | ||
| Plasma machine | Diener | Nano | oxygen plasma capability is critical |
| Supplies | |||
| Sylgard 184 poly (dimethylsiloxane) (PDMS) base/curing agent kit | Ellsworth Adhesives | 4019862 | |
| Mixing cup | Ensure adequate ventilation when handling prepolymer due to low levels of ethylbenzene | ||
| 1 mL syringe | VWR | 10099-395 | |
| Cleanroom wipes | VWR | TWTX1080 | |
| 25 x 75 mm glass microscope slides | VWR | 48311-703 | |
| Packing tape | VWR | 500043-724 | |
| Scotch tape | VWR | 500026-873 | |
| Die-cut Polyurethane (PU) strips | Atlantic Gasket, Inc. | custom: AGWI2X3 | 1/8” thick; 60 Durometer Black Polyurethane; 2” x 3” |
| Polycarbonate film .005” thick | McMaster-Carr | 85585K102 | |
| 100 x 100 x 15 mm square gridded petri dishes | VWR | 60872-480 | |
| Aluminum foil | |||
| Optional Equipment | |||
| Thinky PDMS Mixer | Thinky | ARE-310 | |
| Mold-in place (MIP) jig | in-house | screw clamp compression jig | |
| Automated membrane fabricator (AMF) | in-house | pneumatic compression piston array with programmable heater |
References
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Benam, K. H., et al. Engineered In vitro Disease Models. Annual Review of Pathology Mechanisms of Disease. 10 (1), 195-262 (2015).
- Huh, D., et al. A Human Disease Model of Drug Toxicity-Induced Pulmonary Edema in a Lung-on-a-Chip Microdevice. Science Translational Medicine. 4 (159), 159ra147 (2012).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328 (5986), 1662-1668 (2010).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-Chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), E7-E15 (2016).
- Musah, S., et al. Mature induced-pluripotent-stem-cell-derived human podocytes reconstitute kidney glomerular-capillary-wall function on a chip. Nature Biomedical Engineering. 1 (5), s41551-017-0069–017 (2017).
- Somayaji, M. R., Das, D., Przekwas, A. Computational approaches for modeling and analysis of human-on-chip systems for drug testing and characterization. Drug Discovery Today. 21 (12), 1859-1862 (2016).
- Prantil-Baun, R., et al. Physiologically Based Pharmacokinetic and Pharmacodynamic Analysis Enabled by Microfluidically Linked Organs-on-Chips. Annual Review of Pharmacology and Toxicology. 58 (1), 37-64 (2018).
- Mahler, G. J., Esch, M. B., Stokol, T., Hickman, J. J., Shuler, M. L. Body-on-a-chip systems for animal-free toxicity testing. Alternatives to laboratory animals: ATLA. 44 (5), 469-478 (2016).
- Miller, P. G., Shuler, M. L. Design and demonstration of a pumpless 14 compartment microphysiological system. Biotechnology and Bioengineering. 113 (10), 2213-2227 (2016).
- Coppeta, J. R., et al. A portable and reconfigurable multi-organ platform for drug development with onboard microfluidic flow control. Lab Chip. 17 (1), 134-144 (2016).
- Wikswo, J. P., et al. Scaling and systems biology for integrating multiple organs-on-a-chip. Lab on a Chip. 13 (18), 3496-3511 (2013).
- Sung, J. H., et al. Using PBPK guided "Body-on-a-Chip" Systems to Predict Mammalian Response to Drug and Chemical Exposure. Experimental biology and medicine (Maywood, N.J.). 239 (9), 1225-1239 (2014).
- Stokes, C., Cirit, M., Lauffenburger, D. Physiome-on-a-Chip: The Challenge of "Scaling" in Design, Operation, and Translation of Microphysiological Systems. CPT: Pharmacometrics & Systems Pharmacology. 4 (10), 559-562 (2015).
- Shirure, V. S., George, S. C. Design considerations to minimize the impact of drug absorption in polymer-based organ-on-a-chip platforms. Lab Chip. , (2017).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Tran, T. T., et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108-2123 (2004).
- Henry, O. Y. F., et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B. M., et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K. H., et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466 (2016).
Tags
Bioteknologi problemet 140 orgel på-chip microphysiological system microfluidic microfabrication PDMS porøs membran microchannel syklisk belastning perfusjonErratum
Formal Correction: Erratum: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips
Posted by JoVE Editors on 05/08/2019.
Citeable Link.
An erratum was issued for: Scalable Fabrication of Stretchable, Dual Channel, Microfluidic Organ Chips. The Representative Results, Discussion, and References sections have been updated.
In the Representative Results section, the legend for Figure 5 has been updated from:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µL/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. Error bars indicate standard error of the mean.
to:
Figure 5: Permeability of inert tracer Cascade Blue through the microporous PDMS membrane. Cascade Blue hydrazide dye in medium was loaded into the top channel of the Organ Chip and perfused at 60 µl/h to measure the flux of the dye across the membrane into the bottom channel containing medium. Empty chips were compared to Gut Chips with Caco2-BBe1 cells in the apical channel and human vascular endothelial cells (HUVEC) in the basal channel cultured for 6 days. The apparent permeability (Papp, cm/s) of the microporous PDMS membrane was determined using the dye concentration in the outlet channels. The gut chip cell layers provide a significantly increased barrier to permeability. Error bars indicate standard error of the mean.
In the Discussion section, the fourth paragraph has been updated from:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 4). The following equation can be used to calculate Papp between the dosing channel and receiving channel and is derived from equations used primarily for Transwell studies19,20 and corrects for tracer dye loss caused by absorption into PDMS by comparing the two output flows and not relying on mass balance assumptions at the outflow.
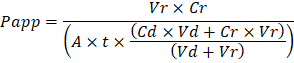
to:
Troubleshooting the resulting Organ Chips takes place at two levels: during the fabrication process and during Organ Chip culture. We have developed a visual method for quality assurance (QA) of through-hole formation in the cast membranes that greatly accelerates the production process while improving the quality and reliability of assembled Organ Chips. This QA method allows for process troubleshooting, and we recommend keeping a record of process conditions to enable tracking fabrication problems that may occur during cell culture. During Organ Chip culture, inert tracer dyes are the simplest method of measuring barrier function to troubleshoot the fabrication process and cell culture steps. Lucifer Yellow has been used historically due to its small molecular mass and innate fluorescence, but Cascade Blue offers similar properties with a narrower emission spectrum that is less likely to interfere with downstream assays. Larger molecules, such as poly-ethyleneglycol (PEG)- or dextran-conjugated fluorophores are larger and consequently result in lower permeability overall and lower sensitivity. The apparent permeability (Papp, cm/s) of tracer dyes can be used to determine barrier function properties of organs or tissues (Figure 5). The following equation derived by Tran, et al.19 can be used to calculate Papp between the dosing channel and receiving channel, which partially corrects for tracer dye loss caused by absorption into PDMS by averaging the two output flows and not relying on mass balance assumptions at the outflow.
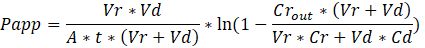
The References section has been updated from:
- Blaser, D.W. Determination of drug absorption parameters in Caco-2 cell monolayers with a mathematical model encompassing passive diffusion, carrier-mediated efflux, non-specific binding and phase II metabolism. at <http://edoc.unibas.ch/655/1/DissB_7998.pdf> (2007).
- Hubatsch, I., Ragnarsson, E.G.E., Artursson, P. Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers. Nature Protocols. 2 (9), 2111-2119 (2007).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).
to:
- Tran, T.T. et al. Exact kinetic analysis of passive transport across a polarized confluent MDCK cell monolayer modeled as a single barrier. Journal of Pharmaceutical Sciences. 93 (8), 2108–2123 (2004).
- Henry, O.Y.F. et al. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Maoz, B.M. et al. Organs-on-Chips with combined multi-electrode array and transepithelial electrical resistance measurement capabilities. Lab on a Chip. 17 (13), 2294-2302 (2017).
- Benam, K.H. et al. Matched-Comparative Modeling of Normal and Diseased Human Airway Responses Using a Microengineered Breathing Lung Chip. Cell Systems. 3 (5), 456-466.e4 (2016).



