Summary
MALT1 regelt aangeboren immuniteit, maar hoe dit gebeurt blijft vaag. We gebruikten de selectieve MALT1 paracaspase remmer MLT-827 te ontrafelen van de bijdrage van MALT1 aan het aangeboren signalering stroomafwaarts van Toll-like of C-type lectine-achtige receptoren, aan te tonen dat MALT1 de productie van myeloïde cytokines regelt, en "downstream" C-type lectine-achtige receptoren, selectief.
Abstract
Naast zijn functie in de lymfoïde cellen, die door tal van studies is gericht, speelt de paracaspase MALT1 ook een belangrijke rol bij aangeboren cellen stroomafwaarts van patroon erkenning receptoren. Beste studeerde zijn de Dectin-1 en Dectin-2 leden van de C-type lectine-achtige receptor familie die een Unnethes - en CARD9-afhankelijke signalering cascade die leiden tot activering van NF-recombination, in een MALT1-afhankelijke manier induceren. Door contrast, Toll-like receptors (TLR), zoals TLR-4, propageren NF-recombination activering maar signaal via een MYD88/IRAK-afhankelijke cascade. Toch, of MALT1 kunnen bijdragen aan de TLR-4 signalering bleef onduidelijk. Recente blijkt met MLT-827, een krachtige en selectieve remmer van MALT1 paracaspase activiteit, dat TNF-productie stroomafwaarts van TLR-4 in menselijke myeloïde cellen is onafhankelijk van de MALT1, in tegenstelling tot de TNF-productie stroomafwaarts van Dectin-1, die MALT1 afhankelijk. Hier, wij gericht de selectieve betrokkenheid van MALT1 in de patroonherkenning sensing verder, met behulp van een verscheidenheid van mens en muis cellulaire preparaten, en stimulatie van Dectin-1, MINCLE of TLR-4 trajecten. Wij voorzien ook aanvullende inzichten door het verkennen van cytokines beyond TNF- en door het vergelijken van MLT-827 een inhibitor van Unnethes (Cpd11) en een IKK-remmer (AFN700). Collectief, de verstrekte gegevens verder bewijs voor de MALT1-afhankelijkheid van C-type lectine-achtige receptor — signalering daarentegen aan TLR-signalering.
Introduction
De activiteit van de paracaspase van MALT1 (Mucosa-geassocieerde lymfoïde weefsel lymfoom translocatie eiwit 1) werd geopenbaard in 20081,2. Sindsdien hebben een aantal studies zijn kritische bijdrage aan antigeen receptor reacties in lymfocyten gemeld. Genetische modellen in de muis, alsmede farmacologie gegevens ondersteunen een sleutelrol in de T-cellen, T-cel afhankelijke autoimmuniteit en B-cel lymfoom instellingen3,4. In lymfocyten, MALT1 paracaspase activering treedt op bij montage van een CARD11-BCL10-MALT1 complex5, die is veroorzaakt door antigeen-receptor proximale signalering stroomafwaarts van de T - of B-cel-receptoren. Er is ook voldoende bewijs dat een soortgelijke CARD9-BCL10-MALT1-complex belangrijk is voor het teeltmateriaal signalen stroomafwaarts van C-type lectine-achtige receptoren (CLLR), bijvoorbeeld, Dectin-1 en Dectin-2 MINCLE in myeloïde cellen6,7. Dectin-1 is bijzonder goed onderzocht omdat dit traject is van cruciaal belang voor de verdediging van de gastheer tegen schimmelinfecties8,9. Implicatie van MALT1 in de Toll-like receptor (TLR) wegen, is echter omstreden10gebleven. Recente gegevens in menselijke myeloïde cellen zijn uitgesloten van een directe rol voor MALT1 paracaspase activiteit in de regulering van de TNF-productie stroomafwaarts van TLR-411.
In het huidige werk, we gebruikten verschillende experimentele instellingen en stimulerend voorwaarden in mens en muis myeloïde cellen sonde aangeboren signaalroutes, afhankelijk van de specifieke farmacologische tool-remmers en meting van cytokine productie.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Experimenten werden uitgevoerd volgens de richtlijnen en normen van de ethische commissie voor Novartis menselijke onderzoek.
1. bereiding van perifere bloed mononucleaire cellen (PBMCs) uit menselijke Buffy Coats
Opmerking: Wij ontvangen buffy coats gezonde vrijwilligers een dag na het verzamelen, in zakken van 50 mL. Ze werden krachtens geïnformeerde toestemming en verzameld via het Interregionale Blutspende Schweizeriches Rotes Kreuz. We behandeld met behulp van de procedure hieronder, bij kamertemperatuur, tenzij anders is bepaald.
- Bereiden een steriele en schone paar van schaar en een bekerglas van 1 L met een plastic zak (onder een lamina stroom).
- Breng de buffy coat in het bekerglas en zorgvuldig te openen met de schaar.
- Met behulp van een precisiepipet 25 mL, voeg 100 mL-fosfaatgebufferde zoutoplossing buffer/ethyleendiamminetetra zuur (PBS/EDTA: PBS 1 x pH 7.4 met geen CaCl2 en geen MgCl2, aangevuld met 2 mM EDTA pH 8,0).
Opmerking: Met behulp van hetzelfde Pipetteer en na langzaam pipetteren de oplossing op en neer, breng 25 mL van de verdunde buffy coat in 6 conische centrifuge buizen van 50 mL vooraf gevuld met 15 mL polysaccharide gebaseerde dichtheid verloop. - 20 min op 800 x g centrifugeren met matige versnelling (vastgesteld op 4 van 9) en zonder de rem te voorzien in scheiding van cellen op basis van hun dichtheid.
Opmerking: Na het centrifugeren zullen drie lagen zichtbaar; een pellet met rode bloedcellen en granulocyten, een bovenste laag gemaakt van plasma, en tussen een witte ring met perifere bloed mononucleaire cellen (PBMCs). - Oogst de PBMC ring met behulp van een pipet 10 mL en overdracht aan de nieuwe 50 mL tubes.
Opmerking: Twee tot drie 50 mL buizen zijn normaal vereist per buffy coat. In dit stadium vervuilt sommige waarschijnlijk plasma de verzamelde PBMCs, die geen effect op de latere verrijking stappen hebben moeten. - Top van maximaal 50 mL elke buis met behulp van PBS/EDTA en overgaan tot drie opeenvolgende wast met afnemende centrifugeertijd en snelheid (15 min op 520 x g, 10 min op 330 x g, 8 min op 150 x g).
Opmerking: Bij elke stap het supernatant wordt gegoten uit in een vloeibare afval container en geresuspendeerde pellet van de cel is in 50 mL PBS/EDTA (pellets mogen worden samengevoegd na de eerste wasbeurt). - Na de definitieve wash, resuspendeer de pellet in een ijskoude lysis-buffermengsel 25 mL (Zie Tabel van materialen) lyse van de rode bloedcellen door de osmotische druk.
- Incubeer de oplossing pas duidelijk (≤5 min bij kamertemperatuur).
- Zet de reactie stop door toevoeging van 25 mL scheiding buffer (PBS 1 x pH 7.4 met geen CaCl2 en geen MgCl2, aangevuld met 2% warmte-geïnactiveerd foetale runderserum (FBS) en 1 mM EDTA pH 8.0).
- Nog een keer wassen bij 150 x g gedurende 8 min.
Opmerking: In dit stadium PBMCs kunnen worden gebruikt als een bulk populatie (zie stap 3: PBMCs en monocyten behandelingen en stimulerend voorwaarden) of verwerkt voor monocyt verrijking (zie stap 2: bereiding van monocyten van PBMCs), of bevroren neer voor later gebruik (zie stap 5: Monocyten en PBMCs procedures invriezen/ontdooien).
2. voorbereiding van de monocyten van PBMCs
- Resuspendeer de PBMCs verkregen bij stap 1.10 in scheiding buffer en tellen ze om te bereiken van 5 x 10,7cellen/mL.
- Breng de celsuspensie in een tube conische centrifuge 14 mL met dop.
- Voeg 50 µL van monocyt verrijking antilichaam cocktail per mL celsuspensie, vortex, en incubeer 10 min bij 4 ° C.
- Voeg 50 µL van monocyt verrijking kralen per mL cellen.
Opmerking: De kralen moet grondig vortexed om de homogeniteit van de schorsing. - Na het toevoegen van de kralen, binnenkort de celsuspensie vortex en incubeer 5 min bij 4 ° C.
- Spoel het bovenste gedeelte van de buis met scheiding buffer totdat de buis gevuld is tot 10 mL.
- Meng de oplossing langzaam door pipetteren omhoog en omlaag.
- Plaats de buis zonder dop in een scheiding-magneet.
- Incubeer gedurende 2,5 minuten bij kamertemperatuur.
- Giet langzaam in een tube van 15 mL conische centrifuge.
- In dit stadium rechtstreeks monocyten gebruiken (zie stap 3: PBMCs en monocyten behandelingen en stimulerend voorwaarden) of ze verschillen in ikmmature Monocyte afkomstige Dendritic Cells (iMoDCs) (zie stap 4), of bevriezen ze af voor later gebruik (zie stap 5).
3. PBMCs en monocyten behandelingen en stimulerend voorwaarden
- Cellen tellen en vul ze in een kweekvloeistof (Roswell Park Memorial Instituut medium (RPMI) 10% FBS + 1 mM natrium pyruvaat 100 U/mL penicilline streptomycine (Pen/Strep) + 5 µM β-mercaptoethanol), tot 1.25 x 104 cellen per putje.
- Distribueren 30 µL celsuspensie per putje van de plaat van een 384-well.
- Voeg 15 µL van 4 x geconcentreerd samengestelde oplossingen en vooraf Incubeer gedurende 1 uur bij 37 ° C, 5% CO2.
- Lipopolysaccharide (LPS) toevoegen om een eindconcentratie van 10 ng/mL, verarmd zymosan (DZ) tot een uiteindelijke concentratie van 100 µg/mL, of houden in gewone medium.
- Na een nacht bebroeden bij 37 ° C, 5% CO2.
- Neem 10 µL van het supernatans dat voor het meten secreted TNF-a (zie stap 7: Cytokines en levensvatbaarheid metingen).
4. monocyten differentiatie in iMoDCs en stimulerend voorwaarden
- Monocyten (verrijkt bij stap 2) tellen samen en centrifugeer de celsuspensie bij 520 x g gedurende 5 min.
- Pipetteer af het supernatant en voeg kweekmedium (RPMI + 10% FBS te verkrijgen van een definitieve celsuspensie van 0,4 x 106 cellen/mL.
- Voeg 80 ng/mL recombinante menselijke IL-4 + 100 ng/mL GM-CSF.
- Afzien van 5 mL celsuspensie per putje in een 6-well-plate.
- Incubeer gedurende 7 dagen bij 37 ° C, 5% CO2.
- Op dag 7, oogst cellen door pipetteren voorzichtig om te voorkomen dat hun activering.
- Centrifugeer bij 520 x g gedurende 5 min.
- Aspirate vacuüm en resuspendeer in 50 mL gestolde voedingsbodem zonder groeifactoren.
- Centrifugeer bij 520 x g gedurende 5 min en resuspendeer bij 1 x 106 cellen/mL in een cultuurmedium.
- Afzien 100 µL celsuspensie (105 cellen) per putje van een 96-Wells platte bodemplaat.
- Vooraf incubate gedurende 1 uur bij 37 ° C na het toevoegen van 50 µL van 4 x geconcentreerd samengestelde oplossingen, bereid zoals beschreven bij stap 8: verbindingen van voorbereiding.
- Voeg 50 µL van stimuli (4 x geconcentreerd), bereid zoals beschreven bij stap 9.
- Incubeer 24 uur bij 37 ° C.
- Meng elk goed en overdracht cellen en supernatant (SN) in een 96-Wells-V-bodemplaat.
- Spin down bij 475 x g gedurende 5 min.
- Pipetteer bovendrijvende substantie in een nieuwe 96-Wells platte bodemplaat, seal en bevriezen bij-20 ° C tot verder gebruik.
5. monocyten en PBMCs invriezen/ontdooien Procedures
-
Bevriezing
- Spin down PBMC of monocyt cel preparaten op 520 x g gedurende 5 minuten.
- Vacuüm gecombineerd het supernatant en resuspendeer de cellen in de bevriezing van medium 1 x 107 cellen/ml.
- Afzien van 1 mL celsuspensie in cryotubes, de buizen overbrengt naar een specifieke koeling apparaat (Zie materialen tabel) en plaats deze bij-80 ° C.
-
Ontdooien
- Ontdooi de cryotube en snel overbrengen van de inhoud in een 15 mL conische centrifugebuis met 9 mL gestolde voedingsbodem.
- Centrifugeer bij 520 x g gedurende 5 min.
- Vacuüm aspirate supernatant en resuspendeer de pellet cel in 5 mL gestolde voedingsbodem. Cellen zijn nu gereed voor verdere experimentele verwerking.
6. muis milt cellen voorbereiding en behandeling
Opmerking: Wij uitgevoerd dierlijke offers volgens de richtlijnen en normen van de organisatie van Novartis Animal Welfare. Studies werden goedgekeurd door de ethische commissie van de regionale overheidsinstantie (Kantonales Veterinäramt der Stadt Basel). We dieren geofferd door Isofluraan overmatige blootstelling, met alle inspanningen om het lijden te minimaliseren.
- Oogst van de milt en distantiëren van weefsel met behulp van een buis voorzien van een mechanische weefsel grinder apparatuur en gevuld met 5 mL koude RPMI voedingsbodem.
- Het programma van de milt van de dissociatie machine fijn organen te gebruiken.
- Filtreer de cellen door een 100 mm nylon cel zeef.
- Spoel de suspensie in 50 mL tubes en centrifugeer bij 4 ° C gedurende 10 minuten bij 320 x g.
- Vacuüm aspirate het supernatant, resuspendeer de pellet cel in 3 mL ijskoud lysis-buffermengsel en incubeer gedurende ≤2 min op ijs.
- Stop lysis door toevoeging van 7 mL van RPMI medium.
- Filtreer opnieuw door een 100 µm nylon cel zeef.
- Spin down celsuspensie bij 330 x g gedurende 10 minuten bij 4 ° C.
- Vacuüm aspirate supernatant en resuspendeer de cellen bij 11 x 106 cellen/mL in volledige medium (RPMI aangevuld met 10% FBS, 100 U/mL Pen/stap en 5 µM β-Mercaptoethanol).
- Plaat 1 x 106 cellen/well (90 µL) in een 96-wells-plaat (platte bodem).
- Voeg 5 µL van 20 x geconcentreerd samengestelde oplossing eerder verdund in RPMI medium zoals beschreven in stap 8.3: seriële verdunning voor lymfkliertest milt cellen.
- Incubeer gedurende 30 minuten bij 37 ° C, 5% CO2.
- Voeg 5 µL van 20 x geconcentreerd DZ (eindconcentratie 30 µg/mL) of 20 x geconcentreerd LPS + IFN-g (TLR-4) (eindconcentratie 1 µM LPS en 10 ng/mL IFN-g).
- Na een nacht bebroeden bij 37 ° C, 5% CO2.
- Centrifugeer bij 330 x g gedurende 10 minuten.
- Overdracht van supernatant in nieuwe platen, seal en bevriezen bij-20 ° C tot verder gebruik.
7. Cytokines en levensvatbaarheid metingen
-
Menselijke TNF-a meting door HTRF (homogene tijd opgelost fluorescentie)
Opmerking: Het protocol gevolgd van de leverancier aanbevelingen, hieronder kort samengevat.- Meng 1 deel van het gereconstitueerde reagens (anti-TNF-a-cryptate en anti-TNF-a-XL665) met 19 delen van reconstitutie buffer (50 mM fosfaatbuffer pH 7.0, 0,8 M kalium fluoride (KF), 0,2% bovien serumalbumine (BSA)).
- Meng de twee oplossingen voor kant-en-klare antilichaam 1:1 vlak voor de verstrekking van de reagentia.
- Afzien van 10 µL van supernatant van stap 3.6 in witte 384-Wells-platen.
- Afzien van 10 µL van het mengsel van antilichamen.
- De afdekplaat met een sealer en na een nacht bebroeden bij 4 ° C.
- Lees de plaat op een microplate-lezer (50 – 200 Flits).
- Menselijke meting van de IL-23 door HTRF (homogene tijd opgelost fluorescentie)
Opmerking: Het protocol gevolgd van de leverancier aanbevelingen, hieronder kort samengevat.- Meng 1 volumedeel gereconstitueerde reagens (anti-IL-23-cryptate-antilichaam en anti-IL-23 D2-antilichaam) met 19 delen detectie buffer #3.
- Meng de twee oplossingen voor kant-en-klare antilichaam 1:1 vlak voor de verstrekking van de reagentia.
- Afzien van 10 µL van supernatant van stap 3.6 in witte 384-Wells-platen.
- Afzien van 10 µL van het mengsel van antilichamen.
- De afdekplaat met een sealer en na een nacht bebroeden bij 4 ° C.
- Lees de plaat op een microplate-lezer (50 – 200 nm flash).
-
Menselijke IL-6, IL-8, IL-1β en TNF-α metingen door electrochemiluminescence
Opmerking: Alle monsters zijn verdund bij 1/150 in verdunningsmiddel 2 (eerste verdunning: 10 µL in 150 µL, dan 20 µL in 180 µL). Het protocol gevolgd van de leverancier aanbevelingen:- Verdun monsters en standaard in verdunningsmiddel 2.
- Ga verder met de verdunning van de standaard in verdunningsmiddel 2 met behulp van een verdunning van 1/4 seriële vouwen.
- Spoel de platen driemaal met was buffer.
- Breng 50 µL van monsters of norm per putje.
- Incubeer gedurende 2 uur bij kamertemperatuur onder agitatie.
- Wassen van de plaat viermaal met PBS + 0,05% Polysorbaat 20.
- 25 µL van detectieantilichaam (60 µL van elke antilichamen tegen 3 mL definitieve) in verdunningsmiddel 3 toevoegen.
- Incubeer gedurende 2 uur bij kamertemperatuur onder agitatie.
- Wassen van de plaat viermaal met PBS + 0,05% Polysorbaat 20.
- Het vermijden van bubbels, toevoegt 150 µL per putje van leesbuffer (Tris gebaseerde buffer met tripropylamine, verdund 2 x in ddH20) als een co reactieve voor lichte generatie in electrochemiluminescence immunoassay.
- Lees de plaat (onverwijld) op een multiplex-afleesapparaat.
-
Muis TNF-a meting door ELISA volgens protocol van de leverancier
- Verdun supernatans 1:1 in assay verdunningsmiddel (klaar voor gebruik eiwithoudende buffer).
- Bereiden standaard verdunningen, reagentia en monsters als beschreven in de kit. Voeg 50 l assay verdunningsmiddel aan elk putje.
- Voeg 50 l standaard, het besturingselement of monster per putje.
- Meng door zachtjes te tikken op het frame van de plaat voor 1 min.
- Dek af met de meegeleverde zelfklevende strip en incubeer gedurende 2 uur bij kamertemperatuur.
- Gecombineerd elkaar goed en wassen met 400 μl per putje (Herhaal deze stap vijf keer in totaal).
- Na de definitieve wash, Verwijder eventuele resterende was buffer door zuigen.
- De plaat omkeren en vlek tegen schone papieren handdoeken.
- Voeg 100 μl van muis TNF-α conjugaat aan elk putje. Bedek met een nieuwe zelfklevende strip.
- Incubeer gedurende 2 uur bij kamertemperatuur.
- Herhaal de aspiratie/wassen zoals in stap 7.4.4.
- Voeg 100 μl van substraat oplossing aan elk putje en incubeer gedurende 30 minuten bij kamertemperatuur beschermd tegen licht.
- Voeg 100 μl van verdund zoutzuuroplossing (eindeoplossing) toe aan elk putje. Tik zachtjes op de plaat om ervoor te zorgen homogenisatie van het mengsel.
- Meten van de extinctie bij 450 nm (met de golflengte van de correctie vastgesteld op 560 nm) met behulp van een microplate-lezer (moet worden gedaan binnen 30 min).
- Verdun supernatans 1:1 in assay verdunningsmiddel (klaar voor gebruik eiwithoudende buffer).
-
Levensvatbaarheid van de cellen
- Na het verwijderen van supernatant van PBMC of monocyt preparaten, beoordelen de levensvatbaarheid van de cellen met behulp van een klaar om resazurin oplossing (oxidation-reduction indicator) toegevoegd rechtstreeks naar de celsuspensie aan eindconcentratie van 10% te gebruiken.
- Incubeer gedurende 1 tot 2 uur bij 37 ° C, 5% CO2.
- Lees de fluorescentie bij 590 nm (excitatie 540 nm) met behulp van een microplate-lezer.
8. samengestelde voorbereiding
-
Seriële verwatering voor iMoDCs
- Verdun de stockoplossing MLT-827 (10 mM dimethylsulfoxide (DMSO) in medium om te bereiken van 8 µM in één keer (4 x geconcentreerd).
- Het uitvoeren van een zes-stap 1:5 seriële verdunning, met behulp van medium + 0,08% DMSO. Gebruik de hetzelfde medium + 0,08% DMSO oplossing voor de staat van het voertuig (geen verbinding).
-
Enkelvoudige dosis testen voor iMoDCs
- Verdun de voorraadoplossingen MLT-827, AFN700 en Cpd11 in medium om te bereiken 4 µM in één keer (4 x geconcentreerd).
-
Seriële verdunning voor lymfkliertest milt cellen
- Verdun een oplossing van 10 µM MLT-827 (verkregen uit een stamoplossing van 10 mM, na een een ga verdunning in medium) tot 0,01 µM, met een DMSO einde concentratie van 0,1%.
- Voor de verdunning stappen, neem 2 µL van elke verdunning, toevoegen van 38 µL RPMI en Pipetteer 5 µL in de put.
Opmerking: Alle behandelingen worden uitgevoerd in drievoud.
9. stimuli voorbereiding
-
Verarmd zymosan (DZ)
- Voeg 2 mL steriele endotoxine-gratis water met 10 mg DZ.
- Vortex te homogeniseren van de stockoplossing, vortex ook voorafgaande elk gebruik.
- Aliquot oplossing en winkel aliquots bij-20 ° C.
-
Trehalose-6,6-dibehenate (TDB)
- Voeg 100 µL van DMSO tot 1 mg TDB, warmte bij 60 ° C in een waterbad voor 15 – 30 s.
- Vortex en onmiddellijk 900 µL van steriele PBS, vortex opnieuw toe te voegen.
- Verwarm gedurende 10-15 minuten bij 60 ° C en meng door vortexing vóór elk gebruik.
- Bewaar deze oplossing bij 4 ° C.
- Het uitvoeren van seriële verdunningen en enkelvoudige dosis voorbereiding wat betreft de MLT-827-compound.
Opmerking: Omdat TDB worden voorbereid in DMSO moet, is een 1% DMSO eindconcentratie aanwezig tijdens de stimulatie van de cel.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
MALT1 Relais in myeloïde cellen, activering signalen stroomafwaarts van verschillende C-type lectine-achtige receptoren, zoals Dectin-1 en Dectin-2 MINCLE6. Deze trajecten afhankelijk (zoom) ITAM motief-bevattende receptoren (b.v., Dectin-1) of ITAM motief-bevattende co receptoren (b.v., FcRγ, voor Dectin-2 en MINCLE) die werven en activeren de Unnethes kinase (Figuur 1). Dit leidt tot activatie van een proteïne kinase C isovorm, namelijk PKCδ, die kinaseenzym CARD9, daardoor triggering complexvorming CARD9/BCL10/MALT1 en rekrutering van TRAF6 voor downstream NF-recombination activering12. Daarentegen, werft de TLR-4-weg TRAF6 in een MALT1-onafhankelijke maar MYD88/IRAK-afhankelijke manier voor NF-recombination activering (Figuur 1). Bewijs voor deze differentiële betrokkenheid van MALT1 werd verkregen met behulp van genetische modellen van MALT1 deficiëntie evenals farmacologische behandeling met de peptidic actieve-site remmer z-VRPR-fmk11,13,14.
We gebruikt de onlangs gemelde krachtige en selectieve MALT1 remmer MLT-82715 en vroegen als deze compound TNF-productie stroomafwaarts van C type lectine-achtige en Toll-like receptoren, respectievelijk zou regelen. Menselijke PBMCs en muis milt cellen werden gestimuleerd met verarmd zymosan (DZ, een bekende agonist van Dectin-1) of lipopolysaccharide (LPS, een bekende agonist voor TLR-4) en we gemeten TNF-release in de cultuur supernatant na 20u. In zowel de menselijke als de muis testen geblokkeerd MLT-827 selectief TNF-productie gedreven door het traject Dectin-1, maar niet door de TLR-4 traject (Figuur 2). Wij verkregen soortgelijke gegevens na incubatie met de z-VRPR-fmk compound (aanvullende Figuur 1).
Om te krijgen traject inzichten, we verdere experimenten uitgevoerd in menselijke monocyten en onvolwassen monocyten-afgeleide dendritische cellen (iMoDCs), vergelijking van het effect van MLT-827 tot die van de Unnethes-remmer Cpd1116 alsmede van de IKK remmer AFN70015 . In monocyten gestimuleerd met LPS, productie van TNF-α bijna volledig werd afgeschaft door AFN700 maar was niet gevoelig zijn voor Cpd11 (figuur 3A), die in overeenstemming is met de afhankelijkheid/onafhankelijkheid van het traject van de TLR-4 op NF-recombination/Unnethes activiteit, respectievelijk () Zie Figuur 1). Daarentegen, TNF-α productie gedreven door Dectin-1 in iMoDCs gevoeligheid voor Cpd11 naast gevoeligheid voor MLT-827 en AFN700 weergegeven (figuur 3B, aanvullende Figuur 2), die verder bewijs voor de betrokkenheid van een Unnethes/CBM signalering bieden: trapsgewijs in het traject van de Dectin-1 (Figuur 1). Opmerkelijk, productie van IL-1, IL-6 en IL-23 na stimulatie van de Dectin-1 was ook gevoelig voor de drie remmers, waardoor regulerende mechanismen vergelijkbaar met TNF - die aangeeft. Echter voorgesteld een beperkt effect van de drie verbindingen op de productie van IL-8 een verschillende regelgevende mechanisme voor deze cytokine (figuur 3B, aanvullende Figuur 2).
Naast de Dectin-1, andere CLLRs, zoals Dectin-2 en MINCLE, via stimulatie van een CARD9 signalosome7functie. We testten daarom MLT-827 in iMoDCs met de MINCLE-agonist Trehalose-6,6-dibehenate (TBD) uitgedaagd. Verhogen van TBD concentraties boven 50 µg/mL leidde tot de productie van TNF-, IL-6 en IL-1, die MALT1 paracaspase activiteit ingeroepen gezien vanaf de blokkerende werking van MLT-827 (figuur 4A). Consistente resultaten werden verkregen wanneer uitdagend iMoDCs met toenemende concentraties van DZ ter stimulering van Dectin-1 (figuur 4B).
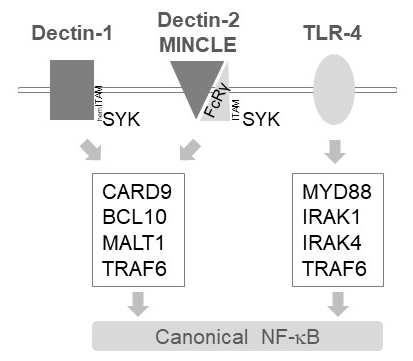
Figuur 1: NF-recombination signalering stroomafwaarts van Dectin-1, MINCLE en TLR-4. De cartoon beeldt de belangrijkste functies van canonieke NF-recombination activering trajecten stroomafwaarts van Dectin-1, Dectin-2, MINCLE of TLR-4 in myeloïde cellen. De hemITAM-bevattende Dectin-1 receptor17 kan direct zich inlaten Unnethes te stimuleren complexvorming CBM (CARD9/BCL10/MALT1), leiden tot activering van de NF-recombination TRAF6 afhankelijk. Andere C-type lectine-achtige receptoren zoals Dectin-2 of MINCLE moeten een ITAM-bevattende FcRγ keten om een CBM engage en het activeren van de NF-recombination werven. TLR-4 receptoren gebruiken een ander mechanisme voor NF-recombination activeren, afhankelijk van MYD88 en IRAK1/IRAK4 kinases stroomopwaarts van TRAF6.

Figuur 2: Dectin-1 signalen via MALT1 voor de productie van TNF-α in mens en muis cellen. (A) menselijke PBMCs gegevens zoals in Unterreiner et al., 2017 (figuur 2A)11. Menselijke PBMCs werden gestimuleerd met 1 ng/mL van LPS (TLR-4 agonist) of 100 µg/mL DZ (Dectin-1-agonist) voor 20u in aanwezigheid van de gesorteerde concentraties van MLT-827. TNF-uitgebracht in het supernatant werd gekwantificeerd door HTRF. (B) muis milt cellen werden behandeld met een concentratie bereik van MLT-827 voor 30 min en vervolgens gestimuleerd met 30 µg/mL DZ of 1 µg/mL LPS + 10 ng/mL IFN - voor 18 h. TNF-α in de celcultuur supernatant werd gemeten door ELISA. Een van de twee experimenten met vergelijkbare resultaten is aangetoond, als middel van ± SEM van drie metingen.

Figuur 3: IKK - en/of Unnethes-afhankelijkheid van cytokine productie stroomafwaarts van TLR-4 en Dectin-1. (A) menselijke monocyten waren vooraf behandeld voor 1 h met MLT-827 (1 µM), Cpd11 (1 µM), of AFN700 (3 µM) of voertuig (DMSO). Cellen werden gestimuleerd met 10 ng/mL LPS voor 20u en TNF-in het supernatant werd gekwantificeerd door HTRF. (B) TNF-α, IL-1β, IL-6, IL-23 en IL-8 productie door menselijke monocyten-afgeleide dendritische cellen (iMoDCs) gestimuleerd gedurende 24 uur met DZ (100 µg/mL) na 1 h pre-incubatie met MLT-827, Cpd11, AFN700 (allemaal op 1 µM) of DMSO. Cytokine niveaus in DMSO-behandelde monsters werden vastgesteld op 100%. Gegevens zijn middelen ± SD van drie metingen, en representatief zijn voor drie onafhankelijke experimenten. * P < 0.05; ** P < 0,01; P < 0.001, ongepaarde tweezijdige Student t-test.

Figuur 4: C-type lectine-achtige-afhankelijke cytokine productie door iMoDCs. TNF-α, IL-1β, en de productie van de IL-6 door iMoDCs gestimuleerd gedurende 24 uur met de MINCLE-agonist Trehalose-6,6-dibehenate (TDB, 100 µg/mL) (A) of met de Dectin-1-agonist DZ (100 µg/mL) (B) na 1 h pre-incubatie met MLT-827 (1 µM) of DMSO. Gegevens zijn middelen ± SD van drie metingen en representatief zijn voor drie onafhankelijke experimenten.
Aanvullende bestand 1. Klik hier om dit bestand te downloaden.
Aanvullende bestand 2. Klik hier om dit bestand te downloaden.
Aanvullende bestand 3. Klik hier om dit bestand te downloaden.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
In dit werk gebruikten we eenvoudige experimentele instellingen te bestuderen signaalroutes in mens en muis aangeboren cellen, en hun afhankelijkheid van MALT1 Proteolytische functie ondervragen. Uitbreiding op de eerdere werk11, onze studie toonde aan dat MALT1 paracaspase activiteit controles C-type lectine-achtige receptor geïnduceerde cytokine productie, met inbegrip van TNF-α. Daarentegen was de TLR-4-geïnduceerde TNF-α onafhankelijk van MALT1 in beide soorten. Deze gegevens bevestigd collectief, de belangrijkste en selectieve bijdrage van de MALT1/CBM signalosome stroomafwaarts van C-type lectine-achtige receptoren, die werd onthuld door eerdere studies6,12,18.
Of de duidelijke onafhankelijkheid van TLR-4 signalering op MALT1 in myeloïde cellen is van toepassing op andere soorten cel blijft om ontdekt te worden. Bijvoorbeeld, in B-lymfocyten, was TLR signalering eerder getoond om bij te dragen tot de activering van de B-cel stroomafwaarts van de B-cel antigeen receptor19. In feite, hebben wij bewijs dat TLR-4 gestimuleerd menselijke en muis B cellen gevoeligheid voor MLT-827 weergeven onuitgegeven. Daarom zullen verder mechanistische inzichten stroomafwaarts van de B-cel receptor waardevol zijn. In deze context, een recente studie in B-cel lymfoom bewijs voor de clustering van de signaalroutes stroomafwaarts van de B-cel receptor en de TLR9 receptor20verstrekt. TRAF6, die als bemiddelaar voor NF-recombination activering in zowel de B-cel receptor en de TLR-trajecten optreedt, misschien wel een punt van Overspraak, die de gevoeligheid van beide trajecten naar het MALT1 protease-inhibitie kon verklaren. Omgekeerd, TRAF6 is ook een gemeenschappelijk downstream speler van CLLRs en TLRs voor de inductie van NF-recombination maar deze twee trajecten lijken niet te Overspraak op een MALT1 paracaspase-afhankelijke manier in myeloïde cellen.
Dit werk gericht op cytokine productie, die een gemakkelijke uitlezing voorziet signaalroutes en kan gemakkelijk worden geïmplementeerd voor samengestelde profileren. Het benadrukt de waarde van selectieve en krachtige remmers van MALT1 voor ontrafelen MALT1 biologie. Verkrijgen verder mechanistische inzichten vereist extra werk en ontwikkeling van meer proximale tests, bijvoorbeeld te karakteriseren de substraten voor MALT1 die betrokken zijn bij aangeboren signalering van verordening.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs hebben niets te onthullen.
Acknowledgments
Wij danken voor hun vergunning (registratienummer 4334770630127) te reproduceren hier figuur 2A van Unterreiner et al. Elsevier (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



