Summary
MALT1 regula la inmunidad innata pero cómo esto ocurre sigue siendo mal definida. Utilizamos el inhibidor selectivo de la paracaspase del MALT1 MLT-827 a desentrañar la contribución de MALT1 al innato señalización corriente abajo de los receptores de lectina-como Toll-like o tipo C, demostrando que MALT1 regula la producción de citocinas mieloide y aguas abajo de los receptores de lectina-como de tipo C, selectivamente.
Abstract
Además de su función en las células linfoides, que ha sido abordado por numerosos estudios, el paracaspase MALT1 también juega un papel importante en las células naturales aguas abajo de los receptores de reconocimiento de patrón. Mejor estudiados son los Dectin-1 y Dectin-2 miembros de la familia del lectin-como el receptor de tipo C que inducen un dependiente SYK y CARD9 señalización cascada lleva a la activación de NF-κB, en una forma dependiente de MALT1. Por el contrario, receptores tipo Toll (TLR), como TLR-4, propagar la activación de NF-κB pero la señal a través de una cascada de MYD88/IRAK-dependiente. Sin embargo, ha quedado claro si MALT1 podría contribuir a la señalización de TLR-4. Evidencia reciente con MLT-827, un inhibidor potente y selectivo de la actividad de paracaspase de MALT1, indica que TNF-producción aguas abajo de los TLR-4 en células mieloides humanas es independiente de MALT1, en contraposición a la producción de TNF abajo de Dectin-1, que es MALT1 dependiente. Aquí, nos dirigimos a la implicación selectiva de MALT1 en reconocimiento de patrones de detección adicional, usando una variedad de preparaciones celulares de ratón y humanos y estimulación de las vías Dectin-1, algunos o TLR-4. También proporcionamos perspectivas adicionales mediante la exploración de citoquinas más allá de TNF-y comparando MLT-827 a un inhibidor SYK (Cpd11) y un inhibidor de la IKK (AFN700). Colectivamente, los datos que más evidencian de la dependencia MALT1 de lectin-como el receptor tipo C, señalando por el contrario a la señalización de TLR.
Introduction
La actividad paracaspase de MALT1 (proteína 1 de desplazamiento linfoma mucosa-asociado del tejido linfoide) fue revelada en el 20081,2. Desde entonces, varios estudios han reportado su contribución crítica a las respuestas del receptor de antígeno en los linfocitos. Modelos genéticos en el ratón, así como datos de Farmacología apoyan un papel clave en las células T, autoinmunidad dependiente de células T y células B linfoma configuración3,4. En linfocitos, activación de MALT1 paracaspase ocurre a Asamblea de CARD11-BCL10-MALT1 complejo5, que se activa por antígeno receptor de señalización proximal descendente de los receptores de células T o B. También hay amplia evidencia de que un complejo similar de CARD9-BCL10-MALT1 es importante para la propagación de señales corriente abajo de los receptores de lectina-como de tipo C (CLLR), por ejemplo,, Dectin-1, Dectin-2 y algunos en mieloide de las células6,7. Dectin-1 ha sido particularmente bien estudiada porque esta vía es crítica para la defensa del huésped contra infecciones micóticas8,9. Implicación de MALT1 en vías de Toll-like receptor (TLR), sin embargo, sigue siendo controvertido10. La evidencia reciente en células mieloides humanas descartó un papel directo para MALT1 paracaspase actividad en la regulación de la producción de TNF abajo de TLR-411.
En el presente trabajo, utilizamos varios ajustes experimentales y condiciones estimulantes en humanos y células mieloides ratón para sonda innatas vías de señalización, depender de los inhibidores de la herramienta farmacológica específica y la medición de producción de citoquinas.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Experimentos se realizaron según las pautas y normas de la Comisión de ética de investigación humana Novartis.
1. preparación de células mononucleares de sangre periférica (PBMCs) de escudos humanos de Buffy
Nota: Hemos recibido buffy coats de voluntarios sanos un día después de la recolección en bolsas de 50 mL. Estaban siempre bajo consentimiento informado y recogidos a través del Interregionale Blutspende Schweizeriches Rotes Kreuz. Manejamos utilizando el procedimiento a continuación, a temperatura ambiente a menos que se especifique lo contrario.
- Preparar un par de tijeras y un vaso de precipitados de 1 L con una bolsa de plástico (bajo flujo lamina) estéril y limpio.
- Transferir la capa buffy en el vaso y abra cuidadosamente con las tijeras.
- Utilizando una pipeta de 25 mL, añadir 100 mL de tampón fosfato salina tampón/dihidratada del ácido (PBS/EDTA: pH de 1 x PBS 7.4 que contiene no de CaCl2 y no de MgCl2, suplementado con 2 mM pH 8.0 de EDTA).
Nota: Con la misma pipeta y después lentamente pipetear la solución hacia arriba y hacia abajo, dispensar 25 mL de la capa anteada diluida en 6 tubos de centrífuga cónico de 50 mL previamente llenado con 15 mL de gradiente de densidad base de polisacárido. - Centrifugar 20 min a 800 x g (establecido en 4 de 9) la aceleración moderada y sin freno para permitir la separación de las células que se basa en sus densidades.
Nota: Después de la centrifugación, tres capas serán visibles; un pellet que contiene eritrocitos y granulocitos, una capa superior de plasma, y entre un círculo blanco que contiene las células mononucleares de sangre periférica (PBMCs). - Cosecha el anillo PBMC con una pipeta de 10 mL y transferencia a nuevos tubos de 50 mL.
Nota: Tubos de 50 mL dos o tres son normalmente requeridos por la capa anteada. En esta etapa, algunos plasma probable contamina las PBMCs recogidos, que no deben influir en los pasos de enriquecimiento posterior. - Superior a 50 mL de cada tubo con PBS/EDTA y proceder a tres lavados sucesivos con la disminución de velocidad (15 min a 520 x g, 10 min a x 330 g, 8 minutos a 150 x g) y tiempo de centrifugación.
Nota: En cada paso, el sobrenadante se vierte de un recipiente de desechos líquidos y el precipitado celular se resuspendió en 50 mL de PBS/EDTA (pellets pueden combinarse después del primer lavado). - Después del último lavado, Resuspender el precipitado en 25 mL de un tampón de lisis helada (véase Tabla de materiales) para lisar los glóbulos rojos por presión osmótica.
- Incubar hasta que la solución llega a estar clara (≤5 min a temperatura ambiente).
- Detener la reacción añadiendo 25 mL de buffer de separación (PBS 1 x pH 7.4, que contiene no CaCl2 y no MgCl2, suplementado con 2% inactivado con calor suero bovino fetal (FBS) y 1 mM EDTA pH 8.0).
- Lavar una vez más a 150 x g durante 8 minutos.
Nota: En esta etapa PBMCs pueden ser utilizados como una población a granel (consulte el paso 3: tratamientos PBMCs y monocitos y condiciones estimulantes) o procesado para el enriquecimiento de monocitos (consulte el paso 2: preparación de monocitos de PBMCs), o congelado abajo para su uso posterior (ver paso 5: Monocitos y PBMCs procedimientos de congelación/descongelación).
2. preparación de monocitos de PBMCs
- Suspender las PBMCs obtenidos paso 1.10 en tampón de separación y contarlos para llegar a 5 x 107células/mL.
- Transferir la suspensión de células en un tubo de centrífuga cónico de 14 mL con tapa.
- Añadir 50 μl de anticuerpo de enriquecimiento monocito cóctel por cada mL de suspensión celular, vortex e incubar 10 min a 4 ° C.
- Añadir 50 μl de granos de enriquecimiento del monocito de células por mL.
Nota: Los granos deben ser bien agitarse para asegurar la homogeneidad de la suspensión. - Después de agregar las cuentas del vórtice poco la suspensión de células e incubar 5 min a 4 ° C.
- Enjuague la parte superior del tubo con tampón de separación hasta que el tubo se llena hasta 10 mL.
- Mezcle lentamente la solución mediante pipeteo arriba y abajo.
- Coloque el tubo sin la tapa en un imán de separación.
- Incubar durante 2,5 min a temperatura ambiente.
- Vierta lentamente en un tubo de centrífuga cónico de 15 mL.
- En esta fase, utilizar monocitos directamente (consulte el paso 3: tratamientos de PBMCs y monocitos y condiciones estimulantes) o diferenciar en mmature Monocyte-derivado Dendritic Cells (iMoDCs) (ver paso 4), o congelarlas abajo para su uso posterior (ver paso 5).
3. PBMCs y monocitos tratamientos y condiciones estimulantes
- Contar las células y diluir en medio de cultivo (medio de Roswell Park Memorial Institute (RPMI) 10% FBS 1 mM de piruvato de sodio + 100 U/mL penicilina estreptomicina (Pen/Strep) + μm 5 β-mercaptoetanol), hasta 1,25 x 104 células/pocillo.
- Distribuir 30 μl de suspensión de células por pocillo de una placa de 384 pozos.
- Añadir 15 μl de 4 x soluciones concentradas de compuestos y los incuban durante 1 h a 37 ° C, 5% CO2.
- Añadir lipopolysaccharide (LPS) a una concentración final de 10 ng/mL, agotado zymosan (DZ) a una concentración final de 100 μg/mL o mantener en llano medio.
- Incubar durante una noche a 37 ° C, 5% CO2.
- Tomar 10 μl del sobrenadante para medir los niveles de TNF-a secretada (consulte el paso 7: medición de citoquinas y viabilidad).
4. monocitos diferenciación en condiciones estimulantes y iMoDCs
- Cuenta de monocitos (enriquecidos en el paso 2) y Centrifugue la suspensión de células a 520 x g durante 5 minutos.
- Pipeta del sobrenadante y agregar medio de cultivo (RPMI + 10% FBS para obtener una suspensión final de 0,4 x 106 células/mL.
- Añadir 80 ng/mL recombinante humano IL-4 + 100 ng/mL GM-CSF.
- Pipetear 5 mL de suspensión de células por pocillo en una placa de 6 pozos.
- Incubar 7 días a 37 ° C, 5% CO2.
- En el día 7, cosechar las células pipeteando suavemente para evitar su activación.
- Centrifugar a 520 x g durante 5 minutos.
- Aspiración al vacío y resuspender en 50 mL de medio de cultivo sin factores de crecimiento.
- Centrifugue a 520 x g durante 5 min y resuspender en 1 x 106 células/mL en medio de cultivo.
- Añada 100 μl de suspensión celular (105 células) por pocillo de una placa de fondo plano de 96 pozos.
- Pre-incubate por 1 h a 37 ° C después de añadir 50 μl de 4 x concentrado compuestas soluciones, preparadas como se describe en el paso 8: preparación de los compuestos.
- Añadir 50 μl de estímulos (4 x concentrado), preparado como se describe en el paso 9.
- Incubar 24 h a 37 ° C.
- Mezclar cada bien y la transferencia de células y sobrenadante (SN) en una placa de 96 pocillos fondo V.
- Desactivación a 475 x g durante 5 minutos.
- Transferir el sobrenadante a un nuevo plato de fondo plano de 96 pozos, sellar y congelar a-20 ° C hasta su uso posterior.
5. monocitos y PBMCs procedimientos de congelación/descongelación
-
Congelación
- Desactivación de PBMC o monocito preparaciones celulares a 520 x g durante 5 minutos.
- Aspirar el sobrenadante y resuspender las células en congelación medio 1 x 107 células/ml.
- Dispensar 1 mL de la suspensión celular en criotubos, los tubos de transferencia a un dispositivo de enfriamiento específico (ver la tabla de materiales) y a-80 ° C.
-
El deshelar
- El criotubo de descongelar y transferir rápidamente su contenido en un tubo de centrífuga cónico de 15 mL que contiene 9 mL de medio de cultivo.
- Centrifugar a 520 x g durante 5 minutos.
- Aspirar aspirar sobrenadante y resuspender el precipitado de células en 5 mL de medio de cultivo. Las células están listas para más procesamiento experimental.
6. células de bazo de ratón preparación y tratamiento
Nota: Llevamos a cabo los sacrificios de animales según las directrices y normas de la organización de Bienestar Animal de Novartis. Los estudios fueron aprobados por el Comité de ética de la autoridad gubernamental regional (los Kantonales Veterinäramt der Stadt Basel). Sacrificaban animales por exposición excesiva de isoflurano, con todos los esfuerzos para minimizar el sufrimiento.
- El bazo de la cosecha y disociar tejido utilizando un tubo equipado con un dispositivo de amoladora mecánica del tejido y llena con 5 mL de Medio RPMI frío.
- Utilizar el programa de la bazo de la máquina de disociación para moler los órganos.
- Filtro de las células a través de un tamiz de 100 mm nylon celular.
- Transferir la suspensión a tubos de 50 mL y centrifugar a 4 ° C por 10 min a x 320 g.
- Vacío Aspire el sobrenadante, Resuspender el precipitado de células en 3 mL de tampón de lisis helada e incubar durante ≤2 minutos en hielo.
- Deje de lisis añadiendo 7 mL de Medio RPMI.
- Filtrar nuevamente a través de un tamiz de celular 100 μm nylon.
- Desactivación de la suspensión celular a 330 x g por 10 min a 4 ° C.
- Aspirar aspirar sobrenadante y resuspender las células en 11 x 106 células/mL en medio completo (RPMI suplementado con 10% FBS, 100 U/mL Pen/paso y 5 μm β-mercaptoetanol).
- Placa de 1 x 106 células/pozo (90 μl) en una placa de 96 pocillos (fondo plano).
- Añadir 5 μl de 20 x concentrado compuesto solución diluida previamente en Medio RPMI como se describe en el paso 8.3: dilución seriada de las células de bazo de ratón.
- Incubar durante 30 min a 37 ° C, 5% CO2.
- Añadir 5 μl de 20 x había concentrado DZ (concentración final de 30 μg/mL) o 20 x concentrado LPS + IFN-g (TLR-4) (concentración final 1 μm LPS y 10 ng/mL IFN-g).
- Incubar durante una noche a 37 ° C, 5% CO2.
- Centrifugar a 330 x g por 10 min.
- Transferencia de sobrenadantes en nuevas placas, sellar y congelar a-20 ° C hasta su uso posterior.
7. citoquinas y medidas de viabilidad
-
Humano TNF-a medida por HTRF (fluorescencia de resueltos de tiempo homogéneo)
Nota: El protocolo seguido las recomendaciones del proveedor, que se resume brevemente a continuación.- Mezclar 1 volumen de reactivo reconstituido (anti TNF a cryptate y anti-TNF-a-XL665) con 19 volúmenes de tampón de reconstitución (50 m m tampón fosfato pH 7.0, 0,8 M fluoruro de potasio (KF), 0.2% albúmina de suero bovino (BSA)).
- Mezclar las dos soluciones de anticuerpo listo para su uso 1:1 antes de la dispensación de los reactivos.
- Dispensar 10 μl de sobrenadante del paso 3.6 en blanco placas de 384 pocillos.
- Dispensar 10 μl de la mezcla de anticuerpos.
- Cubra la placa con un sellador e incubar a 4 ° C durante la noche.
- Lea la placa con un lector de microplacas (50 – 200 flash).
- Humana medida de la IL-23 por HTRF (fluorescencia de resueltos de tiempo homogéneo)
Nota: El protocolo seguido las recomendaciones del proveedor, que se resume brevemente a continuación.- Mezclar un volumen de reactivo reconstituido (anti IL-23-cryptate-anticuerpo y anti-IL-23 D2-anticuerpo) con 19 volúmenes de tampón de detección #3.
- Mezclar las dos soluciones de anticuerpo listo para su uso 1:1 antes de la dispensación de los reactivos.
- Dispensar 10 μl de sobrenadante del paso 3.6 en blanco placas de 384 pocillos.
- Dispensar 10 μl de la mezcla de anticuerpos.
- Cubra la placa con un sellador e incubar a 4 ° C durante la noche.
- Lea la placa con un lector de microplacas (flash de 50-200 nm).
-
Humano IL-6, IL-8, IL-1β y TNF-α mediciones por electrochemiluminescence
Nota: Todas las muestras se diluyeron en 1/150 en diluyente 2 (primera dilución: 10 μL en 150 μL y 20 μl en 180 μL). El protocolo había seguido las recomendaciones del proveedor:- Diluir las muestras y el estándar en diluyente 2.
- Proceder a la dilución de la norma en diluyente 2 usando una dilución de 1/4 doblez serial.
- Lavar las placas tres veces con tampón de lavado.
- Dispensar 50 μl de las muestras o estándar por pozo.
- Incubar por 2 h a temperatura ambiente en agitación.
- Lavar el plato cuatro veces con PBS + 0.05% polisorbato 20.
- Añada 25 μl del anticuerpo de detección (60 μL de cada anticuerpo para final de 3 mL) en 3 diluyente.
- Incubar por 2 h a temperatura ambiente en agitación.
- Lavar el plato cuatro veces con PBS + 0.05% polisorbato 20.
- Evitando las burbujas, añadir 150 μL por pocillo de leer buffer (búfer de Tris que contiene tripropylamine, diluido 2 x en ddH20) como un reactivo Co de generación de luz en electrochemiluminescence inmunoensayos.
- Leer la placa (sin demora) en un lector de placas multiplex.
-
Ratón TNF-a medida por ELISA siguiendo el protocolo del proveedor
- Diluir 1:1 en diluyente de ensayo (listo para usar que contiene proteína tampón) del sobrenadante.
- Preparación de reactivos, muestras y diluciones estándar como se describe en el kit. Añadir 50 μL de diluyente de ensayo a cada pocillo.
- Añadir 50 μL de estándar, control o muestra por pozo.
- Mezclar golpeando suavemente el marco de la placa durante 1 minuto.
- Cubrir con la cinta adhesiva provista e incubar por 2 h a temperatura ambiente.
- Aspirar cada uno bien y lavar con 400 μL/pozo (Repita este paso cinco veces en total).
- Después del último lavado, eliminar cualquier tampón de lavado restante por aspiración.
- Invertir la placa y luego contra toallas de papel limpias.
- Añada 100 μL de conjugado de ratón TNF-α a cada pocillo. Cubrir con una nueva tira adhesiva.
- Incubar por 2 h a temperatura ambiente.
- Repetir la aspiración/lavado como en el paso 7.4.4.
- Añada 100 μL de solución sustrato a cada pocillo e incubar durante 30 min a temperatura ambiente protegido de la luz.
- Añada 100 μL de solución de ácido clorhídrico diluido (solución de parada) a cada pocillo. Golpear suavemente la placa para asegurar una mezcla completa.
- Medir la densidad óptica a 450 nm (con la longitud de onda de corrección a 560 nm) usando un lector de microplacas (a realizar dentro de 30 minutos).
- Diluir 1:1 en diluyente de ensayo (listo para usar que contiene proteína tampón) del sobrenadante.
-
Viabilidad celular
- Después de la eliminación de sobrenadantes de preparaciones de PBMC o monocito, evaluar viabilidad celular mediante un listo utilizar solución de resazurina (indicador de oxidación-reducción) añadido directamente a la suspensión de células a concentración final de 10%.
- Incubar durante 1 a 2 h a 37 ° C, 5% CO2.
- Leer la fluorescencia a 590 nm (excitación 540 nm) usando un lector de microplacas.
8. preparación de compuestos
-
Dilución seriada de iMoDCs
- Diluir la solución madre de MLT-827 (10 mM en dimetil sulfóxido (DMSO) en el medio para llegar a 8 μm de una sola vez (4 x concentrado).
- Realizar una dilución seriada de seis pasos 1:5, utilizando medio + 0.08% DMSO. Utilizar el mismo medio + solución de DMSO de 0.08% para el estado del vehículo (no compuesto).
-
Dosis única de prueba para iMoDCs
- Diluir las soluciones stock MLT-827, AFN700 y Cpd11 en medio para llegar a 4 μm de una sola vez (4 x concentrado).
-
Dilución seriada de las células de bazo de ratón
- Diluir una solución de MLT-827 10 μm (obtenida de una solución stock de 10 mM después de una dilución de ir uno en medio) a 0,01 μm, con una concentración final de DMSO de 0.1%.
- Para los pasos de dilución, tomar 2 μl de cada dilución, añadir 38 μl de RPMI y Pipetee 5 μL en el pozo.
Nota: Todos los tratamientos se realizan por triplicado.
9. estímulos preparación
-
Zymosan empobrecido (DZ)
- Añadir 2 mL de agua estéril libre de endotoxina a 10 mg de DZ.
- Vortex para homogeneizar la solución, vortex también antes de cada uso.
- Alícuotas alícuotas de la solución y almacenar a-20 ° C.
-
Trehalosa-6,6-dibehenate (TDB)
- Añadir 100 μl de DMSO a TDB, calor a 60 ° C en un baño de agua durante 15 – 30 s. de 1 mg.
- Vórtice e inmediatamente agregar 900 μl de PBS estéril, vórtice otra vez.
- Calentar durante 10-15 min a 60 ° C y homogeneizar por antes de Vortex cada uso.
- Mantener la solución a 4 ° C.
- Realizar diluciones seriadas y preparación de dosis única como por el compuesto de MLT-827.
Nota: Porque TDB necesita estar preparado en DMSO, una concentración final de DMSO 1% está presente durante la estimulación celular.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
En células mieloides, MALT1 retransmite las señales de activación río abajo de varios receptores de lectina-como tipo C, tales como Dectin-1, Dectin-2 y algunos6. Estas vías dependen de receptores que contienen los adorno (hem) ITAM (e.g., Dectin-1) o receptores de cooperación que contienen motivos ITAM (e.g., FcRγ Dectin-2 y algunos) que reclutan y activan la quinasa SYK (figura 1). Esto conduce a la activación de una isoforma de la proteína quinasa C, es decir PKCδ, que fosforila CARD9, tal modo provocando formación de complejos de BCL10/CARD9/MALT1 y reclutamiento de TRAF6 aguas abajo de la activación de NF-κB12. Por el contrario, la vía TLR-4 reclutas TRAF6 en una MALT1 independiente pero forma de MYD88/IRAK-dependiente para la activación de NF-κB (figura 1). Se obtuvo evidencia de implicación diferencial de MALT1 utilizando modelos genéticos de deficiencia MALT1, así como tratamiento farmacológico con los inhibidores peptídicos de sitio activo z-VRPR-fmk11,13,14.
Se utilizó el recientemente divulgado inhibidor potente y selectivo MALT1 MLT-82715 y le preguntó si este compuesto regularía producción de TNF abajo de C tipo lectina-como y peaje-como los receptores, respectivamente. PBMCs humanos y células de bazo de ratón fueron estimuladas con zymosan empobrecido (DZ, un agonista conocido de Dectin-1) o lipopolisacárido (LPS, un agonista conocido de TLR-4) y mide liberación de TNF en el sobrenadante de cultivo después de 20 h. En el ser humano y en los ensayos del ratón, MLT-827 selectivamente bloquea TNF-producción impulsada por la vía de Dectin-1, pero no por la vía TLR-4 (figura 2). Se obtuvieron datos similares a la incubación con el compuesto z-VRPR-fmk (suplementario figura 1).
Para hacerse una idea de camino, llevamos a cabo otros experimentos en monocitos humanos y en células dendríticas derivadas de monocitos inmaduras (iMoDCs), que compararon el efecto de la MLT-827 del SYK inhibidor Cpd1116 y a los del inhibidor de la IKK AFN70015 . En monocitos estimulados con LPS, producción de TNF-α fue casi totalmente derogada por AFN700 pero no fue sensible a Cpd11 (Figura 3A), que es consistente con la dependencia/independencia de la vía TLR-4 en la actividad de NF-κB/SYK, respectivamente () Ver figura 1). Por el contrario, producción de TNF-α impulsado por Dectin-1 en iMoDCs muestra sensibilidad al Cpd11 además de sensibilidad a MLT-827 y AFN700 (figura 3B, suplementario figura 2), proporcionando más evidencia de la implicación de una señalización de SYK/CBM cascada en el camino de Dectin-1 (figura 1). Cabe destacar, la producción de IL-1, IL-6 e IL-23 sobre el estímulo Dectin-1 también fue sensible a los inhibidores de la tres, lo que indica a mecanismos regulatorios similares a TNF-. Sin embargo, un efecto limitado de los tres compuestos en la producción de IL-8 sugiere un mecanismo de regulación distintivo para esta citoquina (figura 3B, suplementario figura 2).
Además Dectin-1, otros CLLRs, tales como Dectin-2 y algunos, función mediante la estimulación de un CARD9 signalosome7. Por lo tanto probamos MLT-827 en iMoDCs con el agonista de algunos trehalosa-6,6-dibehenate (TBD). Aumentar las concentraciones de TBD por encima de 50 μg/mL condujo a la producción de TNF-, IL-6 e IL-1, que se basaba en MALT1 paracaspase actividad como se ve en el efecto de bloqueo de MLT-827 (Figura 4A). Resultados se obtuvieron cuando un reto iMoDCs con el aumento de las concentraciones de DZ para estimular Dectin-1 (Figura 4B).
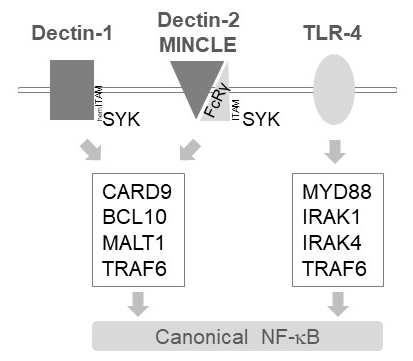
Figura 1: señalización de NF-κB de Dectin-1, algunos y TLR-4. La caricatura muestra las características clave canónicas N-F-κB activación de las vías de aguas abajo de Dectin-1, Dectin-2, algunos o TLR-4 en células mieloides. Los que contienen hemITAM Dectin-1 receptor17 directamente puede comprometer SYK para estimular la formación de complejos de CBM (CARD9/BCL10/MALT1), conduciendo a la activación de NF-kB dependiente de TRAF6. Otros receptores de lectina-como de tipo C como Dectin-2 o algunos necesitan reclutar una cadena FcRγ que contiene el ITAM para enganchar un CBM y activar NF-κB. Los receptores TLR-4 utilizan otro mecanismo para la activación de NF-κB, depender de las quinasas MYD88 y IRAK1/IRAK4 aguas arriba de TRAF6.

Figura 2: Dectin-1 señales vía MALT1 para la producción de TNF-α en humano y ratón células. (A) datos de PBMCs humano como Unterreiner et al., 2017 (figura 2A)11. PBMCs humanos fueron estimuladas con 1 ng/mL de LPS (TLR-4 agonista) o 100 μg/mL DZ (agonista Dectin-1) 20 h en presencia de concentraciones graduales de MLT-827. TNF-aparecido en el sobrenadante se cuantificó por HTRF. (B) ratón células de bazo fueron tratadas con una concentración de gama de MLT-827 por 30 min y posteriormente estimuladas con 30 μg/mL DZ o 1 μg/mL LPS + 10 ng/mL IFN - 18 h. TNF-α en el sobrenadante de cultivo celular se midió mediante ELISA. Se muestra uno de dos experimentos con resultados similares, como los medios ± SEM de tres mediciones.

Figura 3: IKK - o SYK-dependencia de la producción del cytokine aguas abajo de TLR-4 y Dectin-1. Monocitos humanos (A) fueron tratadas previamente por 1 h con MLT-827 (1 μm), Cpd11 (1 μm), o AFN700 (3 μm) o vehículo (DMSO). Las células fueron estimuladas con 10 LPS de ng/mL para 20 h y TNF-en el sobrenadante se cuantificó por HTRF. (B) TNF-α, IL-1β, IL-6, IL-23 y IL-8 por derivados de monocitos células dendríticas humanas (iMoDCs) estimuladas por 24 h con DZ (100 μg/mL) después de la incubación previa de 1 h con MLT-827, Cpd11, AFN700 (todo en 1 μm) o DMSO. Se establecieron niveles de citocinas en las muestras tratadas con DMSO al 100%. Datos son medio ± SD de tres mediciones y son representativos de tres experimentos independientes. * P < 0.05; ** P < 0.01; P < 0.001, desapareado prueba t de Student de dos colas.

Figura 4: C dependiente de lectinas como cytokine producción por iMoDCs. TNF-α, IL-1β y la IL-6 producción por iMoDCs estimularon por 24 h con el agonista de algunos trehalosa-6,6-dibehenate (TDB, 100 μg/mL) (A) o con el agonista Dectin-1 DZ (100 μg/mL) (B) después de la incubación previa de 1 h con MLT-827 (1 μm) o DMSO. Datos son medio ± SD de tres mediciones y son representativos de tres experimentos independientes.
Archivo suplementario 1. Haga clic aquí para descargar este archivo.
Archivo suplementario 2. Haga clic aquí para descargar este archivo.
Archivo suplementario 3. Haga clic aquí para descargar este archivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
En este trabajo, utilizamos simple configuración experimental para estudiar vías de señalización en humano y ratón células innatas e interrogar su dependencia en la función proteolítica MALT1. Ampliando el anterior trabajo11, nuestro estudio mostró que la actividad de paracaspase MALT1 controla c-tipo lectin-como el receptor inducido por producción de citoquinas, incluyendo el TNF-α. Por el contrario, TLR-4-inducida por el TNF-α fue independiente de MALT1 en ambas especies. Colectivamente, estos datos corroboran la contribución clave y selectivo de la CBM/MALT1 signalosome aguas abajo de los receptores de lectina-como de tipo C, que fue revelado por estudios anteriores6,12,18.
Si la clara independencia de TLR-4 señalización en MALT1 en células mieloides se aplica a otros tipos celulares queda por explorarse. Por ejemplo, en los linfocitos B, señalización de TLR fue demostrado previamente para contribuir a la activación de células B aguas abajo de las células B antígeno receptor19. De hecho, hemos inéditos evidencia que TLR-4 estimula humano y las células de ratón B mostrar sensibilidad a MLT-827. Por lo tanto, más mecanicistas penetraciones aguas abajo del receptor de la célula de B será valiosos. En este contexto, un estudio reciente en linfoma de células B proporcionó la evidencia para la agrupación de las vías de señalización corriente abajo del receptor de la célula B y el receptor TLR9 del20. TRAF6, que actúa como mediador para la activación de NF-κB en el receptor de células B y las vías TLR, podría ser un punto de interferencia, lo que podría explicar la sensibilidad de ambas vías a la inhibición de proteasa MALT1. Por el contrario, TRAF6 es también un jugador abajo común de CLLRs y TLR para la inducción de NF-κB pero estas dos vías no parecen interferencia en forma de paracaspase-dependiente MALT1 en células mieloides.
Este trabajo centrado en la producción de citoquinas, que proporciona una lectura fácil para vías de señalización y puede implementarse fácilmente para perfiles compuestos. Destacó el valor de los inhibidores selectivos y potentes de MALT1 para desentrañar la biología MALT1. Obtener más ideas mecanicistas requerirá trabajo adicional y el desarrollo de ensayos más proximales, por ejemplo, para caracterizar a los substratos de MALT1 en innata Reglamento de señalización.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Damos las gracias a Elsevier para su autorización (número de licencia 4334770630127) reproducir aquí figura 2A de Unterreiner et al. (2017).
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



