Summary
MALT1 免疫を調節するが、不明確のままどのようにこれが発生します。MALT1 の生得的なシグナリング Toll 様や C 型レクチン様受容体、MALT1 が骨髄性サイトカインの生産を調節することを示すの下流と下流への貢献を解明する選択的 MALT1 paracaspase 阻害剤 MLT 827 を使いました。C 型レクチン様受容体の選択的に。
Abstract
多くの研究によって対処されている、リンパ球様細胞でその機能のほか paracaspase MALT1 はまたパターン認識受容体の下流生得の細胞で重要な役割を果たしています。SYK と CARD9-依存性シグナル伝達カスケード MALT1 依存的に、NF-κ B の活性化につながるを誘発する C 型レクチン様受容体ファミリの自己免疫 1 および自己免疫-2 メンバーである最もよく研究します。一方で、Toll 様受容体 (TLR) TLR 4 など NF-κ B 活性化が MYD88/アイラック依存型カスケードを介して信号を伝達します。それにもかかわらず、MALT1 TLR 4 シグナル伝達に貢献するかもしれないかどうか明白でなく残ったが。MLT-827、MALT1 paracaspase 活動の強力かつ選択的な阻害剤を最近の証拠ことを示しますひと骨髄細胞における TLR 4 の下流 TNF 産 MALT1 TNF 産下流ではなく自己免疫-1 の独立 MALT1 であります。依存。ここでは、我々 はさらに、さまざまな人間とマウス細胞製剤と自己免疫 1、MINCLE または TLR 4 経路の刺激を使用してパターン認識における MALT1 の選択的関与に対処。サイトカイン TNF-を超えてあり、MLT 827 SYK 阻害剤 (Cpd11)、IKK 阻害剤 (AFN700) を比較することによって、我々 はまた追加の洞察力を提供しました。総称して、提供されたデータがさらに MALT1 C 型レクチン様受容体依存性の証拠-対照的に TLR シグナルをシグナリングします。
Introduction
MALT1 の paracaspase 活動 (粘膜関連リンパ組織リンパ腫転座蛋白質 1) は、2008 年1,2で明らかにされました。その後、研究の数は、リンパ球の抗原受容体応答への重要な貢献を報告しています。マウス T 細胞、T 細胞の依存の自己免疫および B 細胞リンパ腫の設定3,4薬理データが重要な役割をサポートと同様に遺伝的モデル。CARD11-BCL10-MALT1 複雑な5、抗原受容体近位伝達によってトリガーされるアセンブリに発生します MALT1 paracaspase 活性化リンパ球の T ・ B 細胞受容体の下流。また同様 CARD9 BCL10 MALT1 コンプレックスが例えば C 型レクチン様受容体 (CLLR) の下流にシグナルを伝達するために重要という十分な証拠がある,自己免疫 1、ヒトデクチン 2、骨髄性で MINCLE 細胞6,7。自己免疫 1 はこの経路は真菌感染症8,9防御の重要なので、特によく研究されています。ただし、Toll 様受容体 (TLR) 経路で MALT1 の含意は、物議を醸す10を推移しています。ひと骨髄細胞における最近の証拠は TLR 411の下流 TNF 産規制で MALT1 paracaspase 活性に直接的な役割を否定しました。
現在の仕事で特定の薬理学的ツール阻害剤、サイトカイン産生の測定に依存する生得的なシグナル伝達経路をプローブする様々 な実験的設定と人間の刺激条件マウス骨髄細胞を使いました。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
ガイドラインとノバルティス人間研究倫理委員会の基準に従って実験を行った。
1. 末梢血単核球 (PBMCs) 人間のバフィー コートからの準備
注:1 日 50 mL 袋内のコレクションの後、健康なボランティアからバフィー コートをいただきました。インフォームド コンセントの下で提供され、 Interregionale Blutspende Schweizeriches Rotes クロイツを通じて収集されました。指定がなければ室温で、次の手順を使用してそれらを処理しました。
- はさみと (薄層流れ) の下でビニール袋で 1 L ビーカーの無菌で清潔なペアを準備します。
- ビーカーにバフィー コートを転送し、慎重にハサミで開きます。
- リン酸緩衝生理食塩水バッファー/エチレンジアミン酸の 100 mL を追加し 25 mL のピペットを使用して (PBS/EDTA: EDTA pH 8.0 2 mM を添加した PBS 1 x pH 7.4 CaCl2と MgCl2を含む)。
注:同じを使用するピペットし、ソリューションを上下にゆっくりとピペッティング後 50 mL を 15 ml 系糖密度勾配の入力済みの 6 の円錐形遠心チューブに希薄バフィー コート 25 mL を調剤します。 - 適度な加速 (9 のうち 4 に設定) の 800 x gで 20 分間の遠心とその密度に基づく細胞の分離を許可するブレーキなし。
注:遠心分離後、3 つのレイヤー表示になります。赤血球および顆粒球、プラズマのと末梢血単核球 (PBMCs) を含むホワイト リングの間に上位層を含むペレット。 - 10 mL のピペットと新しい 50 mL チューブへの転送を使用して PBMC リングを収穫します。
注:2 ~ 3 50 mL チューブがバフィー コートにつき通常必要です。この段階では、可能性が高いいくつかのプラズマは豊かな後続の手順に影響はありません収集の PBMCs を汚染します。 - トップ 50 mL PBS/EDTA を使用してすべての管、遠心時間と速度 ( g、330 x gで 10 分間、150 x gで 8 分 x 520 で 15 分) の減少と 3 連続洗浄に進みます。
注:各ステップで上清は液体廃棄物容器に注がし、細胞ペレットは 50 mL の PBS/EDTA で再停止される (ペレットは最初の洗浄後プール可能性があります)。 - 最終的な洗浄の後に、冷たい換散バッファーの 25 mL にペレットを再懸濁します。 (参照材料表) 浸透圧によって赤血球を溶解します。
- ソリューションが明確になるまで孵化させなさい (室温で ≤5 分)。
- 25 mL の分離バッファー (pH 7.4 CaCl2とない MgCl2, 2% 熱不活化ウシ胎児血清 (FBS) を添加したを含むと 1 mM EDTA pH 8.0 x PBS 1) の追加によって反作用を停止します。
- 150 x g 8 分間で 1 つのより多くの時間を洗います。
注:この段階では、PBMCs は一括人口として使用できます (手順 3 を参照してください: PBMCs や単球のトリートメントや刺激条件) または単球濃縮処理 (手順 2 を参照してください: PBMCs から単球の準備)、またはそれに続く使用のためダウン冷凍 (手順 5 を参照してください。単球や凍結/融解手順 PBMCs)。
2. PBMCs から単球の準備
- ステップ 1.10 分離バッファー内で得られる PBMCs を再懸濁します、5 x 107セル/mL に到達する数を数えます。
- キャップ 14 mL 円錐形遠心チューブに細胞懸濁液を転送します。
- 単球濃縮抗体細胞懸濁液の mL あたりカクテルを 50 μ l 添加渦、し、4 ° C で 10 分間加温
- セルの mL あたり単球濃縮ビーズの 50 μ L を追加します。
注:ビーズは、徹底的に懸濁液の均質性を確保するための vortexed である必要があります。 - 後ビーズ、まもなく渦細胞懸濁液を追加し、4 ° C で 5 分間加温
- チューブが 10 mL を塗りつぶされるまで分離バッファーをチューブの上の部分を洗い流してください。
- ゆっくりと上下にピペッティングによるソリューションをミックスします。
- 分離の磁石にキャップなし管を配置します。
- 2.5 分間室温でインキュベートします。
- 15 mL コニカル遠心管にゆっくりと注ぐ。
- この段階で単球を直接使用して、(手順 3 を参照してください: PBMCs や単球のトリートメントや刺激条件)私mmature Monocyte 派生Dendritic Cエルs (iMoDCs) にそれらを区別するためまたは (手順 4 を参照)、またはその後使用するためダウンそれらを凍結 (手順 5. を参照)。
3. PBMCs および単球刺激条件
- セルをカウントし、それらを培地の希釈 (ロズウェル パーク記念研究所メディア (RPMI) 10% FBS 1 mM ピルビン酸ナトリウム 100 U/mL ペニシリン ストレプトマイシン (ペン/連鎖球菌) + + 5 μ M β-メルカプトエタノール)、104細胞/ウェル x 1.25 まで。
- 30 μ L/ウェルの 384 ウェル プレートの細胞懸濁液を配布します。
- 濃厚化合物溶液 x 4 の 15 μ l 添加し 37 ° C、5% CO2で 1 時間インキュベートする前。
- 10 ng/mL の最終的な集中にリポ多糖 (LPS) を追加またはザイモサン (DZ) を使い果たされて、最終濃度 100 μ G/ml になる媒体にしてください。
- 37 ° C、5% CO2で一晩インキュベートします。
- 分泌された TNF のレベルを測定する上清の 10 μ L を取る (ステップ 7 を参照してください: サイトカインと生存率の測定)。
4. 単球の分化促進条件と iMoDCs
- 単球 (ステップ 2 で濃縮) をカウントし、520 x gで 5 分で細胞懸濁液を遠心分離します。
- 上澄みをピペットし、培地を追加 (RPMI + 10 %fbs 最終的な細胞の懸濁液 106セル/mL x 0.4 を取得します。
- 80 ng/mL 組換えひと IL-4 + 100 ng/mL GM-CSF を追加します。
- 6 ウェル プレートのウェルあたり細胞懸濁液 5 mL を調剤します。
- 37 ° C、5% CO2の 7 日間孵化させなさい。
- 7 日でその活性化を避けるために軽くピペッティングにより細胞を収穫します。
- 520 x gで 5 分間遠心します。
- 真空吸引と成長因子なし培養液 50 mL で再懸濁します。
- 5 分の 520 x gで遠心し、培地の 1 x 106セル/ml で再懸濁します。
- 96 ウェル平底プレートのウェルあたり細胞懸濁液 (105セル) を 100 μ l 添加を調剤します。
- 50 を追加した後の 37 ° C で 1 時間の事前 incubate 4 x μ L 集中手順 8 で説明されている混合物の解決: 化合物の準備。
- ステップ 9 で説明されている刺激 (4 倍濃縮) の 50 μ L を追加します。
- 37 ° C で 24 時間インキュベートします。
- 96 ウェル V 底プレートに各井戸および転送細胞と培養上清 (SN) を混ぜます。
- 475 x gで 5 分でスピンダウンします。
- 新しい 96 ウェル平底プレートに上清を移す、シール、さらに使用するまで-20 ° C で凍結します。
5. 単球と PBMCs 凍結/融解手順
-
凍結
- 520 x gで 5 分 PBMC や単球の細胞製剤をスピンダウンします。
- 真空は、上清を吸引し、培地で 1 x 10 の7セル/mL を凍結で細胞を再懸濁します。
- Cryotubes に細胞懸濁液の 1 mL を分注、特定の冷却装置にチューブを転送 (表を参照) し、-80 ° C に配置
-
融解
- Cryotube を解凍し、すぐに培養液 9 mL を含む 15 mL コニカル遠心管にその内容を転送します。
- 520 x gで 5 分間遠心します。
- 真空吸引液上清、5 mL の培地で細胞ペレットを再懸濁します。細胞は、さらに実験的処理する準備が整いました。
6. マウス脾臓細胞の調製と治療
注:ガイドラインとノバルティス動物福祉団体の基準によると動物の犠牲を行った。研究は、地域の政府機関の倫理委員会で承認された (Kantonales Veterinäramt ・ デア ・ シュタット バーゼル)。私たちは苦しみを最小限に抑えるために行われたすべての努力とイソフルラン過剰露出によって動物を犠牲にしました。
- 脾臓を収穫し、機械組織グラインダー装置付けし、冷たい RPMI 培地 5 ml チューブを用いた組織を切り離して考えます。
- 解離マシンの脾臓プログラムを使用すると、臓器を挽きます。
- 100 mm ナイロン携帯こし器を通って細胞をフィルターします。
- 50 mL チューブに 4 ° C で 320 x gで 10 分間遠心する懸濁液を転送します。
- 真空吸引、上清は冷たい換散バッファーの 3 mL で細胞ペレットを再懸濁し、氷で 2 分間インキュベートします。
- RPMI 培地の 7 mL を追加することによって溶解を停止します。
- 100 μ m ナイロン携帯こし器を通って再びフィルターします。
- 細胞懸濁液 4 ° C で 10 分間 330 x gでスピンダウンします。
- 真空吸引清と 11 × 106セル/ml (10 %fbs、100 U/mL ペン/ステップ 5 μ M β-メルカプトエタノールと添加 RPMI) 完全培地で細胞を再懸濁します。
- 1 x 106細胞/ウェル (90 μ L) 96 ウェル プレート (フラットボトム) のプレートします。
- 20 x の 5 μ L 濃縮複合ソリューション手順 8.3 以前 RPMI 培地で希釈を追加: マウスの脾細胞のためのシリアル希薄。
- 5% CO237 ° C で 30 分間インキュベートします。
- 20 x の 5 μ L 集中 DZ (最終濃度 30 μ g/mL) または 20 倍濃縮 LP + IFN g (TLR-4) (最終濃度 1 μ M LPS および 10 ng/mL IFN g) を追加します。
- 37 ° C、5% CO2で一晩インキュベートします。
- 330 x gで 10 分間遠心します。
- 新しいプレートに培養上清を転送、シール、さらに使用するまで-20 ° C で凍結します。
7. サイトカインと生存率の測定
-
HTRF (均質な時間分解蛍光) によって人間の TNF の計測
注:プロトコルの後仕入先の推奨事項、簡潔にまとめます。- ミックス 1 ボリューム (抗 TNF は cryptate と抗 TNF、XL665) 再構成された試薬の溶解バッファー (50 mM リン酸バッファー pH 7.0、フッ化カリウム 0.8 M (KF) 0.2% ウシ血清アルブミン (BSA)) の 19 巻。
- 2 つのすぐに使える抗体ソリューションだけ試薬を塗布する前に 1:1 を混ぜます。
- 白 384 ウェル プレートにステップ 3.6 から培養上清の 10 μ L を分注します。
- 抗体ミックスの 10 μ L を分注します。
- 4 ° C で一晩インキュベート ・ シーラーとプレートを取り外します。
- マイクロ プレート リーダー (50-200 フラッシュ) の板をお読みください。
- HTRF (均質な時間分解蛍光) による人間の IL-23 測定
注:プロトコルの後仕入先の推奨事項、簡潔にまとめます。- (抗 IL 23 cryptate 抗体および抗 il-23 D2 抗体) 再構成の試薬の 1 つのボリュームを検出バッファー #3 の 19 のボリュームに混ぜてください。
- 2 つのすぐに使える抗体ソリューションだけ試薬を塗布する前に 1:1 を混ぜます。
- 白 384 ウェル プレートにステップ 3.6 から培養上清の 10 μ L を分注します。
- 抗体ミックスの 10 μ L を分注します。
- 4 ° C で一晩インキュベート ・ シーラーとプレートを取り外します。
- マイクロ プレート リーダー (50-200 nm フラッシュ) の板をお読みください。
-
人間 IL-6、イリノイ 8、il-1、TNF α 電気化学発光測定
注:すべてのサンプルが希釈 2 で 150 分の 1 で希釈された (最初の希釈: 150 μ L に 10 μ L、180 μ L で 20 μ L)。プロトコルの後仕入先の推奨事項。- サンプルや希釈剤 2 標準を希釈します。
- 1/4 シリアル倍希釈を使用して希釈剤 2 標準の希釈に進みます。
- 3 回洗浄バッファーでプレートを洗います。
- サンプルの井戸あたり標準 50 μ L を分注します。
- 攪拌下で室温で 2 時間インキュベートします。
- 4 回 PBS + 0.05% を洗浄するポリソルベート 20。
- 希釈 3 の検出の抗体 (3 ml 最終各抗体の 60 μ L) の 25 μ L を追加します。
- 攪拌下で室温で 2 時間インキュベートします。
- 4 回 PBS + 0.05% を洗浄するポリソルベート 20。
- 読み取りバッファーの井戸あたり 150 μ L を追加泡を回避 (トリス ベースのバッファー、tripropylamine を含む希釈 ddH20 2 x) 電気化学発光イムノアッセイにおける光生成のための共同の反応として。
- 多重プレート リーダー (遅延) なしの板をお読みください。
-
マウス TNF、サプライヤーのプロトコルに続く elisa 法による測定
- 上清 1:1 (蛋白質を含むバッファーを使用する準備ができて) アッセイの希釈液で希釈します。
- キットの説明に従って、試薬、サンプル、および標準的な希薄を準備します。希釈アッセイの 50 μ L を各ウェルに追加します。
- 50 μ L の標準、コントロール、または井戸ごとにサンプルを追加します。
- 1 分のプレート フレームをやさしくタッピングでミックスします。
- 指定された付着力のストリップにかぶせて、2 時間室温で孵化させなさい。
- それぞれ、400 μ L/ウェル (計 5 回ステップを繰り返してください) の洗浄を吸い出しなさい。
- 最終的な洗浄の後、吸引洗浄バッファーの残りのすべてを削除します。
- プレートを反転し、きれいなペーパー タオルとしみを付けなさい。
- 各ウェルに 100 μ L のマウス TNF-α 共役を追加します。新しい付着力のストリップでカバーします。
- 2 時間室温で孵化させなさい。
- 7.4.4 のステップのように吸引・洗浄を繰り返します。
- 各ウェルに基質溶液 100 μ L を追加し、光から保護された室温で 30 分間インキュベートします。
- 各ウェルに 100 μ L の希釈塩酸溶液 (停止液) を追加します。軽くたたくように徹底したミキシング プレート。
- 450 の光学濃度を測定 nm (560 で設定補正波長 nm) (30 分以内に行わなければ) マイクロ プレート リーダーを使用しています。
- 上清 1:1 (蛋白質を含むバッファーを使用する準備ができて) アッセイの希釈液で希釈します。
-
細胞生存率
- PBMC または単球の準備から培養上清を除去した後 10% の最終濃度に細胞懸濁液に直接追加レサズリン ソリューション (酸化還元インジケーター) を使用する準備ができてを使用してセルの実行可能性を評価します。
- 37 ° C、5% CO2で 1 ~ 2 時間インキュベートします。
- 590 で蛍光を読み取る nm (励起 540 nm) マイクロ プレート リーダーを使用しています。
8. 化合物の調製
-
IMoDCs のシリアル希釈
- 希薄 MLT 827 ストック溶液 (ジメチルスルホキシド (DMSO) で 1 つ (4 倍濃縮) 8 μ M に到達する媒体に 10 mM。
- 六つのステップ 1:5 のシリアル希釈、ミディアム + 0.08 %dmso を使用してを実行します。車両 (化合物ない) 状態の同じ媒体 + 0.08 %dmso 溶液を使用します。
-
単回投与試験 iMoDCs
- 1 つの移動 (4 倍濃縮) 4 μ M に到達する媒体に MLT 827、AFN700、Cpd11 原液を希釈します。
-
マウスの脾細胞の連続希釈
- 0.01 μ m まで、終わりの DMSO 濃度 0.1% の (次の中の 1 つ行く希釈原液の 10 mM から得られる) 10 μ M MLT 827 溶液を希釈します。
- 希釈手順については、各希釈の 2 μ L を取る、井戸の中に 38 μ l 添加 RPMI とピペット 5 μ L を追加します。
注:すべての治療は、3 通で実行されます。
9 刺激の準備
-
劣化ザイモサン (DZ)
- アルジェリアの 10 mg 2 mL の滅菌エンドトキシン フリーの水を追加します。
- 原液、渦も事前に各使用を均質化する渦。
- -20 ° C で割り切れるソリューションとストアの因数
-
トレハロース-6, 6-dibehenate (TDB)
- 1 mg TDB、15-30 秒の水風呂で 60 ° C で熱に DMSO の 100 μ L を追加します。
- 渦と 900 μ L の滅菌 PBS、再び渦をすぐに追加。
- 各使用前にボルテックスによって均質化し、60 ° C で 10-15 分の熱します。
- 4 ° C でのソリューションを保持します。
- 連続希釈、MLT 827 化合物としては単回投与の準備を実行します。
注:TDB は、DMSO で準備する必要がある、ため最終 1 %dmso 濃度は細胞刺激中に存在です。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
骨髄細胞における MALT1 自己免疫 1、ヒトデクチン 2、MINCLE6など、いくつかの C 型レクチン様受容体活性化シグナルを下流に中継します。(裾) ITAM モチーフ含んでいる受容体に依存してこれらの経路 (例えば,自己免疫 1) または ITAM モチーフを含む共同受容体 (例えば, FcRγ、ヒトデクチン 2、MINCLE の) 募集、SYK キナーゼ (図 1) をアクティブにします。これは蛋白質キナーゼ C アイソ フォーム、すなわち pkc δ、CARD9、ひいては CARD9/BCL10/MALT1 複雑な形成、TRAF6 の下流 NF-κ B 活性化12募集を廃止するの活性化に します。対照的に、TLR 4 経路は、TRAF6 MYD88/アイラック依存的 NF κ B 活性化 (図 1) が、MALT1 独立で募集します。性の活性部位阻害剤 z VRPR fmk11,13,14MALT1 欠乏症と同様の薬理学的治療の遺伝的モデルを用いた MALT1 のこの差分の関与の証拠を求めた。
最近報告された強力かつ選択的な MALT1 阻害 MLT 82715を使用し、この化合物を C 型レクチン様、Toll 様受容体の下流 TNF 産それぞれ規制するだろうかどうかに尋ねた。人間の PBMCs とマウス脾臓細胞劣化ザイモサン (DZ, 自己免疫 1 の知られているアゴニスト) 促進されたまたはリポ多糖 (LPS、TLR 4 の知られている作動薬)、我々 は 20 時間後培養上清中の TNF リリースを測定します。両方の人間とマウスの試金、MLT 827 は選択的に TNF 産自己免疫 1 経路による TLR 4 経路 (図 2) ではなく、駆動をブロックしました。Z VRPR fmk 化合物 (補足図 1) の孵化の時に似たようなデータを得た。
経路の洞察力を得るためには、実験を行ったさらにひと単球および未熟な単球由来樹状細胞 (iMoDCs)、MLT 827 SYK 阻害剤 Cpd1116に、IKK 阻害剤 AFN700 の影響の比較15.LPS 刺激を受けた単球、TNF-α の生産の AFN700 によってほぼ完全に廃止されたが、Cpd11 に敏感ではなかった (図 3 a)、NF-κB/SYK 活動、それぞれ (TLR 4 経路の依存関係/独立性に一貫しています。図 1を参照)。対照的に、iMoDCs で自己免疫 1 によって駆動される TNF-α 産表示感度 Cpd11 MLT 827、AFN700 感度に加えて (図 3 b、補足図 2) SYK/CBM のシグナル伝達の関与についてのさらなる証拠を提供します。カスケードで自己免疫 1 経路 (図 1)。注目すべき、IL-1、産 IL-6 と IL-23 刺激による自己免疫 1 もに敏感だった 3 つの阻害剤と TNF - 同様の規制機構を示します。ただし、il-8 産生に対する 3 つの化合物の影響が少ない (図 3 b、補助図 2) このサイトカインの個別制御機構を提案しました。
に加えて自己免疫-1、ヒトデクチン 2、MINCLE CARD9 シグナロソーム7の刺激関数などの他の CLLRs。我々 はそのため MINCLE アゴニスト トレハロース-6, 6-dibehenate (時間未定) に挑戦 iMoDCs の MLT 827 をテストしました。TNF - の生産につながった 50 μ G/ml 以上未定の濃度を高める il-6, IL-1, MLT-827 (図 4 a) のブロックの効果から見た MALT1 paracaspase 活動に依存していた。一貫性のある結果が得られたとき自己免疫 1 (図 4 b) を刺激するためにアルジェリアの濃度の増加と iMoDCs に挑戦します。
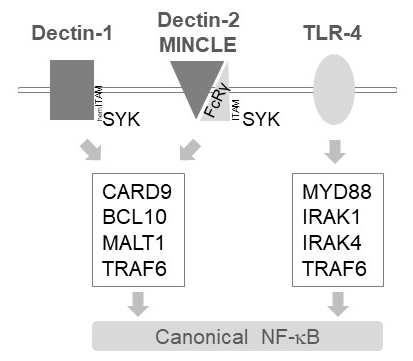
図 1: NF-κ B シグナル伝達自己免疫 1、MINCLE TLR 4 下流。漫画では、正規の NF-κ B 活性化経路下流自己免疫 1、ヒトデクチン 2、MINCLE または骨髄細胞における TLR 4 の主要な機能を示しています。HemITAM を含む自己免疫 1 受容体17直接 SYK TRAF6 依存 NF-κ B の活性化につながる、CBM (CARD9/BCL10/MALT1) 複合体の形成を刺激することを行うことができます。自己免疫 2 や MINCLE など他の C 型レクチン様受容体は、CBM に従事し NF κ B を有効に ITAM を含む FcRγ チェーンを採用する必要があります。TLR 4 受容体は、TRAF6 の上流の MYD88 と IRAK1/IRAK4 キナーゼ依存、NF-κ B の活性化のための別のメカニズムを使用します。

図 2: 人間の TNF α とマウスの細胞の生産のため MALT1 を介して信号を自己免疫 1.(A) Unterreiner のように人間の PBMCs データet al., 2017 (図 2 a)11。人間の PBMCs LPS (TLR 4 作動薬) の 1 ng/mL と 100 μ g/mL DZ (自己免疫 1 アゴニスト) MLT 827 の傾斜濃度の存在下で 20 h の刺激を受けました。TNF-上清にリリース HTRF し, 定量化しました。(B) マウス脾細胞と、濃度範囲の MLT-827 で 30 分間、その後を扱われた刺激 30 μ G/ml DZ または 1 μ g/mL LP + 10 ng/mL IFN-18 h TNF α の細胞培養上清は、elisa 法により測定されました。± SEM の 3 つの測定の手段として、2 つの実験と同様の結果の 1 つは、表示されます。

図 3: IKK やサイトカイン産生の TLR 4 と自己免疫 1 下流の SYK 依存します。(A) ひと単球が MLT 827 で 1 h の前処理 (1 μ M)、Cpd11 (1 μ M)、または AFN700 (3 μ M) や車両 (DMSO)。20 h の 10 ng/mL lps 刺激された細胞および TNF - 清 HTRF による定量化を行った。(B) TNF-α、IL-1 β、il-6, ひと単球由来樹状細胞 (iMoDCs) アルジェリアで 24 時間刺激による IL 23 と IL-8 生産 (100 μ g/mL) 1 h (1 μ M) ですべて MLT-827、Cpd11、AFN700 と前培養後または DMSO。DMSO 処理した試料中のサイトカイン濃度は 100% で設定されました。データ 3 つの測定の平均 ± SD、3 つの独立実験の代表です。* P < 0.05;* * P < 0.01;P < 0.001、ペア 2-スチューデントの両側 t 検定。

図 4: iMoDCs による C 型レクチンようなサイトカイン生産。TNF α, イリノイ-MINCLE アゴニスト トレハロース-6, 6-dibehenate で 24 時間 (TDB、100 μ g/mL) 1 β と iMoDCs による il-6 産生刺激 (A) または自己免疫 1 アゴニスト DZ (100 μ g/mL) (B) MLT 827 1 h 前培養後 (1 μ M) や DMSO。データ 3 つの測定の平均 ± SD、3 つの独立実験の代表です。
補足ファイル 1.このファイルをダウンロードするここをクリックしてください。
補足ファイル 2.このファイルをダウンロードするここをクリックしてください。
補足ファイル 3.このファイルをダウンロードするここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
この仕事で人間のシグナル伝達経路とマウス自然細胞研究し、MALT1 蛋白分解機能への依存度を調査簡単な実験設定を使用しました。以前の作業11で拡大して、我々 の研究は、MALT1 paracaspase 活動が C 型レクチン様受容体誘導サイトカイン産生、TNF α などを制御することを示した。対照的に、TLR 4 誘導性 TNF α は両草種と MALT1 の独立していた。総称して、これらのデータは、MALT1/CBM シグナロソーム下流の C 型レクチン様受容体、6、研究以前12,18で発表されたの主要で選択的な貢献を確証しました。
TLR 4 MALT1 骨髄細胞内のシグナル伝達の明確な独立性は他に適用するかどうかのセルタイプを探検するために残っています。例えば、B リンパ球、tlr 以前示された B 細胞抗原受容体19の下流、B 細胞活性化に貢献します。実際には、証拠は、TLR 4 刺激人間マウス B 細胞は MLT 827 に感度を表示を未発表を持っています。したがって、B 細胞受容体の下流にさらに力学的洞察は貴重になります。このコンテキストでは、B 細胞性リンパ腫の最近の研究は、B 細胞受容体と TLR9 受容体20の下流のシグナル伝達経路のクラスタ リングのための証拠を提供しました。NF-κ B 活性化 B 細胞受容体と TLR 経路の両方の仲介者となる TRAF6 MALT1 プロテアーゼ阻害に両方の経路の感受性を説明する可能性のクロストークのポイントがあります。逆に、TRAF6 はまた CLLRs と Tlr の NF-κ B の誘導のための一般的な下流プレーヤーですがこれらの 2 つの経路がクロストークに骨髄細胞における MALT1 paracaspase 依存的に表示されません。
この作品は、サイトカインのシグナル伝達経路の簡単な読み出しを提供し、化合物プロファイリングのため容易に実装することができますに焦点を当てた。解き明かす MALT1 生物 MALT1 の選択的かつ強力な阻害剤の値が強調表示されます。さらに機械論的な洞察を得ることが必要になります追加作業とより近位の試金の開発など MALT1 自然免疫に関与するシグナル伝達制御基板を特徴付けるため。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者が明らかに何もありません。
Acknowledgments
我々 は Unterreinerらから図 2 aをここで再現する彼らの承認 (ナンバー 4334770630127) のエルゼビアに感謝します。(2017 年)。
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm nylon cell strainer | Sigma | CLS431752 | |
| 14 mL Falcon tube | BD Falcon | 352057 | |
| 15 mL Falcon tube | Falcon | 352090 | |
| 50 mL Falcon tube | Falcon | 352070 | |
| 6 well plates | Costar | 3516 | |
| 96 well flat-bottom plate, with low evaporation lid | Costar | 3595 | |
| 96 well V-bottom plate | Costar | 734-1798 | |
| Ammonium Chloride - NH4Cl | Sigma | A9434 | |
| Assay diluent RD1-W ELISA | R&D | 895038 | Assay diluent |
| Cell culture microplate, 384 well, black | Greiner | 781986 | |
| Depleted Zymosan | Invivogen | tlrl-dzn | now: tlrl-zyd |
| Dimethyl sulfoxide | Sigma | D2650 | DMSO |
| EDTA-Na2 | Sigma | E5134 | Ethylenediaminetetraacetic acid disodium salt dihydrate |
| ELISA muTNF-α | R&D | SMTA00 | |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | |
| gentleMACS C tubes | MACS Miltenyi Biotec | 130-096-334 | |
| gentleMACS dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| GM-CSF | Novartis | - | |
| Heat-inactivated Fetal bovine serum | Gibco | 10082 | FBS |
| HTRF hu IL-23 | CisBio | 62HIL23PEG | |
| HTRF hu TNF-α | CisBio | 62TNFPEC | |
| HTRF reconstitution buffer | CisBio | 62RB3RDE | 50mM Phosphate buffer, pH 7.0, 0.8M KF, 0.2% BSA |
| IFN-γ | R&D | L4516 | |
| IL-4 | Novartis | - | |
| Isoflurane | Abbott | Forene | |
| Lipopolysaccharides (LPS) | Sigma | L4391 | LPS used in human samples |
| Lipopolysaccharides | Sigma | L4516 | LPS used in murine samples |
| Lysis buffer | Self-made | - | 155 mM NH4Cl, 10 mM KHCO3, 1 mM EDTA, pH 7.4 |
| Magnet | Stemcell | 18001 | |
| Microplate, 384 well white | Greiner | 784075 | |
| Monocytes enrichment kit | Stemcell | 19059 | |
| Nalgene Mr. Frosty Cryo 1°C Freezing Container | Nalgene | 5100-0001 | cooling device (containing Propanol-2) |
| PBS 1x pH 7.4 [-] CaCl2 [-] MgCl2 | Gibco | 10010 | Phosphate-buffered saline |
| Penicillin/Streptomycin | Gibco | 15140 | Pen/Strep |
| Potassium bicarbonate - KHCO3 | Sigma | P9144 | |
| PrestoBlue | Invitrogen | A13262 | Resazurin solution for viability assessment |
| Propanol-2 | Merck | 1.09634 | |
| Read buffer | MesoScale Discovery | R92TC-3 | Tris-based buffer containing tripropylamine |
| Recovery cell culture freezing medium | Gibco | 12648-010 | freezing medium |
| Roswell Park Memorial Institute Medium (RPMI) with Glutamax | Gibco | 61870 | + 10% FBS for iMoDCs + 10% FBS + 1 mM Sodium Pyruvate + 100 U/mL Pen/Strep + 5 µM β-mercaptoethanol for human PBMCs and monocytes + 10% FBS + Pen/Strep + 5 µM β-mercaptoethanol for murine splenocytes |
| Separation buffer | Self-made | - | PBS pH 7.4 + 2% FBS + 1 mM EDTA pH 8.0 |
| Sodium Pyruvate | Gibco | 11360 | |
| Trehalose-6,6-dibehenate | Invivogen | tlrl-tdb | TDB |
| Tween 20 | Sigma | P7949 | Polysorbate 20 |
| UltraPure 0.5 M EDTA pH 8.0 | Invitrogen | 15675 | Ethylenediaminetetraacetic acid |
| Viewseal sealer | Greiner BioOne | 676070 | |
| V-PLEX Proinflammatory Panel 1 Human Kit | MesoScale Discovery | K15049D | electrochemiluminescent multiplex assay (IL-1β, TNF-α, IL-6, IL-8) |
| β-Mercaptoethanol | Gibco | 31350 |
References
- Coornaert, B., et al. T cell antigen receptor stimulation induces MALT1 paracaspase-mediated cleavage of the NF-kappaB inhibitor A20. Nature immunology. 9 (3), 263-271 (2008).
- Rebeaud, F., et al. The proteolytic activity of the paracaspase MALT1 is key in T cell activation. Nature immunology. 9 (3), 272-281 (2008).
- Jaworski, M., Thome, M. The paracaspase MALT1: Biological function and potential for therapeutic inhibition. Cellular and Molecular Life Sciences. 73 (3), 459-473 (2016).
- Meininger, I., Krappmann, D. Lymphocyte signaling and activation by the CARMA1-BCL10-MALT1 signalosome. Biological Chemistry. 397 (12), 1315-1333 (2016).
- Qiao, Q., et al. Structural architecture of the CARMA1/Bcl10/MALT1 signalosome: nucleation-induced filamentous assembly. Molecular cell. 51 (6), 766-779 (2013).
- Gross, O., et al. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity. Nature. 442 (7103), 651-656 (2006).
- Chiffoleau, E. C-type lectin-like receptors as emerging orchestrators of sterile inflammation represent potential therapeutic targets. Frontiers in Immunology. 9 (FEB), 1-9 (2018).
- Taylor, P. R., et al. Dectin-1 is required for beta-glucan recognition and control of fungal infection. Nature Immunology. 8 (1), 31-38 (2007).
- Lanternier, F., et al. Primary immunodeficiencies underlying fungal infections. Current opinion in pediatrics. 25 (6), 736-747 (2013).
- Thome, M. Multifunctional roles for MALT1 in T-cell activation. Nature reviews. Immunology. 8 (7), 495-500 (2008).
- Unterreiner, A., Stoehr, N., Huppertz, C., Calzascia, T., Farady, C. J., Bornancin, F. Selective MALT1 paracaspase inhibition does not block TNF-α production downstream of TLR-4 in myeloid cells. Immunology Letters. , 48-51 (2017).
- Strasser, D., et al. Syk Kinase-Coupled C-type Lectin Receptors Engage Protein Kinase C-δ to Elicit Card9 Adaptor-Mediated Innate Immunity. Immunity. 36 (1), 32-42 (2012).
- Jaworski, M., et al. Malt1 protease inactivation efficiently dampens immune responses but causes spontaneous autoimmunity. The EMBO journal. 33 (23), 2765-2781 (2014).
- Yu, J. W., et al. MALT1 protease activity is required for innate and adaptive immune responses. PLoS ONE. 10 (5), 1-20 (2015).
- Bardet, M., et al. The T-cell fingerprint of MALT1 paracaspase revealed by selective inhibition. Immunology and Cell Biology. 96 (1), 81-99 (2018).
- Thoma, G., et al. Discovery and profiling of a selective and efficacious syk inhibitor. Journal of Medicinal Chemistry. 58 (4), 1950-1963 (2015).
- Bauer, B., Steinle, A. HemITAM: A single tyrosine motif that packs a punch. Science Signaling. 10 (508), 1-10 (2017).
- Gringhuis, S. I., et al. Selective c-Rel activation via Malt1 controls anti-fungal TH-17 immunity by dectin-1 and dectin-2. PLoS Pathogens. 7 (1), (2011).
- Dufner, A., Schamel, W. W. B cell antigen receptor-induced activation of an IRAK4-dependent signaling pathway revealed by a MALT1-IRAK4 double knockout mouse model. Cell Communication and Signaling. 9 (1), 6 (2011).
- Phelan, J. D., et al. A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature. , In press (2018).



