Summary
Cette étude présente un protocole permettant de mesurer la microcirculation dans la muqueuse buccale humaine par imagerie de contraste de speckle laser. La surveillance de la cicatrisation après que vestibuloplasty combiné avec un greffon de collagène xénogène est présenté sur un cas clinique.
Abstract
Contraste de speckle laser imaging (LSCI) est une nouvelle méthode pour mesurer la perfusion sanguine superficielle sur de grandes superficies. Puisqu’il est non invasif et évite le contact direct avec la zone mesurée, il est adapté pour la surveillance des modifications du débit sanguin durant la cicatrisation chez des patients humains. Vestibuloplasty est la chirurgie parodontale au vestibule oral, visant à rétablir la profondeur vestibulaire avec élargissement simultané de la gencive kératinisée. Dans ce cas clinique spécial, un lambeau d’épaisseur de split a été élevé à la première prémolaire supérieure et une matrice de collagène xénogène a été adaptée au destinataire lit qui en résulte. LSCI a été utilisé pour surveiller la re - et une néovascularisation de la prothèse et la muqueuse environnante pendant un an. Un protocole est introduit pour le réglage de la mesure de la microcirculation dans la muqueuse buccale, en soulignant les difficultés et les échecs possibles.
L’étude de cas clinique présenté ont démontré que, suivant le protocole approprié — LSCI est une méthode appropriée et fiable de suivi de la microcirculation en une guérison enroulé dans la muqueuse buccale humaine et donne des informations utiles sur l’intégration de la greffe.
Introduction
Suivi de l’évolution à long terme des humaine microcirculation gingivale en situation clinique est un sujet brûlant en chirurgie buccale et parodontale. Toutefois, une évaluation fiable de la perfusion peut être difficile. Il y a seulement quelques méthodes qui ne mesurent pas invasive de changements dans la circulation sanguine de la muqueuse humaine. Deux de ces emploient un laser beam1,2,3,4, mais d’une manière différente. Débitmétrie doppler laser (LDF) se sert de l’effet Doppler Maj dans un laser à faisceau5,6, tandis que le contraste de speckle laser (LSCI) méthode d’imagerie repose sur le modèle de chatoiement de la lumière laser rétrodiffusée pour mesurer la vitesse du sang rouge 7de cellules.
LDF mesure uniquement dans un seul point, et reproductible normalisation de la position des capteurs est une tâche souhaitable mais difficile. Un autre problème est que la sonde de la LDF est petite diamètre (1 mm2). La mesure des points prédéterminés avant chirurgie est trop spécifique et peut être aveugle aux changements circulatoires postopératoires, tandis que le œdème, l’élimination de tissu, mouvement de tissu ou la prothèse implantée provoquent des changements significatifs dans la géométrie postopératoire des personnes touchées tissus mous. La distance de mesure de la LDF est inférieure à 1 mm, ce qui interdit l’utilisation d’une attelle dentaire avec un trou prédéterminé pour la sonde en cas de changement volumétrique des tissus. LSCI ne nécessite pas d’outils spéciaux pour la localisation et permet de mesurer dans les zones de plusieurs cm2. Ainsi, la cicatrisation des plaies peut être suivie tout au long du site chirurgical. En outre, LSCI peut afficher la perfusion sanguine dans des images couleur à une fraction de seconde, avec une résolution jusqu'à 20 μm.
Le dispositif LSCI présenté dans cet article est utilisé principalement pour des applications de recherche sur les animaux où haute résolution dans les zones de petite mesure est souhaitée. Cependant, la structure et l’histologie de la muqueuse buccale humaine étant différentes de zone à zone (gencive attachée, gencive marginale, la muqueuse vestibulaire), la circulation sanguine est aussi hétérogène8. Par conséquent, LSCI haute résolution a un grand avantage sur LSCI normal-résolution qui est habituellement utilisé dans l’essai humain.
L’instrument LSCI emploie un laser invisible (longueur d’onde 785 nm). Le faisceau est divergé pour éclairer la zone de mesure, créant un motif moucheté. Une caméra CCD images le motif moucheté dans la zone éclairée. La caméra CCD utilisée dans ce système comporte une zone d’imagerie active de 1386 x 1034 pixels et sa résolution est entre 20 à 60 µm/pixel en fonction de la taille de la zone de mesure et sur la création du logiciel (faible, moyen, élevé). Il peut prendre des images à une vitesse de 16 images par seconde, ou même plus, jusqu'à 100 images par seconde, si la taille de l’image est réduite. La perfusion sanguine est calculée par le logiciel intégré. Il analyse les variations dans le modèle de speckle et quantifie le contraste. Le flux qui en résulte est couleur codée pour produire une image de perfusion. Selon nos résultats antérieurs, LSCI évalue la perfusion sanguine de la gencive avec une bonne répétabilité et reproductibilité9. Cela implique que c’est un outil fiable pour surveiller les changements dans la microcirculation de la muqueuse buccale, non seulement dans les expériences de courte durée, mais aussi au cours des études à long terme à suivre la progression de la maladie ou la blessure curative10.
Dans cet article, nous présentons un rapport de cas clinique pour démontrer que la haute résolution spatiale de LSCI permet de révéler le motif de la néovascularisation d’un greffon de collagène Xénogénique. En outre, cette affaire indique que LSCI, en raison de sa haute fiabilité, pouvait détecter avec sensibilité des variations individuelles. C’est important que les importantes variations anatomiques locales et un fond différent systémique entre les cas, il est difficile de normaliser l’intervention chirurgicale dans les essais cliniques de la chirurgie parodontale.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
La méthode déclarée a été employée dans un essai clinique qui a accordé l’homologation éthique du Comité hongrois de la santé d’enregistrement et un centre de formation (numéro d’agrément : 034310/2014/OTIG).
1. LSCI Setup
- Allumez l’ordinateur et ses périphériques.
- Allumer l’instrument LSCI pour être utilisé avec le commutateur sur le panneau arrière.
- Laissez l’instrument à réchauffer pendant au moins 5 min. L’instrument est prêt pour la mesure lorsque les deux voyants sur le panneau arrière n’ont cessé de clignoter.
- Démarrez le logiciel en double-cliquant sur l’icône du logiciel sur le bureau ou via le menu démarrer.
- Attendez que tant la jaune et la LED verte sur le panneau arrière ont cessé de clignoter, ce qui indique que le laser est chaud et l’initialisation est terminée.
Remarque : Lors du démarrage du système, un occasionnellement demandera d’effectuer la procédure de vérification du système.
2. vérification du système
- Utilisez la boîte de calibrage fournie. Retirez le couvercle de la boîte de calibration et secouer pour éviter la sédimentation dans la suspension colloïdale.
- Abandonner le couvercle pendant 30 s pour éviter les bulles.
- Remettez le couvercle sur la boîte d’étalonnage.
- Cliquez sur avancé | Vérification | Vérifiez l’instrument.
- Sélectionnez la Routine de vérification | Prochaine.
- Tourner la tête à 90°, fixer le boîtier d’étalonnage à l’aide des aimants intégrés et cliquez sur suivant.
- Entrez la température de la pièce dans la zone de texte, sélectionnez ° C et cliquez sur Démarrer.
- Patientez pendant que l’assistant a terminé la procédure de vérification.
- Après une procédure de vérification réussie, fermez l’assistant en cliquant sur terminer.
3. participante préparation
- S’assurer que la mesure est effectuée dans une pièce à température contrôlée (26 ° C).
- Installer le patient dans une position confortable en position couchée dans un fauteuil dentaire et placer un oreiller sous vide sous sa tête (Figure 1).
- Laisser le patient pendant 15 minutes avant que des mesures soient prises.
4. microcirculation mesure de l’Image
- Dans le menu outils , sélectionnez et cliquez sur Éditeur de projet. Une nouvelle fenêtre s’ouvre dans lequel les paramètres utilisés peuvent être sauvegardés.
- Dans la zone projets, cliquez sur nouveau pour créer un nouveau projet. Entrez le « vestibule », puis cliquez sur OK.
- Dans la boîte de Sites, cliquez sur nouveau pour créer un nouveau site. Entrez « Dent 14 », puis cliquez sur OK.
- Sous le panneau contenu de la dent 14 ajoute « 10 cm » comme la distance requise pour la Distance de travail et entrez une largeur de 3 cm et une hauteur de 2 cm dans les zones de mesure.
- Réglez la résolution de la densité de point à la normale et la cadence de 16 images/s et sélectionnez temps dans la liste déroulante durée pour définir la durée d’enregistrement à 0:30.
- Sélectionnez « Record avec aucun étalement » et définissez le taux de capture de photo couleur à 1/seconde.
- Puis cliquez sur « Appliquer » et « OK » pour enregistrer les paramètres de projet.
- Dans le menu fichier , sélectionnez et cliquez sur nouvel enregistrement. Ouvrira une nouvelle fenêtre de l’Image et le panneau de configuration s’affichera.
- Sous Configuration de l’enregistrement, sélectionnez « Vestibule » du projet et « dent 14"pour la 4.9. Site.
- Ouvrez la liste déroulante objet , cliquez sur nouveau dans la boîte de dialogue sélectionner l’objet et entrez le nom du Patient.
- Cliquez sur OK et entrez un nom pour l’enregistrement dans le champ Nom de Rec : par exemple, jour 1 (jours écoulés après l’opération) et le nom de l’opérateur dans le domaine de l’opérateur .
- Avant de commencer la mesure microcirculation de l’image, du patient mesure pouls et tension artérielle.
- Évacuer l’air de l’oreiller vide pour fixer la tête du patient dans une position correspondant à la zone étudiée.
- Demandez le patient d’ouvrir la bouche.
- Rétracter doucement les lèvres par deux miroirs dentaires (Figure 1).
- Régler la tête de l’instrument parallèle à la zone mesurée de la gencive. Un intégré visible (650 nm) laser indicateur facilite le positionnement de l’imageur par rapport à la bouche du patient.
- Ajuster la distance de travail à 10 cm en déplaçant l’instrument en ce qui concerne le tissu. La distance est mesurée en permanence par le dispositif LSCI et il est affiché par le logiciel en tant que valeur travail distance/mesurée sous Configuration de l’Image.
- Instruire le sujet reste encore pour la durée de la mesure.
- Cliquez sur le bouton enregistrer pour démarrer l’enregistrement. La couleur de la fenêtre d’Image passe maintenant au rouge, indiquant que l’enregistrement est en cours. Le panneau de configuration est remplacé par le Comité de l’enregistrement. Enregistrement s’arrête automatiquement après 30 s. Lorsque l’enregistrement est terminé, la couleur de la fenêtre de l’Image change au bleu et le panneau enregistrement est remplacée par la Commission d’examen.
- Retirez les miroirs dentaires et permettent au patient de fermer sa bouche et avaler.
- Basculez vers l’image en direct en appuyant sur le bouton reprendre l’enregistrement .
- Répéter deux fois les étapes de 4.14 à 4.21.
- Fermez le fichier. Les données sont enregistrées automatiquement.
- Mesurer la tension artérielle et le rythme cardiaque après les mesures LSCI.
5. hors ligne analyse
- Analyser les images LSCI en utilisant le logiciel intégré. Allez dans affichage Image ou Split (Figure 2).
- Définir des zones d’intérêt (ROI). Remarque : les valeurs de la perfusion de pixels dans un retour sur investissement sont en moyenne et définies comme la valeur du flux sanguin du ROI, exprimée en une valeur arbitraire, appelée Laser Speckle Perfusion unité (LSPU).
- Sélectionnez la forme désirée du ROI dans la palette d’outils ROI sur la droite.
- Sélectionnez l’option appliquer dans la palette d’outils ROI, qui s’applique à des opérations de retour sur investissement à toutes les images de l’enregistrement.
- Dessiner le ROI en cliquant sur et maintenir le bouton de la souris dans l’image de l’intensité, traîner le ROI à la taille désirée et relâcher la souris bouton (clic et double-clic pour les ROIs de forme libre). Régler la position du ROI, redimensionner ou faire pivoter, si nécessaire.
- Répétez les étapes de 5,3. à 5.5 autant de fois que le nombre désiré de ROIs (Figure 3).
- Définir des périodes de temps d’intérêt (TOI). Cela permet une moyenne de perfusion dans un retour sur investissement sur une période déterminée (Figure 2).
- Allez dans affichage graphique ou Split. Cliquez sur l’outil ajouter TOI.
- Cliquez et maintenez sur le graphique à la position où vous souhaitez la TOI pour commencer et faites glisser le curseur à la position finale souhaitée. Puis relâchez le bouton de la souris.
- Exporter les données de la table de la valeur moyenne pour un traitement ultérieur.
- Construire les courbes de débit sanguin par un logiciel approprié utilisé pour l’analyse statistique.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Vestibuloplasty est la chirurgie parodontale au vestibule oral, visant à accroître la profondeur vestibulaire, la zone de la gencive kératinisée et l’épaisseur des tissus mous pour esthétique améliorée et la fonction. Le lambeau d’épaisseur split apicalement repositionnée combiné avec une matrice de collagène est une procédure vestibuloplasty fréquemment utilisés. Matrice de collagène xénogène est une alternative viable à une greffe gingivale autogène pour augmenter la quantité de gencive kératinisée11,12,13; Toutefois, aucune donnée n’est disponible que sur l’orientation de la revascularisation du greffon et sur la manière dont celles-ci affectent la micro-circulation des tissus environnants. Compréhension de ces mécanismes peut faciliter rabat appropriée et conception d’incision dans la chirurgie parodontale.
Un patient masculin de 17 ans avec une largeur insuffisante de la gencive kératinisée à la première prémolaire dans le maxillaire a été traitée par vestibuloplasty, à l’aide d’un lambeau d’épaisseur split apicalement repositionnée combinée avec une matrice de collagène. Intrabuccales photos (prises par un appareil photo) et mesures de débits (BF) de sang par LSCI ont été prises avant la vestibuloplasty (de base) ainsi que 1, 2, 3, 4, 5, 7, 9, 11, 14, 21, 27 jours et de 2, 3, 4, 5, 6 et 12 mois après l’opération. Pouls et tension artérielle ont été évalués avant et après chaque mesure.
Pendant l’analyse hors ligne, plusieurs ROIs ont été déterminées dans le domaine de la muqueuse augmentée ; certains dans la région de greffe et d’autres dans la muqueuse environnante, définie comme « peri » régions. Tel qu’illustré à la Figure 3, le « peri » et le greffon les régions étaient encore divisées en zones selon la distance entre le centre de la prothèse implantée, marqué comme zone F dans l’image. Zones A et B sont définies dans les zones C, D et E dans la région de la prothèse et le « peri » région. Chacune de ces zones a été délimitées séparément aux quatre côtés de la prothèse (mésiale, distale, apicale et coronale). Chaque tir de 30 secondes a été identifié comme un TOI (Figure 2). Données à chaque ROI et TOI ont été exportées dans un tableur. Courbes d’écoulement de sang ont été construits par un logiciel approprié utilisé pour l’analyse statistique.
Il n’y avait aucun changement important dans la pression artérielle moyenne (PAM) au cours de l’expérience d’un an, soit en carte avant ou après les mesures du débit sanguin par session. Figure 4 montre une photo couleur, une image d’intensité et une image de perfusion de la gencive exploitée les jours représentatifs de notre étude. Au cours de la première fermeture de Rabat complet semaine postopératoire, une épaisse couche de fibrine concernant greffées et un léger érythème et œdème dans la gencive environnante étaient visibles. Images de perfusion de sang a montré une ischémie dans la région exploitée et hyperémie dans les régions « peri ». Du 14e, la zone greffée a été cliniquement érythémateuse, en parallèle avec une hyperémie grave observée sur des images de perfusion de sang. Le troisième mois après la constitution de la greffe, la plaie guérie et perfusion gingivale est proche des niveaux de circulation préopératoire.
La figure 5 illustre une image floue d’intensité et le graphe de perfusion de l’image entière. Le pic soudain sur le graphique indique le mouvement par le patient. La mesure a été répétée immédiatement, après avoir vérifié que le patient est dans une position confortable. Changements dans BF dans les différentes zones au sein de la prothèse et dans les régions « peri » sont indiqués à la Figure 6. Il est commun dans toutes les courbes que partir du quatrième mois, le débit sanguin ne change pas plus jusqu'à la fin de l’enquête. Le flux de sang moyenne pour cette période pourrait servir d’une valeur de débit sanguin au repos pour les nouveaux tissus et de la variation aléatoire entre points dans le temps nous a permis de calculer la composante temporelle de variance pour chaque ROI respectivement, à l’aide d’un modèle linéaire mixte. La différence minimale détectable pourrait être calculée puis d’identifier un changement réel (avec 95 % de confiance) entre des points dans le temps au cours de la période de cicatrisation (avant le quatrième mois) afin de déterminer la hyperémique et la phase ischémique. Les caractéristiques de base des courbes étaient similaires dans tous les ROIs au sein de la greffe, en commençant par une phase ischémique suivie d’une phase hyperémique. Toutefois, la durée de ces deux phases était différente (tableau 1). L’ischémie a été plus longs (7 à 9 jours) dans le central et dans toutes les zones coronales, avec hyperémie fin commence entre 11 et 27 jours. Dans d’autres zones de la prothèse, ischémie a duré seulement 4 à 7 jours et une hyperémie a commencé plus tôt, entre 7 et 21 jours.
Les courbes BF des zones sur les différentes côtés de la prothèse avaient des caractéristiques uniques (Figure 6). Du côté apical, tous les quatre zones avaient des courbes de débit sanguin similaires. Sur le côté coronal, perfusion a été retrouvée dans la zone extérieure au plus tard dans les zones intérieures, à l’encontre de la face mésiale et distale. Sur les deux côtés latérale, BF a augmenté tout d’abord dans la zone C, puis dans la zone D, suivie par la hausse BF en zone E et enfin dans la centrale la zone F. Dans les zones de la muqueuse environnante (zone A et B) aucune ischémie significative a été observée. Au lieu de cela, hyperémie d’une autre ampleur et l’étendue a été observée sur les côtés différentes.
Il y a deux points dans le temps lorsque la valeur BF ne concordance pas avec les caractéristiques générales de la courbe BF. Jour 9, il y avait une baisse soudaine dans la plupart des zones et principalement dans les zones « peri » du côté apical et distal. On ne peut affirmer avec certitude qu’il s’agissait d’une erreur de mesure, car aucune des mesures ont été prises sur le précédent et le jour suivant. Toutefois, selon une note dans le rapport de la mesure, le pli vestibulaire était rentré avec trop de pression par l’opérateur, ce qui entraîne une baisse de BF. C’est logique étant donné que principalement la circulation des parties distales et apicales pourrait ont été touchée en tirant sur la joue. Le jour 182 (6 mois plus tard), due à des intervalles plus longs entre temps, le patient a oublié de respecter les restrictions convenues avant la mesure. Le saignement de la gencive marginale sur la photographie couleur (Figure 6) indique de brossage des dents dures avant la mesure. Dans l’intervalle, le patient a subi un traitement orthodontique, trop, et il a utilisé des élastiques intermaxillaire. Ces deux facteurs pourraient augmenter considérablement BF14,15, si la mesure a été répétée à une date ultérieure dans une situation plus soigneusement contrôlée.

Figure 1 : préparation de configuration et patient LSCI expérimentale pour mesure de débit sanguin dans la zone opérée. Les lèvres sont rétractées par miroirs dentaires. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
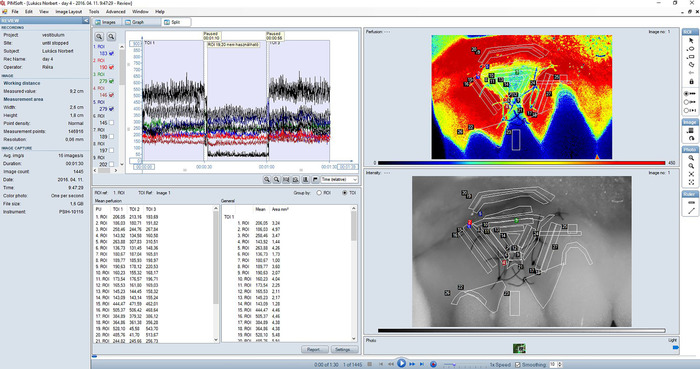
Figure 2 : fractionné (combinaison de l’affichage d’Images et la vue du graphique) d’un enregistrement typique du RBF gingivale dans la zone traitée. Image de perfusion (partie supérieure droite vue secondaire) est une représentation couleur de perfusion sanguine dans la gencive. Zones de perfusion élevé figurent en rouge tandis que les zones de faible perfusion sont en bleus. La gamme de couleurs des images de perfusion correspond à 0-450 Longshoremen ; lissage a été fixé à 10. Une image d’intensité (inférieure droite vue secondaire) est créée par la lumière laser rétrodiffusée total. Il correspond exactement à l’image de la perfusion et est utile pour l’orientation et de préciser les détails dans l’image de la perfusion. Régions d’intérêt (ROI) sont toujours définis dans l’image de l’intensité. Le graphique (panneau supérieur gauche) présente des traces de perfusion de sang en temps réel pour chaque ROI lors de l’enregistrement. Cases à cocher à gauche permet de sélectionner Quelles traces de montrer. Trois mesures consécutives sont affichés sur le graphique. Chaque 30 s tir a été identifiée comme un TOI. Un tableau de valeur moyenne affichant des valeurs de perfusion moyenne dans chaque ROI et TOI est également affiché en mode fractionné (panneau inférieur gauche). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : régions d’intérêt (ROI) défini dans la zone gingivale examinée dans l’image de l’intensité. Zone A et B sont dans la région de « peri », tandis que de la zone C, D et E sont dans le greffon à réduire la distance entre le centre de la prothèse, marqué comme zone F. Zone A se trouve sur la surface vestibulaire des lèvres. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : photographies représentatives (ligne supérieure), image d’intensité LSCI (ligne médiane) et image de perfusion LSCI (ligne inférieure) de la gencive exploitée. Les images représentent l’état préopératoire et la perfusion et enroulé de guérison et la perfusion 1, 4, 7, 14, 21, 27 et 98 jours après l’opération. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
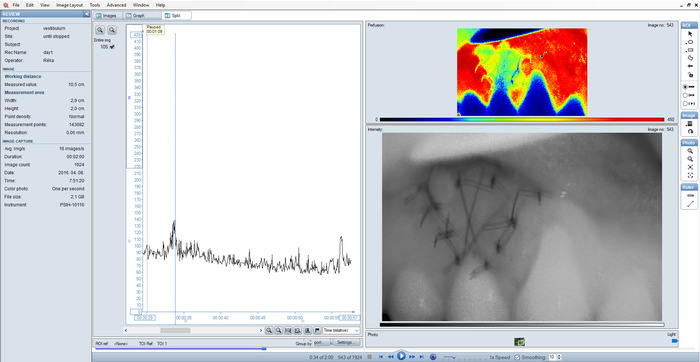
Figure 5 : fractionné d’un enregistrement sous-optimal. Image floue d’intensité et les pics sur le graphique à la suite de mauvais réglage. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : diagramme de dispersion du BF au fil du temps au coronal (a), mésiale (b), apical et distal (c) (d) côté du greffon. La partie centrale de la prothèse (zone F) était représentée dans tous les graphes à servir de référence pour les zones plus externes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Côté | Zone de | Fin de l’ischémie | Démarrer une hyperémie | Fin de l’hyperémie |
| coronale | c | 9 | 27 | 27 |
| coronale | d | 9 | 21 | 27 |
| coronale | e | 7 | 11 | 98 |
| central | f | 9 | 11 | 98 |
| mésiale | c | 5 | 21 | 27 |
| mésiale | d | 5 | 11 | 61 |
| mésiale | e | 7 | 11 | 61 |
| distale | c | 5 | 11 | 27 |
| distale | d | 4 | 7 | 98 |
| distale | e | 4 | 11 | 98 |
| apicale | c | 4 | 11 | 27 |
| apicale | d | 5 | 11 | 61 |
| apicale | e | 5 | 11 | 61 |
Tableau 1 : calendrier de la phase ischémique et hyperémique dans les diverses zones dans la prothèse, en jours
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Le but de cette étude était d’introduire une nouvelle technique pour la surveillance de la vascularisation d’un greffon dans la gencive humaine. Selon nos résultats antérieurs, LSCI évalue la perfusion sanguine de la gencive avec une bonne répétabilité et reproductibilité9, lors de l’application scrupuleuse de chaque étape du protocole prévu comme une exigence essentielle est satisfaite. LSCI est considéré comme une technique semi-quantitative nécessitant l’étalonnage périodiquement pour en assurer l’exactitude et la stabilité. Au cours de la vérification, la température de la pièce doit être mesurée aussi précisément que possible, parce que cette valeur est utilisée par l’algorithme de vérification pour calculer une perfusion.
La méthode LSCI est très sensible au paramètre de distance de travail et artefacts de mouvement aussi bien. Dans cette étude, la distance de travail a été fixée à 10 cm. La zone de mesure était de 2,7 cm x 2 cm, ce qui correspond à une zone large gingivale environ trois dents. La fréquence d’images réelle était 16 images/s et 0,06 s/image comme le pouls artériel induit des changements pulsatiles dans la microcirculation gingivale9, qui a de la valeur moyenne partir de l’enregistrement. Imagerie rapide réduit le risque d’artefacts de mouvement, trop. Toutefois, dans le cas des paramètres incorrects ou mouvements de patients, l’enregistrement doit être arrêté et répété dans des conditions optimales.
Deux opérateurs ont participé à chaque mesure : un ajusté la tête LSCI et contrôlé l’ordinateur tandis que l’autre rentré les lèvres du patient. Dans cette étude, trois répètent des mesures ont été effectuées à chaque séance, chacun prenant 30 s. Puisque les mesures impliquent toujours une sorte d’irritation pour les tissus mous en raison de la rétraction inévitable des lèvres et des joues, qui perturbe la microcirculation de la gencive, une augmentation de l’erreur aléatoire se produit. Une telle variation inter-jour, cependant, peut être minimisée en répétant le processus de toute mesure, c'est-à-dire, de ré-ouverture de la bouche, rétraction des tissus mous à nouveau, re-définissant la position de la caméra et en re-sélectionnant ROIs dans le logiciel9.
Microcirculation gingivale ont montré de fortes variations régionales8. Par conséquent, une méthode telle que LSCI qui mesure le débit sanguin dans une vaste zone a un grand avantage sur les techniques de mesure de point unique comme LDF. Dans cette étude, la zone de mesure couvert le champ entier chirurgical. La zone de mesure à l’échelle nous a permis de comparer re - ou néovascularisation dans diverses régions au sein de la zone blessée dans notre étude. Contrairement à LDF, où la sonde est fixée par les stents fabriqués avant la chirurgie, dans le cas de la méthode LSCI, il n’y a pas besoin de définir la zone à examiner à l’avance. Pour le premier objectif de la surveillance de la cicatrisation des plaies en médecine personnalisée consiste à reconnaître les tendances inattendus partout autour de la plaie ou du volet. En outre, changements postopératoires dans la géométrie des tissus et oedème provoqué par l’augmentation des tissus mous ou durs verserait les stents préfabriqués inutile après la chirurgie. Pour aider à l’évaluation visuelle, lissage a été allumé pendant l’enregistrement et le lissage a la valeur 10. Cela signifie que la perfusion a été en moyenne sur dix images pour une apparence plus lisse de l’image de la perfusion et afin de réduire le bruit de fond. Cependant, le lissage est seulement un effet visuel et n’influence pas les valeurs réelles de perfusion enregistré.
Le débit sanguin gingivale a une forte variation temporelle aussi bien. Cela peut être lié à plusieurs facteurs physiologiques qui accompagnent la vie quotidienne, telles que l’inflammation gingivale16,17,18, rythme circadien,19,20de la tension artérielle, température16 , 21, pression mécanique8,22,23,24, dents brossage14,17,25 ou force orthodontique15 . Par conséquent, la normalisation et la stabilisation de ces facteurs est obligatoire pour les mesures de suivi avec succès.
Les méthodes utilisées précédemment pour étudier la vascularisation du greffon sont très envahissantes, qui signifiait une restriction majeure sur la mesure des moments durant la cicatrisation, notamment dans les études chez l’homme26,27,28, 29,30,31,32. Ils ont aussi des limites en termes de mesurer quantitativement les différences régionales. Nos précédentes études9,10 ont déjà prouvé la grande fiabilité du LSCI dans les essais cliniques et il s’est avéré utile pour déterminer le temps de guérison de tissus mous d’un individu après une extraction dentaire afin d’optimiser l’implant placement33. Dans cette étude, la région de la plaie couverte par un greffon de collagène xénogène a montré excellente néovascularisation, comme le 11e jour postopératoire, toutes les zones au sein de la prothèse a atteint le niveau de débit sanguin maximal. Toutefois, on pourrait présumer que le greffon de collagène dépouillées ou a été résorbé par jour 11 et nous avons mesuré en réalité la revascularisation du destinataire lit. En plus de sa caractéristique non invasif, un autre attribut spécial du LSCI est une capacité à caractériser les courbes de reperfusion à diverses régions d’un greffon durant l’incorporation au niveau individuel. Les caractéristiques centripètes de la néovascularisation greffon ressemblent aux précédents histologie observations30. Ceci suggère que cette revascularisation de la greffe se produit non seulement des plexus vasculaire périostique mais aussi de la marge de la plaie.
L’expérience montre que la revascularisation d’un greffon peut être a présenté clairement suivi si chaque étape est strictement respectée. Cependant, le jour 182, instruction et la préparation du patient non conforme a entraîné une augmentation significative de BF.
LSCI est intensivement employé pour plein champ d’imagerie de structure vasculaire et associés du débit sanguin dans les autres tissus, comme dans la rétine34,35, la peau7,36 et le cerveau37,38 . Applications cliniques les plus prometteuses du LSCI sont graver plaie évaluation39,40, évaluation des volets41 et peropératoire sanguin cérébral flow surveillance42. Apparemment, il y a des mesures gingivales généralisées par LSCI chez des sujets humains de sérieuses limites. Cet outil est très robuste et lourd. Les principales difficultés se posent dans le cadre de la caméra de la documentation, qui a basse résolution et se trouve à quelques centimètres de l’appareil de mesure. Ces caractéristiques, il est difficile d’identifier des régions d’intérêt directement sur des photos en couleur. La taille de la tête de machine LSCI empêche la prise de vue à l’intérieur de la cavité buccale. Par conséquent, les zones qui ne sont pas directement visibles ne peuvent pas être mesurés. Plus tôt, nous avons démontré qu’en utilisant une approche indirecte avec un miroir photographique peut servir d’une méthode alternative de9. Cependant, en utilisant un miroir implique plusieurs artefacts de mouvement qui LSCI est sensible aux, rend plus difficile à capturer une image perpendiculaire et diminue la distance focale. Lorsque la zone mesurée ne peuvent pas être capturée perpendiculairement, la valeur du flux sanguin peut être correcte9,39, mais région identification sur l’image reste compliquée à cause de la torsion 3D.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Ce travail a été réalisée en partie par la prise en charge par le fonds de recherche scientifique hongrois sous Grant nombre K112364, par le ministère hongrois des capacités humaines, programme d’Excellence de l’enseignement supérieur à l’université Semmelweis, Module de recherche de thérapie et de la National de la recherche, développement et Innovation Office KFI_16-1-2017-0409.
Materials
| Name | Company | Catalog Number | Comments |
| PeriCam PSI-HR | Perimed AB, Stockholm, Sweden | The PeriCam PSI System is an imaging system based on LASCA technology (LAser Speckle Contrast Analysis). The system measures superficial blood perfusion over large areas at fast capture rates. This makes it ideal for investigations of both the spatial and temporal dynamics of microcirculation in almost any tissue. | |
| PIMSoft | Perimed AB, Stockholm, Sweden | PIMSoft is a data acquisition and analysis software, intended for use together with the PeriCam PSI System and the PeriScan PIM 3 System, for measurement and imaging of superficial blood perfusion. | |
| Geistlich Mucograft | Geistlich, Switzerland | It's a unique 3D collagne matrix designed specifically for soft tissue regeneration. It's indicated for the gain of keratinized tissue and recession coverage. | |
| Omron M4 | Omron Healthcare Inc., Kyoto, Japan | Blood pressure monitor, which gives accurate readings. | |
| Nikon D5200 | Nikon Corportation, Tokyo, Japan | Taking intra oral photos | |
| MS Excel | Microsoft Corporation, Redmond, Washington, USA | The software used for data management | |
| IBM SPSS Statistics 25 | IBM Corp., Armonk, NY, USA | The software used for statistical analysis |
References
- Nakamoto, T., et al. Two-Dimensional Real-Time Blood Flow and Temperature of Soft Tissue Around Maxillary Anterior Implants. Implant Dentistry. 21 (6), 522-527 (2012).
- Kajiwara, N., et al. Soft tissue biological response to zirconia and metal implant abutments compared with natural tooth: microcirculation monitoring as a novel bioindicator. Implant Dentistry. 24 (1), 37-41 (2015).
- Kemppainen, P., Forster, C., Handwerker, H. O. The importance of stimulus site and intensity in differences of pain-induced vascular reflexes in human orofacial regions. Pain. 91 (3), 331-338 (2001).
- Kemppainen, P., Avellan, N. L., Handwerker, H. O., Forster, C. Differences between tooth stimulation and capsaicin-induced neurogenic vasodilatation in human gingiva. Journal of Dental Research. 82 (4), 303-307 (2003).
- Riva, C., Ross, B., Benedek, G. B. Laser Doppler measurements of blood flow in capillary tubes and retinal arteries. Investigative ophthalmology. 11 (11), 936-944 (1972).
- Humeau, A., Steenbergen, W., Nilsson, H., Stromberg, T. Laser Doppler perfusion monitoring and imaging: novel approaches. Medical & Biological Engineering & Computing. 45 (5), 421-435 (2007).
- Briers, J. D., Webster, S. Laser speckle contrast analysis (LASCA): a nonscanning, full-field technique for monitoring capillary blood flow. Journal of Biomedical Optics. 1 (2), 174-179 (1996).
- Fazekas, R., et al. Functional characterization of collaterals in the human gingiva by laser speckle contrast imaging. Microcirculation. 25 (3), 12446 (2018).
- Molnar, E., Fazekas, R., Lohinai, Z., Toth, Z., Vag, J. Assessment of the test-retest reliability of human gingival blood flow measurements by Laser Speckle Contrast Imaging in a healthy cohort. Microcirculation. 25 (2), (2018).
- Molnar, E., et al. Evaluation of Laser Speckle Contrast Imaging for the Assessment of Oral Mucosal Blood Flow following Periodontal Plastic Surgery: An Exploratory Study. BioMed Research International. 2017, 4042902 (2017).
- Sanz, M., Lorenzo, R., Aranda, J. J., Martin, C., Orsini, M. Clinical evaluation of a new collagen matrix (Mucograft prototype) to enhance the width of keratinized tissue in patients with fixed prosthetic restorations: a randomized prospective clinical trial. Journal of Clinical Periodontology. 36 (10), 868-876 (2009).
- Nevins, M., Nevins, M. L., Kim, S. W., Schupbach, P., Kim, D. M. The use of mucograft collagen matrix to augment the zone of keratinized tissue around teeth: a pilot study. The International Journal of Periodontics and Restorative Dentistry. 31 (4), 367-373 (2011).
- Lorenzo, R., Garcia, V., Orsini, M., Martin, C., Sanz, M. Clinical efficacy of a xenogeneic collagen matrix in augmenting keratinized mucosa around implants: a randomized controlled prospective clinical trial. Clinical Oral Implants Research. 23 (3), 316-324 (2012).
- Perry, D. A., McDowell, J., Goodis, H. E. Gingival microcirculation response to tooth brushing measured by laser Doppler flowmetry. Journal of Periodontology. 68 (10), 990-995 (1997).
- Yamaguchi, K., Nanda, R. S., Kawata, T. Effect of orthodontic forces on blood flow in human gingiva. Angle Orthodontist. 61 (3), 193-203 (1991).
- Molnár, E., et al. Assessment of heat provocation tests on the human gingiva: the effect of periodontal disease and smoking. Acta Physiologica Hungarica. 102 (2), 176-188 (2015).
- Gleissner, C., Kempski, O., Peylo, S., Glatzel, J. H., Willershausen, B. Local gingival blood flow at healthy and inflamed sites measured by laser Doppler flowmetry. Journal of Periodontology. 77 (10), 1762-1771 (2006).
- Hinrichs, J. E., Jarzembinski, C., Hardie, N., Aeppli, D. Intrasulcular laser Doppler readings before and after root planing. Journal of Clinical Periodontology. 22 (11), 817-823 (1995).
- Svalestad, J., Hellem, S., Vaagbo, G., Irgens, A., Thorsen, E. Reproducibility of transcutaneous oximetry and laser Doppler flowmetry in facial skin and gingival tissue. Microvascular Research. 79 (1), 29-33 (2010).
- Sasano, T., Kuriwada, S., Sanjo, D. Arterial blood pressure regulation of pulpal blood flow as determined by laser Doppler. Journal of Dental Research. 68 (5), 791-795 (1989).
- Ikawa, M., Ikawa, K., Horiuchi, H. The effects of thermal and mechanical stimulation on blood flow in healthy and inflamed gingiva in man. Archives of Oral Biology. 43 (2), 127-132 (1998).
- Baab, D. A., Oberg, P. A., Holloway, G. A. Gingival blood flow measured with a laser Doppler flowmeter. Journal of Periodontal Research. 21 (1), 73-85 (1986).
- Fazekas, A., Csempesz, F., Csabai, Z., Vág, J. Effects of pre-soaked retraction cords on the microcirculation of the human gingival margin. Operative Dentistry. 27 (4), 343-348 (2002).
- Csillag, M., Nyiri, G., Vag, J., Fazekas, A. Dose-related effects of epinephrine on human gingival blood flow and crevicular fluid production used as a soaking solution for chemo-mechanical tissue retraction. Journal of Prosthetic Dentistry. 97 (1), 6-11 (2007).
- Tanaka, M., Hanioka, T., Kishimoto, M., Shizukuishi, S. Effect of mechanical toothbrush stimulation on gingival microcirculatory functions in inflamed gingiva of dogs. Journal of Clinical Periodontology. 25 (7), 561-565 (1998).
- Rothamel, D., et al. Biodegradation pattern and tissue integration of native and cross-linked porcine collagen soft tissue augmentation matrices - an experimental study in the rat. Head & Face Medicine. 10, 10 (2014).
- Schwarz, F., Rothamel, D., Herten, M., Sager, M., Becker, J. Angiogenesis pattern of native and cross-linked collagen membranes: an immunohistochemical study in the rat. Clinical Oral Implants Research. 17 (4), 403-409 (2006).
- Vergara, J. A., Quinones, C. R., Nasjleti, C. E., Caffesse, R. G. Vascular response to guided tissue regeneration procedures using nonresorbable and bioabsorbable membranes in dogs. Journal of Periodontology. 68 (3), 217-224 (1997).
- Oliver, R. C., Loe, H., Karring, T. Microscopic evaluation of the healing and revascularization of free gingival grafts. Journal of Periodontal Research. 3 (2), 84-95 (1968).
- Janson, W. A., Ruben, M. P., Kramer, G. M., Bloom, A. A., Turner, H. Development of the blood supply to split-thickness free ginival autografts. Journal of Periodontology. 40 (12), 707-716 (1969).
- Mormann, W., Bernimoulin, J. P., Schmid, M. O. Fluorescein angiography of free gingival autografts. Journal of Clinical Periodontology. 2 (4), 177-189 (1975).
- Busschop, J., de Boever, J., Schautteet, H. Revascularization of gingival autografts placed on different receptor beds. A fluoroangiographic study. Journal of Clinical Periodontology. 10 (3), 327-332 (1983).
- Fazekas, R., et al. A proposed method for assessing the appropriate timing of early implant placements: a case report. Journal of Oral Implantology. , (2018).
- Briers, J. D., Fercher, A. F. Retinal blood-flow visualization by means of laser speckle photography. Investigative Ophthalmology & Visual Science. 22 (2), 255-259 (1982).
- Srienc, A. I., Kurth-Nelson, Z. L., Newman, E. A. Imaging retinal blood flow with laser speckle flowmetry. Front Neuroenergetics. 2, (2010).
- Choi, B., Kang, N. M., Nelson, J. S. Laser speckle imaging for monitoring blood flow dynamics in the in vivo rodent dorsal skin fold model. Microvascular Research. 68 (2), 143-146 (2004).
- Ayata, C., et al. Laser speckle flowmetry for the study of cerebrovascular physiology in normal and ischemic mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 24 (7), 744-755 (2004).
- Armitage, G. A., Todd, K. G., Shuaib, A., Winship, I. R. Laser speckle contrast imaging of collateral blood flow during acute ischemic stroke. Journal of Cerebral Blood Flow & Metabolism. 30 (8), 1432-1436 (2010).
- Lindahl, F., Tesselaar, E., Sjoberg, F. Assessing paediatric scald injuries using Laser Speckle Contrast Imaging. Burns. 39 (4), 662-666 (2013).
- Mirdell, R., Iredahl, F., Sjoberg, F., Farnebo, S., Tesselaar, E. Microvascular blood flow in scalds in children and its relation to duration of wound healing: A study using laser speckle contrast imaging. Burns. , (2016).
- Zotterman, J., Bergkvist, M., Iredahl, F., Tesselaar, E., Farnebo, S. Monitoring of partial and full venous outflow obstruction in a porcine flap model using laser speckle contrast imaging. Journal of Plastic, Reconstructive & Aesthetic Surgery. 69 (7), 936-943 (2016).
- Hecht, N., Woitzik, J., Dreier, J. P., Vajkoczy, P. Intraoperative monitoring of cerebral blood flow by laser speckle contrast analysis. Neurosurgical Focus. 27 (4), E11 (2009).



