ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Deze methode beschrijft de zuivering door flowcytometrie van MEP en MKp van muizendijbenen, tibia's en bekkenbotten.
Abstract
Beenmerg megakaryocyten zijn grote polyploïde cellen die zorgen voor de productie van bloedplaatjes. Ze ontstaan uit hematopoëtische stamcellen door megakaryopoiese. De laatste stadia van dit proces zijn complex en omvatten klassiek de bipotente Megakaryocyte-Erythrocyte Progenitors (MEP) en de unipotente Megakaryocyte Progenitors (MKp). Deze populaties gaan vooraf aan de vorming van bonafide megakaryocyten en als zodanig zou hun isolatie en karakterisering de robuuste en onbevooroordeelde analyse van megakaryocytenvorming mogelijk kunnen maken. Dit protocol presenteert in detail de procedure om hematopoëtische cellen uit het beenmerg van muizen te verzamelen, de verrijking van hematopoëtische voorlopercellen door magnetische depletie en ten slotte een celsorteerstrategie die sterk gezuiverde MEP- en MKp-populaties oplevert. Eerst worden beenmergcellen verzameld uit het dijbeen, het scheenbeen en ook de iliacale kam, een bot dat een groot aantal hematopoëtische voorlopers bevat. Het gebruik van iliacale kambotten verhoogt het totale celaantal per muis drastisch en draagt zo bij aan een ethischer gebruik van dieren. Een magnetische afstammingsdepletie werd geoptimaliseerd met behulp van 450 nm magnetische kralen die een zeer efficiënte celsortering door flowcytometrie mogelijk maakten. Ten slotte presenteert het protocol de etiketterings- en gatingstrategie voor het sorteren van de twee sterk gezuiverde megakaryocytenvoorloperpopulaties: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim) en MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9bright ). Deze techniek is eenvoudig te implementeren en biedt voldoende cellulair materiaal om i) moleculaire karakterisering uit te voeren voor een diepere kennis van hun identiteit en biologie, ii) in vitro differentiatietests, die een beter begrip zullen geven van de mechanismen van rijping van megakaryocyten, of iii) in vitro modellen van interactie met hun micro-omgeving.
Introduction
Bloedplaatjes worden geproduceerd door megakaryocyten. Deze grote polyploïde cellen bevinden zich in het beenmerg en zoals voor alle bloedcellen zijn ze afgeleid van hematopoëtische stamcellen (HSC)1. De klassieke productieroute van megakaryocyten in het beenmerg is afkomstig van HSC en omvat de generatie van verschillende voorlopers die hun differentiatiepotentieel geleidelijk beperken2. De eerste stamvader die de verbintenis tot de megakaryocytische afstamming ondertekent, is de Megakaryocyte-Erythrocyte Progenitor (MEP), een bipotente voorloper die zowel erytroïde cellen als megakaryocyten kan produceren3,4,5. De MEP produceert vervolgens een unipotente voorloper /precursor (MKp) die zich zal differentiëren tot een volwassen megakaryocyt die in staat is om bloedplaatjes te produceren. De mechanismen die betrokken zijn bij het genereren van deze voorlopers, evenals hun differentiatie en rijping tot megakaryocyten zijn complex en slechts gedeeltelijk begrepen. Bovendien zijn de heterogeniteit van de MEP-populatie in termen van differentiatiepotentieel en het intrinsieke betrokkenheidsniveau van deze cellen nog steeds onduidelijk. Om deze processen te ontcijferen, is het essentieel om gezuiverde populaties van MEP en MKp te verkrijgen (of er toegang toe te hebben) voor fijne moleculaire en eencellige analyses.
Verschillende studies hebben specifieke combinaties van celoppervlakmarkers aangetoond voor de identificatie van voorlopers die zich inzetten voor de megakaryocytische afstamming in de muis6,7,8. Hieruit werd een methode bedacht waarmee MEP en MKp van muizen konden worden gezuiverd. Deze methode werd geoptimaliseerd om cellen in voldoende aantal en kwaliteit te verkrijgen voor een groot aantal testen. Met ethische overwegingen in gedachten, en om het aantal dieren dat betrokken is bij de experimenten te minimaliseren, hebben we uitgelokt om het beenmerg te oogsten van het dijbeen en het scheenbeen, en ook van de iliacale kam. Dit bot bevat een hoge frequentie en aantal hematopoëtische voorlopers en wordt meestal beschadigd tijdens lange botoogst. Hier gepresenteerd is een gedetailleerde methode voor de betrouwbare verzameling van dit bot.
Het tweede criterium van optimalisatie is het produceren van sterk gezuiverde celpopulaties. Fluorescent Activated Cell Sorting (FACS) is een methode bij uitstek om gezuiverde populaties van cellen van belang te verkrijgen. Lage opbrengsten worden echter bereikt wanneer de celpopulatie van belang zeer zeldzaam is. Verrijkingsprocedures zijn dus noodzakelijk. In dit protocol is gekozen voor een negatieve selectieprocedure met behulp van magnetische kralen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protocollen met betrekking tot dieren werden uitgevoerd in overeenstemming met het CREMEAS Committee on the Ethics of Animal Experiments van de Universiteit van Straatsburg (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg. Vergunningsnummer: E67-482-10).
1. Verzameling van muisbotten
- Offer het dier op in overeenstemming met de institutionele richtlijnen.
OPMERKING: De gegevens in dit manuscript zijn verkregen van C57Bl/6 muizen van 8 tot 12 weken oud. Het aantal verkregen cellen en de frequentie van de genoemde populaties kunnen variëren met leeftijd en muizenstam. - Spray het lichaam met 70% ethanol.
- Maak met een schaar een incisie van 0,5-1 cm van de huid loodrecht op de wervelkolom en scheur de huid rond het hele lichaam. Trek de huid van het onderlichaam naar beneden en verwijder de huid.
- Plaats het dier op het dissectiekussen, met de voorkant naar beneden. Lokaliseer de bekkenbotten door je vingers langs de blootgestelde wervelkolom van boven naar beneden te laten glijden. Om de iliacale top te lokaliseren, identificeert u de kleine bult in het lumbale gebied in de buurt van de achterpoten (het anterosuperiorgebied van het bekkenbot). Figuur 1A(B) geeft een schematische weergave van de anatomie van de muis.

Figuur 1: Muisanatomie. (A) Röntgenfoto van muizen met de achterpoten. Let op de ruimte tussen het bekkenbot en de wervelkolom (gele pijl), waar de schaar moet worden ingebracht om de achterpoten goed te scheiden van het lichaam van de muis (gele stippellijn). (B) Schematische weergave van de beenmergrijke botten van belang. De bekkenbeenderen zijn afgebeeld in rood, de dijbenen in paars en de tibia's in groen. (C) Schematische weergave van het bekkenbot van de muis. Het darmbeen komt overeen met het mergrijke deel van het bekkenbot en is rood gemarkeerd. Klik hier om een grotere versie van deze figuur te bekijken.
- Plaats de schaar evenwijdig aan de wervelkolom tegen de wervels en dicht bij de iliacale kuifbult. Ga verder met het snijden van de spieren langs de zijkant van de wervelkolom boven het bekkenbot door de schaar langs de wervels helemaal naar beneden naar de staart te schuiven.
OPMERKING: Dit eerste deel van de spieren kan ook worden uitgevoerd met behulp van een scalpelmes. - Plaats de schaar evenwijdig aan de wervelkolom en ga verder met knippen tussen de wervels en de iliacale top, zoals aangegeven door de gele stippellijn op figuur 1A. Zorg ervoor dat je zo dicht mogelijk bij de wervels blijft. Snijd de resterende spieren om de ledemaat los te maken van het lichaam.
OPMERKING: Er zou weinig tot geen weerstand moeten zijn. - Herhaal dit aan de andere kant om het tweede ledemaat los te maken.
- Breng de ledematen over op een schoon oppervlak en gooi de rest van het lichaam weg in overeenstemming met de institutionele richtlijnen.
- Stel de bekken-, femur- en tibiale botten bloot door zoveel mogelijk omringend weefsel te verwijderen met de tang en de scalpels.
- Ga verder met het voorzichtig ontwrichten van de heupkop van het bekkenbot door het distale uiteinde van het dijbeen met de tang vast te houden terwijl je de spieren rond de articulatie voorzichtig doorsnijd met de scalpels snijdt. Wiebel de botten om de dislocatie te vergemakkelijken.
- Schraap de resterende spier van het bekkenbot af en snijd met een scalpel in het midden van de holte die wel de dijbeenkop vasthield. Het darmbeen wordt bewaard omdat het rijk is aan hematopoëtische voorlopercellen, terwijl de driehoekige zeer dunne kant van het bot wordt weggegooid, zoals weergegeven in figuur 1C.
- Verwijder de resterende weefsels rond het darmbeen met het scalpel en plaats het gereinigde bot in steriel PBS aangevuld met 2% Newborn Calf Serum (PBS-2% NBCS).
- Knip met een schaar de voet af van het been bij de enkel.
- Houd het onderste deel van het scheenbeen vast met de tang en schraap de spier omhoog naar de knie. Gooi de kuitbeen weg en snijd met het scalpel over het tibiale plateau. Plaats het scheenbeen in steriele PBS-2%NBCS.
- Verwijder de resterende weefsels rond het dijbeen met scalpels.
- Houd de bovenzijde van het dijbeen vast met een tang; plaats het scalpelmesje aan de basis van de knieschijf. Oefen een kracht uit op de knieschijf parallel aan het dijbeen tot het losmaken van de knieschijf. Plaats het dijbeen in steriele PBS-2%NBCS. Verwijdering van de knieschijf biedt een schone toegang voor het inbrengen van de naald voor mergspoeling.
2. Magnetische uitputting van afstammingspositieve cellen
- Breng in een laminaire flowkast de botten over in een steriel petrischaaltje gevuld met steriele PBS-2%NBCS.
- Snijd met een scalpel de kop van de dijbenen af.
- Vul een spuit van 1 ml met steriele PBS-2% NBCS en bevestig een naald van 21 G aan de uitlaat.
- Vul een polypropyleen buis van 5 ml met 2 ml steriele PBS-2% NBCS.
- Houd het dijbeen vast met de tang; steek de naald voorzichtig in de groef die overblijft na het verwijderen van de knieschijf. Breng rotatie aan op de naald tijdens het inbrengen om te voorkomen dat de naald verstopt. Zorg ervoor dat de naald volledig in het bot is ingebracht tot aan de schuine kant.
- Breng het bot met de naald over in de buis met 2 ml PBS-2% NBCS. Dispenseer en aspirateer de PBS-2%NBCS uit de spuit totdat het bot helder is.
- Verwijder de naald uit het dijbeen en steek deze in het gat aan de andere kant waar de dijbeenkop zat. Verwijder en aspirateer de buffer opnieuw en gooi het bot weg.
- Voor de iliacale kam en het scheenbeen, houd het bot met de tang; steek de naald voorzichtig in de open zijde. Breng rotatie aan op de naald tijdens het inbrengen om te voorkomen dat de naald verstopt. Zorg ervoor dat de naald volledig in het bot is ingebracht tot aan de schuine kant. Breng het bot met de naald over in de buis met 2 ml PBS-2% NBCS. Dispenseer en aspirateer de PBS-2%NBCS uit de spuit totdat het bot helder is. Gooi de botten weg.
OPMERKING: Botten van maximaal drie muizen kunnen in dezelfde buis worden gespoeld. Pool de cel suspensies. - Passeer de gepoolde celsuspensie door een celzeefdop van 40 μm die op een steriele polystyreenbuis van 5 ml wordt geplaatst.
- Ga verder met het tellen van de cellen.
OPMERKING: Het aantal cellen kan worden uitgevoerd met elke hemocytometer, met behulp van Trypan Blue voor de beoordeling van de levensvatbaarheid of met een geautomatiseerde celteller. Eén muis levert meestal 105 ± 7 x 106 cellen. - Neem 100 μL van de celsuspensie apart als totaal beenmerg, voeg 500 μL PBS-2% NBCS toe en bewaar het op ijs voor de kleuringsprocedure.
- Pellet de gefilterde suspensie door centrifugeren bij 400 x g gedurende 5 minuten bij 4 °C en gooi het supernatant weg.
OPMERKING: Rode bloedcellen kunnen worden gelyseerd door de pellet opnieuw te suspenderen in vers bereide Lysis-oplossing (1/10e in dH2O). Incubeer gedurende 5 minuten totdat de suspensie helder en helderrood wordt en voeg 10 volumes steriel PBS toe. Ga verder met het wassen van de cellen in PBS-2%NBCS door centrifugeren op 400 x g gedurende 5 minuten bij 4 °C. Wees voorzichtig bij het verwijderen van het supernatant, omdat de celkorrel erg los zit. Voer een tweede wasbeurt uit met PBS-2%NBCS door centrifugering bij 400 x g gedurende 5 minuten bij 4 °C en ga verder met stap 2.13. - Resuspend de celkorrel in vers bereide primaire antilichaamcocktail met een verhouding van 100 μL per 1 x 107 cellen. Incubeer op ijs gedurende 30-45 min.
| Antistof | Verdunning |
| Gr-1-biotine | 1:500 |
| B220-biotine | 1:500 |
| Mac-1-biotine | 1:500 |
| CD3-biotine | 1:500 |
| CD4-biotine | 1:500 |
| CD5-biotine | 1:500 |
| CD8-biotine | 1:500 |
| TER119-biotine | 1:1000 |
| CD127-biotine | 1:500 |
Tabel 1.
- Neem 10 μL van de celsuspensie apart in een steriele 5 ml polystyreenbuis met het label Lin-Pos Fraction. Voeg 90 μL PBS-2%NBCS toe en bewaar het op ijs voor de kleuringsprocedure.
- Ga verder met het tweemaal wassen van de cellen met steriele PBS-2%NBCS door centrifugeren bij 400 x g gedurende 5 minuten bij 4 °C. Zorg ervoor dat u de laatste was doet in een steriele polypropyleen buis van 5 ml.
- Bereid tijdens de wasstappen de kralen voor op de magnetische uitputting.
- Resuspend de kralen in de injectieflacon door grondig te vortexen gedurende 30 s.
- Breng een volume kralen dat overeenkomt met twee kralen per doelcel over in een polypropyleenbuis van 5 ml.
- Was de kralen tweemaal met PBS-2%NBCS door de buis op de magneet te plaatsen en de wasbuffer te verwijderen met een steriel glazen Pasteur pipet.
- Resuspend de kralen in 500 μL steriel PBS-2NBCS%.
- Resuspend de pellet van gelabelde cellen in 250 μL kralen en meng voorzichtig gedurende 5 minuten op ijs. Voeg 2 ml steriele PBS-2%NBCS toe en meng voorzichtig. Schud de tube niet.
- Plaats de buis gedurende 2 minuten op de magneet.
- Ga verder met het verzamelen van de niet-magnetische fractie met een steriel glazen Pasteur pipet en voeg deze toe aan de resterende 250 μL magnetische kralen. Sluit de buis af met parafilm.
- Plaats de buis gedurende 20 minuten op een buisrol bij 4 °C.
- Voeg 2 ml steriele PBS-2%NBCS toe en meng voorzichtig. Schud de tube niet.
- Plaats de buis gedurende 2 minuten in de magneet.
- Ga verder met het verzamelen van de niet-magnetische fractie in een steriele 5 ml polypropyleenbuis met het label Lin-Neg Fraction met een steriele glazen Pasteur pipet.
- Pellet de cellen door centrifugering bij 400 x g gedurende 5 minuten bij 4 °C en verwijder het supernatant.
- Resuspend de niet-magnetische cellen in 500 μL steriel PBS-2%NBCS.
- Ga verder met het tellen van de cellen.
OPMERKING: Eén muis levert meestal 3,9 ± 1,1 x 106 cellen. Typische afstammingskleuring voor en na de uitputting zijn weergegeven in figuur 2B.
3. Celsortering van megakaryocytenvoorlopers door flowcytometrie
- Neem de buizen met het label Total Bone Marrow, Lin-Pos Fraction en Lin-Neg Fraction.
- Ga verder met het splitsen van de inhoud van de buis Total Bone Marrow gelijkelijk in zes steriele 5 ml polystyreenbuizen. Label de buizen met de nummers 1-6.
- Ga verder met het labelen van de buis Lin-Pos Fraction met het nummer 7.
- Ga verder met het splitsen van de inhoud van de buis Lin-Neg Fraction als volgt.
- Breng 50 μL over in een steriele polystyreenbuis van 5 ml met 250 μL steriele PBS-2%NBCS. Splits vervolgens de inhoud gelijkelijk in 3 steriele 5 ml polystyreenbuizen. Label deze buizen met de nummers 8-10.
- De resterende 450 μL lin-neg fractie celsuspensie komt overeen met de buis met het getal 11.
- Voeg de antilichamen toe aan de buisjes zoals beschreven in tabel 2.
| Buis | Etiket | Antilichaam cocktail |
| Totaal beenmerg | ||
| 1 | Onbevlekte controle | |
| 2 | Enkele bevlekte bediening | CD45-FITC (1/200) |
| 3 | Enkele bevlekte bediening | CD45-PE (1/200) |
| 4 | Enkele bevlekte bediening | TER119-APC (1/200) |
| 5 | Enkele bevlekte bediening | CD45-PECy7 (1/200) |
| 6 | Enkele bevlekte bediening | CD45-APC-Cy7 biotine (1/200) |
| Lin-Pos Fractie | ||
| 7 | Enkele bevlekte bediening | Enkele bevlekte controle. Streptavidin-APC-Cy7 (1/500) |
| Lin-Neg Fractie | ||
| 8 | FMO FITC-besturing | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | FMO PE-regeling | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | FMO PECy7-besturing | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Positieve buis voor het sorteren | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tabel 2.
- Incubeer op ijs gedurende 30-45 minuten in het donker.
- Was de cellen met steriele PBS-2%NBCS door centrifugeren op 400 x g gedurende 5 minuten bij 4 °C.
- Resuspend de celkorrels als volgt.
- Resuspend voor de buizen 1 tot en met 10 de pellet in 300 μL steriele PBS-2%NBCS aangevuld met 7AAD (2,5 μg/ml finale) (PBS-7AAD).
LET OP: 7AAD is een DNA-intercalant en moet daarom met de juiste PBM (handschoenen) worden behandeld. - Voor buis 11, resuspend de pellet in steriel PBS-7AAD in een maximale concentratie van 5 x 106 cellen per ml en een minimumvolume van 1 ml.
- Resuspend voor de buizen 1 tot en met 10 de pellet in 300 μL steriele PBS-2%NBCS aangevuld met 7AAD (2,5 μg/ml finale) (PBS-7AAD).
- Bereid twee polypropyleen verzamelbuizen met het label MEP en MKp met 2 ml PBS-2% NBCS.
OPMERKING: Als alternatief kunnen cellen worden verzameld in kweekmedium of cellysisbuffer, afhankelijk van de daaropvolgende toepassing voor de gesorteerde cellen. Het gebruik van polystyreenbuizen wordt niet aanbevolen vanwege mogelijke interferentie met de geladen druppels die de cellen van belang bevatten. - Bewaar alle buizen op ijs in het donker.
- Ga verder met de celsorteerder instellen.
- Gebruik de buizen 1-7 om spanning en compensatie in te stellen, buizen 7-10 om de sorteerpoorten voor de celpopulaties van belang te bepalen en buis 11 voor celsortering.
- De eerste stappen van de gatingstrategie zijn gericht op het uitsluiten van doubletten en dode cellen van de analyse, zoals beschreven in figuur 3. Identificeer enkele levensvatbare cellen en geef SSC-vs Lin-APC-Cy7 dot plot weer om de efficiëntie van de uitputting van de afstamming te bevestigen. Vanuit de Lin- cellen is een poort ingesteld om cellen te selecteren die positief zijn voor c-kit en negatief of dim voor Sca-1 en CD16/32. Een CD9 vs CD150 expressie dot plot voor de geselecteerde cellen maakt de identificatie van vier populaties mogelijk.
OPMERKING: MEP- en MKp-cellen zijn beide positief voor CD150. Er kunnen drie expressieniveaus voor CD9 worden gedefinieerd (neg, dim en high). MKp drukt een hoog niveau van CD9 uit en MEP drukt CD9 uit bij een intermediair fluorescentie-intensiteitsniveau. MEP-populatie komt overeen met Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim en MKp-populatie komt overeen met Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9helder. De discriminatie tussen CD9 hoge en CD9 dim populaties voor de CD150 positieve cellen wordt ingesteld op basis van het maximale niveau van CD9 expressie in de CD150 negatieve populatie. Eén muis levert doorgaans 5,3 ± 0,6 x 103 MKp en 27,2 ± 2,4 x 103 MEP.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Fenotypische analyse van de cellen geïdentificeerd als MEP en MKp werden uitgevoerd door middel van flowcytometrie. Cellen werden gelabeld met fluorescentie geconjugeerde antilichamen tegen CD41a en CD42c, klassieke markers van de megakaryocytische en bloedplaatjeslijn. Beide markers werden uitgedrukt door de cellen van de MKp-populatie, terwijl deze markers nog niet worden gedetecteerd aan het oppervlak van de cellen van de MEP-populatie (Figuur 4Ai, 4Aii). Polyploïdie is een kenmerk van megakaryocyten. Het DNA-gehalte van de gesorteerde populaties werd ook geanalyseerd en aangetoond dat de cellen meestal 2N zijn voor de MEP-populatie en een klein deel van de MKp-cellen 4N, maar hogere ploïdie wordt niet significant gedetecteerd in deze populaties (Figuur 4Aiii).
Om de identiteit van de gesorteerde celpopulaties te bevestigen, werden verschillende differentiatietests uitgevoerd om hun vermogen om te differentiëren naar de megakaryocytische en erytroïde afstammingslijn te evalueren. Eerst werden semi-solide clonogene assays uitgevoerd om megakaryocytische voorloper (CFU-MK) en erytroïde voorlopers (BFU-E) te kwantificeren. CFU-MK werden gedetecteerd in zowel MEP- als MKp-populaties, maar niet in de andere geteste populatie(figuur 4B). BFU-E werden niet gedetecteerd in de MKp-populatie, maar werden gedetecteerd in de MEP-populatie en de CD150-CD9dimcell-populatie (figuur 4C).
De differentiatie van de gesorteerde cellen werd ook gevolgd in vloeibare cultuur in aanwezigheid van een lage concentratie hematopoëtische cytokines. Representatieve beelden van microscopische observatie op de3e dag van differentiatie laten zien dat MEP en MKp voornamelijk megakaryocyten produceerden die worden geïdentificeerd als grote cellen (Figuur 5Aiii, 5Aiv). Megakaryocyten werden geïdentificeerd met behulp van CD41- en CD42c-expressie en vertegenwoordigen respectievelijk 53,9 ± 10,4% en 82,0 ± 2,0% van de cellen geproduceerd uit MEP- en MKp-celpopulaties (figuur 5B). Merkbaar was de ploïdie van de geproduceerde megakaryocyten geanalyseerd met behulp van DNA-marker Hoescht 33242, groter voor de megakaryocyt afgeleid van MKp-populatie in vergelijking met de MEP-populatie die een meer volwassen toestand suggereert (Figuur 5C). Ten slotte werden de cellen die op de3e dag uit elke populatie werden geproduceerd, onderworpen aan een proplateletvormingstest9. Er werd waargenomen dat alleen de cellen afgeleid van de MKp-populatie in staat waren tot proplateletemissie in deze toestand (figuur 5D). Dit suggereert een meer gevorderd rijpingsstadium voor de MKp-populatie. Bovendien, wanneer de kweekduur wordt verlengd tot 4-5 dagen, zullen megakaryocyten gegenereerd door MEP ook proplatelets verlengen.

Figuur 2: Magnetische depletie van afstammings-(Lin)-cellen. (A) Schematische weergave van het magnetische depletieprotocol. Eerst worden ongesorteerde beenmergcellen gelabeld met de biotine-geconjugeerde antimuisantilichaamcocktail van ratten. Cellen worden vervolgens geïncubeerd met anti-rat Ig gecoate magnetische kralen en vervolgens onderworpen aan de magnetische uitputting met behulp van een sterke magneet. De magneet houdt de gelabelde magnetische Lin+ fractie tegen de buiswanden, terwijl de ongelabelde niet-magnetische Lin-negatieve fractie wordt opgevangen in een nieuwe buis. (B) Afstammingscellen kunnen worden geïdentificeerd met behulp van fluorescerend geconjugeerd streptavidin. Typische analyse van de afstammingsexpressie in cellen voorafgaand aan magnetische depletie (totaal beenmerg) en na magnetische depletie (Lin-Fractie) N = 21. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 3: Celsorteerstrategie. (A) Selectie van de gebeurtenissen die overeenkomen met levensvatbare afzonderlijke cellen. (B) Epp en MKp bevolkingsselectie. (i) De Lin Neg-populatie wordt geselecteerd uit de levensvatbare eencellige gebeurtenissen. (ii) Voorlopers die c-kit tot expressie brengen en met een lage tot geen expressie van Sca-1- of CD16/32-antigeen worden vervolgens geselecteerd. (iii) CD9- en CD150-expressieniveaus definiëren vier celpopulaties. MKp worden gedefinieerd als CD9heldereCD150+ cellen, MEP worden gedefinieerd als CD9dimCD150+. De hogere limiet voor de CD9-expressie voor de CD9dimCD150+ populatie is gebaseerd op het maximale CD9-expressieniveau voor de CD150- cellen. Voor analysedoeleinden werden ook CD9dimCD150- cellen (Voorlopercellen) en CD9-CD150- (Dubbel Negatief: DN) gesorteerd. (C) Celsorteerpoorten zijn gebaseerd op Fluorescentie Minus One (FMO) controles. (i) FMO-besturing voor CD9-poorten (ii) FMO-besturing voor CD150-poorten. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 4: Karakterisering van de MEP- en MKp-celpopulaties. (A) Flowcytometrieanalyse van (i) CD41-expressie, (ii) CD42c-expressie en (iii) DNA-gehalte (Hoechst33342) in de CD9+CD150dim (MEP) en CD9+CD150heldere (MKp) celpopulaties. B) Kwantificering van KVE-MK van de gesorteerde celpopulaties. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) en CD9+CD150heldere (MKp) celpopulaties werden gesorteerd en verguld in collageengel volgens de instructies van de fabrikant. (C) Kwantificering van BFU-E uit de gesorteerde celpopulaties. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) en CD9+CD150heldere (MKp) celpopulaties werden gesorteerd en verguld in methylcellulosegel volgens de instructies van de fabrikant. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 5: Differentiatiepotentieel van MEP en MKp. CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) en CD9+CD150heldere(MKp) celpopulaties werden gedurende drie dagen gekweekt in StemSpan medium aangevuld met SCF (7,5 ng /ml), Flt-3 (5 ng / ml), IL-6 (1 ng / ml) en TPO (10 ng / ml). (A) Representatieve beelden werden gemaakt door middel van fasecontrastmicroscopie. (B)Het percentage CD41+CD42c+ megakaryocyten werd vervolgens beoordeeld door middel van flowcytometrie. N = 3. (C)Het ploïdieniveau van de CD41+CD42c+ megakaryocyten werd vervolgens geëvalueerd met Hoechst door middel van flowcytometrie. N = 3. (D) Cellen geproduceerd op dag 3 van CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) en CD9+CD150heldere(MKp) celpopulaties werden geoogst en gekweekt in DMEM-medium aangevuld met 50 ng / ml TPO, 10 % foetaal kalfsserum en 100 U / ml hirudin. i)Het aandeel van proplaatjesvormende megakaryocyten in de kweek werd bepaald door microscopische waarneming. Megakaryocyten werden geïdentificeerd op basis van hun grootte en/of de aanwezigheid van proplatelets. N = 2. ii)Representatieve foto van een proplatelet met megakaryocyt door middel van fasecontrastmicroscopie. Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De methode die in dit artikel wordt beschreven, maakt de extractie en zuivering van muis MEP en MKp mogelijk. Een belangrijke parameter in de optimalisatie van het protocol was het verkrijgen van voldoende cellen die compatibel zouden zijn met de meeste moleculaire en cellulaire assays. De algemene praktijk van het verzamelen van muizenbotten voor hematopoëtische celextractie bestaat meestal uit het oogsten van zowel de dijbenen als de tibia's van elke muis. Het bekkenbot, een andere bron van hematopoëtisch materiaal, wordt dus vaak over het hoofd gezien. De redenen om de iliacale kam niet te verzamelen, is de slechte kennis van de interne anatomie van het muizenskelet en het feit dat gebruikers klassiek achterpoten verzamelen door over of net boven de dijbeenkop te snijden. Bovendien wordt vaak aangenomen dat de mergcellen niet efficiënt uit het iliacale kambot zouden worden gespoeld vanwege de aanwezigheid van trabeculae, die afwezig zijn in het centrale deel van het scheenbeen en het dijbeen. In dit protocol worden deze twee zorgen aangepakt en wordt een gestandaardiseerde, betrouwbare en tijdseffectief methode gepresenteerd die een goede spoeling van elke achterpootbotten, inclusief het bekkenbot, mogelijk maakt. Met name het gebruik van het iliacale bot levert 105 ± 7 x 106 cellen per muis op, terwijl de klassieke methode meestal 42 ± 5 x 106 cellen oplevert. Een groot voordeel van deze methode is de vermindering van het aantal dieren dat nodig is om een bepaald aantal doelcellen te verkrijgen, waardoor meer ethische en kosteneffectieve experimentele omstandigheden worden geboden. Deze procedure is daarom ook van toepassing op elk onderzoek dat beenmergcelsuspensie vereist, zoals isolatie van hematopoëtische stamcellen10 of de analyse van hematopoëtisch voorlopergedrag in halfvaste omstandigheden11.
Celsortering met behulp van flowcytometrie is een krachtige techniek met een groot voordeel op het gebied van zuiverheid in vergelijking met magnetische verrijkingstechnieken, maar de opbrengst van celsortering voor zeldzame populaties kan lager zijn dan voor meer overvloedige populaties. Magnetische uitputting van ongewenste cellen vooraf is daarom een nuttige methode om de frequentie van de cellen van belang te verhogen. Hier verschilt de magnetische depletieprocedure van de aanbeveling van de fabrikant en houdt rekening met de heterogeniteit in de expressie van de oppervlaktemarkers die worden gebruikt om de ongewenste afstammingspositieve cellen te verwijderen. Met de typische, eenstapsprotocollen zullen afstammingspositieve cellen met de hoogste expressie van oppervlaktemarkers de magnetische kralen snel verzadigen. Ze zullen de daaropvolgende vangst van de resterende gelabelde cellen door concurrentie en sterische belemmering voorkomen, waardoor de uitputtingseffectiviteit aanzienlijk wordt verminderd. Om dit probleem aan te pakken, werd een magnetische depletie in twee stappen ontworpen die de sequentiële verwijdering van alle afstammingspositieve cellen mogelijk maakt, waardoor strenge depleties mogelijk zijn die geschikt zijn voor celsortering.
Een andere kritische parameter om een efficiënte uitputting te bereiken, zijn de juiste etiketteringsomstandigheden van de ongewenste afstammingspositieve cellen. De antilichaamtitratie is daarom specifiek geoptimaliseerd. Het gebruik van hogere concentraties antilichamen zal resulteren in overmatige rosetting van de magnetische kralen en de niet-specifieke uitputting van afstammingsnegatieve cellen van belang. Het gebruik van sterk gezuiverde MEP- en MKp-celpopulaties is een belangrijk hulpmiddel bij de studie van megakaryopoiese. Om de mechanismen die dit proces beheersen op te helderen, onderzocht de studie de rol van de cellulaire micro-omgeving en hebben aangetoond dat een foetale levercelstromale celpopulatie de differentiatie van MKp10zou ondersteunen . De gesorteerde populatie kan ook worden gebruikt voor moleculaire of eencellige analyses. Dit zal met name relevant zijn gezien het opkomende idee van megakaryocyt-biased HSC12,13,14. De productie van megakaryocyten rechtstreeks uit de HSC-populatie zonder de generatie van een bipotente voorloper zou een noodroute zijn als reactie op stress13.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
De auteurs verklaren geen tegenstrijdige financiële belangen te hebben.
Acknowledgments
De auteurs willen Monique Freund, Catherine Ziessel en Ketty bedanken voor de technische ondersteuning. Dit werk werd ondersteund door ARMESA (Association de Recherche et Développement en Médecine et Santé Publique), en door Grant ANR-17-CE14-0001-01 to Henri.de la. Salle.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
Biologie Nummer 171Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
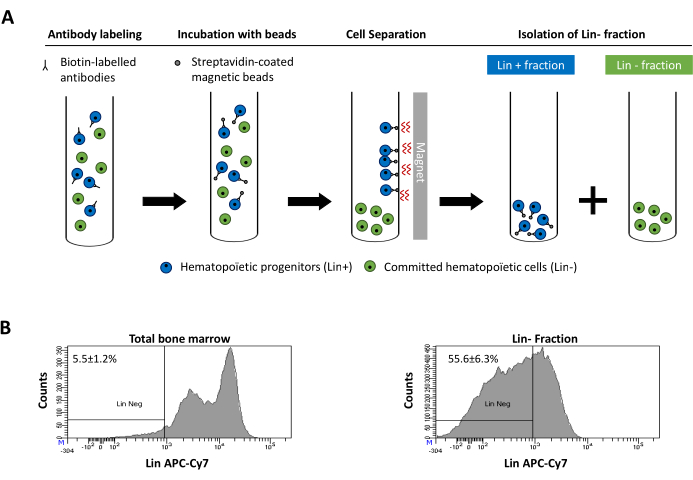
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
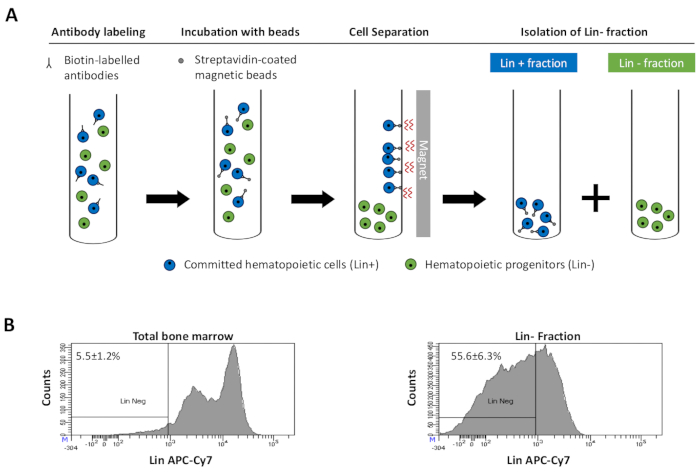
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



