ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
该方法描述了通过流式细胞术从小鼠股骨,胫骨和盆骨中纯化MEP和MKp。
Abstract
骨髓巨核细胞是确保血小板产生的大多倍体细胞。它们通过巨核生成从造血干细胞中产生。该过程的最后阶段很复杂,通常涉及双能巨核细胞 - 红细胞祖细胞(MEP)和单能巨核细胞祖细胞(MKp)。这些群体先于 真正的 巨核细胞的形成,因此,它们的分离和表征可以允许对巨核细胞的形成进行稳健和公正的分析。该协议详细介绍了从小鼠骨髓收集造血细胞的程序,通过磁消耗富集造血祖细胞,最后是产生高度纯化的MEP和MKp群体的细胞分选策略。首先,骨髓细胞从股骨,胫骨和髂嵴收集,髂嵴是含有大量造血祖细胞的骨骼。髂骨的使用大大增加了每只小鼠获得的总细胞数,从而有助于更合乎道德地使用动物。使用450 nm磁珠优化了磁谱系耗尽,允许通过流式细胞术进行非常有效的细胞分选。最后,该协议提出了两种高度纯化的巨核细胞祖细胞群体分类的标记和门控策略:MEP(Lin-Sca-1-c-Kit+CD16 / 32-CD150+CD9dim)和MKp(Lin- Sca-1-c-Kit+CD16 / 32-CD150+CD9明亮)).该技术易于实施,并提供足够的细胞材料来执行i)分子表征以更深入地了解其身份和生物学,ii) 体外 分化测定,这将更好地理解巨核细胞成熟的机制,或iii)与微环境相互作用的 体外 模型。
Introduction
血小板由巨核细胞产生。这些大的多倍体细胞位于骨髓中,对于所有血细胞,它们都来自造血干细胞(HSC)1。骨髓中巨核细胞产生的经典途径起源于HSC,涉及不同祖细胞的产生,这些祖细胞逐渐限制了它们的分化潜力2。签署对巨核细胞谱系承诺的第一个祖是巨核细胞 - 红细胞祖细胞(MEP),这是一种能够同时产生红细胞和巨核细胞3,4,5的双能祖。然后,MEP产生一个单能祖细胞/前体(MKp),它将分化成能够产生血小板的成熟巨核细胞。这些祖细胞的产生所涉及的机制,以及它们分化和成熟为巨核细胞是复杂的,只能部分理解。此外,MEP群体在分化潜力方面的异质性和这些细胞的内在承诺水平尚不清楚。为了破译这些过程,必须获得(或能够获得)纯化的MEP和MKp群体,以进行精细分子和单细胞分析。
一些研究表明,细胞表面标记物的特殊组合用于鉴定小鼠6,7,8中致力于巨核细胞谱系的祖细胞。从这些中设计出一种方法,允许从小鼠中纯化MEP和MKp。该方法经过优化,可获得足够数量和质量的细胞,以进行大量测定。考虑到伦理因素,为了尽量减少参与实验的动物数量,我们从股骨和胫骨以及髂嵴中收获骨髓。这种骨含有高频率和数量的造血祖细胞,并且在长骨收获过程中大部分时间都受损。这里介绍的是可靠收集该骨骼的详细方法。
优化的第二个标准是产生高度纯化的细胞群。荧光活化细胞分选(FACS)是获得纯化目标细胞群的首选方法。然而,当感兴趣的细胞群非常罕见时,就会达到低产量。因此,浓缩程序是必要的。在该协议中,使用磁珠选择负选择程序。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
涉及动物的协议是根据斯特拉斯堡大学动物实验伦理学CREMEAS委员会(斯特拉斯堡动物研究区教育委员会)进行的。许可证编号:E67-482-10)。
1. 小鼠骨骼采集
- 按照机构准则牺牲动物。
注:本手稿中提供的数据来自8至12周龄的C57Bl / 6小鼠。获得的细胞数量和被引群体的频率可能随年龄和小鼠品系而变化。 - 用70%乙醇喷洒身体。
- 使用剪刀,在垂直于脊柱的皮肤上做一个0.5-1厘米的切口,撕裂整个身体周围的皮肤。从下半身拉下皮肤并去除皮肤。
- 将动物放在解剖垫上,面朝下。通过沿着暴露的脊柱从顶部到底部滑动手指来定位骨盆骨。要定位髂嵴,请识别后肢附近腰部区域(骨盆骨的前上区域)中的小肿块。图1A、B给出了小鼠解剖结构的示意图。

图1:小鼠解剖学(A)小鼠X射线显示后肢骨骼。请注意骨盆骨和脊柱之间的空间(黄色箭头),必须插入剪刀以将后肢与小鼠身体正确分开(黄色虚线)。(B) 感兴趣的富含骨髓的骨骼的示意图。骨盆骨以红色描绘,股骨以紫色描绘,胫骨以绿色描绘。(C)小鼠骨盆骨示意图。髂骨对应于骨盆骨富含骨髓的部分,并以红色突出显示。请点击此处查看此图的放大版本。
- 将剪刀平行于脊柱靠在椎骨上,靠近髂嵴凸起。通过沿着椎骨一直向下滑动剪刀,沿着骨盆骨上方的脊柱一侧切割肌肉。
注意:肌肉的第一部分也可以使用手术刀刀片进行。 - 将剪刀平行于脊柱放置,然后继续在椎骨和髂嵴之间切割,如图 1A上的黄色虚线所示。确保尽可能靠近椎骨。切掉剩余的肌肉,将肢体从身体上分离出来。
注意:应该几乎没有阻力。 - 在另一侧重复上述步骤,分离第二肢。
- 将四肢转移到干净的表面上,并按照机构准则丢弃身体的其余部分。
- 用镊子和手术刀尽可能多地去除周围组织,暴露骨盆、股骨和胫骨。
- 继续小心地将股骨头与骨盆骨脱臼,方法是用镊子固定股骨远端,同时用手术刀轻轻切开关节周围的肌肉。摆动骨头以促进脱臼。
- 从骨盆骨上刮下剩余的肌肉,并在固定股骨头的腔体中间用手术刀切开。髂被保留,因为它富含造血祖细胞,而骨骼的三角形非常薄的一侧被丢弃,如图 1C所示。
- 用手术刀去除髂骨周围的残留组织,并将清洁的骨头放入补充有2%新生犊牛血清(PBS-2%NBCS)的无菌PBS中。
- 使用剪刀,将脚从脚踝处的腿上切下来。
- 用镊子固定胫骨的下部,将肌肉向上刮向膝盖。丢弃腓骨,用手术刀切开胫骨平台。将胫骨置于无菌PBS-2%NBCS中。
- 用手术刀去除股骨周围的残留组织。
- 用镊子固定股骨的上侧;将手术刀刀片放在膝盖骨的底部。向与股骨平行的膝盖骨施加力,直到膝盖骨脱离。将股骨置于无菌PBS-2%NBCS中。切除膝盖骨为插入针头进行骨髓冲洗提供了干净的通道。
2. 谱系阳性细胞的磁耗竭
- 在层流柜中,将骨头转移到充满无菌PBS-2%NBCS的无菌培养皿中。
- 用手术刀切掉股骨头。
- 用无菌PBS-2%NBCS填充1 mL注射器,并将21 G针头连接到插座。
- 在 5 mL 聚丙烯管中加入 2 mL 无菌 PBS-2%NBCS。
- 用镊子握住股骨;轻轻地将针头插入膝盖骨切除后留下的凹槽中。插入时旋转针头,以避免针头堵塞。确保针头完全插入骨头直至斜角。
- 将用针头将骨头转移到含有2 mL PBS-2%NBCS的管中。从注射器中分配并抽吸PBS-2%NBCS,直到骨头清晰。
- 从股骨上取下针头,并将其插入股骨头对面的孔中。再次分配并吸出缓冲液,然后丢弃骨头。
- 对于髂嵴和胫骨,用镊子固定骨头;轻轻地将针头插入开口侧。插入时旋转针头,以避免针头堵塞。确保针头完全插入骨头直至斜角。将用针头将骨头转移到含有2 mL PBS-2%NBCS的管中。从注射器中分配并抽吸PBS-2%NBCS,直到骨头清晰。丢弃骨头。
注意:最多可以将三只小鼠的骨头冲洗到同一管中。池化细胞悬浮液。 - 将混合的细胞悬浮液通过放置在无菌5m聚苯乙烯管上的40μm细胞过滤器盖。
- 继续对细胞进行计数。
注意:细胞计数可以使用任何血细胞计数器进行,使用台盼蓝进行活力评估,或者使用任何自动细胞计数器。一只小鼠通常产生105±7×106 个细胞。 - 取出100μL细胞悬浮液作为总骨髓,加入500μLPBS-2%NBCS并将其保存在冰上进行染色程序。
- 通过在4°C下以400×g离心5分钟沉淀过滤的悬浮液并弃去上清液。
注意:红细胞可以通过将沉淀重悬于新鲜制备的裂解溶液(dH 2 O中的1/10)来裂解。孵育5分钟,直到悬浮液变得清晰鲜红色,并加入10体积的无菌PBS。继续在PBS-2%NBCS中洗涤细胞,在4°C下以400×g离心5分钟。 取出上清液时要小心,因为细胞沉淀非常松散。通过在4°C下以400×g离心5分钟,用PBS-2%NBCS进行第二次洗涤,然后继续步骤2.13。 - 将细胞沉淀重悬于新鲜制备的一抗混合物中,比例为每1×107 个细胞100μL。在冰上孵育30-45分钟。
| 抗体 | 稀释 |
| 1-克-生物素 | 1:500 |
| B220-生物素 | 1:500 |
| 甲基-1-生物素 | 1:500 |
| CD3-生物素 | 1:500 |
| CD4-生物素 | 1:500 |
| CD5-生物素 | 1:500 |
| CD8-生物素 | 1:500 |
| TER119-生物素 | 1:1000 |
| CD127-生物素 | 1:500 |
表 1.
- 将10μL细胞悬浮液放入无菌的5mL聚苯乙烯管中,标有Lin-Pos级分。加入90μLPBS-2%NBCS,并将其保存在冰上进行染色程序。
- 通过在4°C下以400×g离心5分钟,继续用无菌PBS-2%NBCS洗涤细胞两次。 确保在无菌的5 mL聚丙烯管中进行最后一次洗涤。
- 在洗涤步骤中,准备磁珠以消耗磁性。
- 通过彻底涡旋30秒将珠子重悬在小瓶中。
- 将对应于每个靶细胞两个磁珠的一体积的磁珠转移到5 mL聚丙烯管中。
- 将管子放在磁铁上并使用无菌玻璃巴斯德移液器除去洗涤缓冲液,用PBS-2%NBCS洗涤珠子两次。
- 将磁珠重悬于500μL无菌PBS-2NBCS%中。
- 将标记细胞的沉淀重悬于250μL微珠中,并在冰上轻轻混合5分钟。加入 2 毫升无菌 PBS-2%NBCS 并轻轻混合。不要摇晃管子。
- 将管子放在磁铁上2分钟。
- 继续用无菌玻璃巴斯德移液器收集非磁性馏分,并将其添加到剩余的250μL磁珠中。用钢筋密封管子。
- 将管子放在管辊上20分钟,在4°C下。
- 加入 2 毫升无菌 PBS-2%NBCS 并轻轻混合。不要摇晃管子。
- 将管子放入磁铁中2分钟。
- 继续用无菌玻璃巴斯德移液管将非磁性馏分收集到无菌的5 mL聚丙烯管中,标有Lin-Neg馏分。
- 通过在4°C下以400×g离心5分钟沉淀细胞并除去上清液。
- 将非磁性细胞重悬于500μL无菌PBS-2%NBCS中。
- 继续对细胞进行计数。
注意:一只鼠标通常产生 3.9 ± 1.1 x 106 个 细胞。典型的谱系染色前和耗竭后如图 2B所示。
3. 流式细胞术对巨核细胞祖细胞进行细胞分选
- 取标有总骨髓,Lin-Pos分数和Lin-Neg分数的管子。
- 继续将管内总骨髓的内容物平均分成六个无菌的5mL聚苯乙烯管。用数字1-6标记管子。
- 继续用数字7标记管子Lin-Pos分数。
- 继续按如下方式拆分管中林负分数的内容物。
- 将50μL转移到含有250μL无菌PBS-2%NBCS的无菌5mL聚苯乙烯管中。然后,将其内容物平均分成3个无菌的5 mL聚苯乙烯管。用数字8-10标记这些管子。
- 剩余的450μLLin-Neg级分细胞悬浮液对应于数字为11的管。
- 将抗体添加到试管中,如 表2中所述。
| 管 | 标签 | 抗体鸡尾酒 |
| 总骨髓 | ||
| 1 | 无污染的控制 | |
| 2 | 单次染色对照 | CD45-FITC (1/200) |
| 3 | 单次染色对照 | CD45-聚乙烯 (1/200) |
| 4 | 单次染色对照 | TER119-APC (1/200) |
| 5 | 单次染色对照 | CD45-PECy7 (1/200) |
| 6 | 单次染色对照 | CD45-APC-Cy7 生物素 (1/200) |
| 林-波斯特分数 | ||
| 7 | 单次染色对照 | 单色对照。链霉亲和素-APC-Cy7 (1/500) |
| 林负分数 | ||
| 8 | FMO FITC 控制 | C-套件-APC (1/200) + SCA-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + 链霉亲和素-APC-Cy7 (1/500) |
| 9 | 热电联控制 | CD9-FITC (1/200) + C-kit-APC (1/200) + CD150-PECy7 (1/200) + 链霉亲和素-APC-Cy7 (1/500) |
| 10 | FMO PECy7 控制 | CD9-FITC (1/200) + C 套件-APC (1/200) + SCA-1-PE (1/200) + CD16/32-PE (1/200) + 链霉亲和素-APC-Cy7 (1/500) |
| 11 | 用于分拣的正极管 | CD9-FITC (1/200) + C 套件-APC (1/200) + SCA-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + 链霉亲和素-APC-Cy7 (1/500) |
表 2.
- 在黑暗中在冰上孵育30-45分钟。
- 通过在4°C下以400×g离心5分钟,用无菌PBS-2%NBCS洗涤细胞。
- 重悬细胞沉淀如下。
- 对于管1至10,将沉淀重悬于300μL无菌PBS-2%NBCS中,并补充7AAD(2.5μg/ mL最终)(PBS-7AAD)。
注意:7AAD是一种DNA插层剂,因此必须使用适当的PPE(手套)进行处理。 - 对于管11,将沉淀重悬于无菌PBS-7AAD中,最大浓度为每mL5×106 个细胞,最小体积为1mL。
- 对于管1至10,将沉淀重悬于300μL无菌PBS-2%NBCS中,并补充7AAD(2.5μg/ mL最终)(PBS-7AAD)。
- 准备两个标有MEP和MKp的聚丙烯收集管,其中含有2毫升PBS-2%NBCS。
注意:或者,可以将细胞收集到培养基或细胞裂解缓冲液中,具体取决于随后对分选细胞的应用。不建议使用聚苯乙烯管,因为可能会干扰含有目标细胞的带电液滴。 - 在黑暗中将所有管子放在冰上。
- 继续进行细胞分选机设置。
- 使用管1-7设置电压和补偿,管7-10确定目标细胞群的分选门,管11用于细胞分选。
- 门控策略的第一步旨在从分析中排除双电偶和死细胞,如图 3所示。识别单个活细胞并显示SSC与Lin-APC-Cy7点阵图,以确认谱系消耗的效率。从Lin- 细胞中,门被设置为选择c-kit阳性的细胞,Sca-1和CD16 / 32的阴性或变暗。所选细胞的CD9与CD150表达点图允许识别四个群体。
注意:MEP和MKp细胞均为CD150阳性。CD9的表达水平可以分为三个级别(负、暗淡和高)。MKp表达高水平的CD9,MEP在中等荧光强度水平上表达CD9。MEP群体对应于Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim 和MKp群体对应于Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9明亮。CD150阳性细胞的CD9高和CD9昏暗群体之间的区别是基于CD150阴性群体中CD9表达的最大水平来设定的。一只鼠标通常产生 5.3 ± 0.6 x 103 MKp 和 27.2 ± 2.4 x 103 MEP。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
通过流式细胞术对鉴定为MEP和MKp的细胞进行表型分析。细胞用CD41a和CD42c的荧光偶联抗体标记,CD41a和CD42c是巨核细胞和血小板谱系的经典标志物。这两种标记物均由MKp群体的细胞表达,而这些标记尚未在MEP群体的细胞表面检测到(图4Ai,4Aii)。多倍体是巨核细胞的标志。还分析了分类群体的DNA含量,并证明MEP群体的细胞大多为2N,MKp细胞的一小部分是4N,但在这些群体中没有显着检测到更高的倍数(图4Aiii)。
为了确认分类细胞群的身份,进行了几次分化测定以评估其分化为巨核细胞和红系的能力。首先,进行半固体克隆发生测定以定量巨核细胞祖细胞(CFU-MK)和红系祖细胞(BFU-E)。在MEP和MKp人群中均检测到CFU-MK,但在其他测试人群中未检测到CFU-MK(图4B)。在MKp群体中未检测到BFU-E,但在MEP群体和CD150-CD9昏暗细胞群中检测到BFU-E(图4C)。
在低浓度造血细胞因子存在的情况下,在液体培养物中也遵循分选细胞的分化。分化第3天的显微镜观察的代表性图像显示,MEP和MKp主要产生被鉴定为大细胞的巨核细胞(图5Aiii,5Aiv)。使用CD41和CD42c表达鉴定巨核细胞,分别代表53.9±MEP和MKp细胞群产生的细胞的2.0%±10.4%和82.0%(图5B)。值得注意的是,与MEP群体相比,使用DNA标记Hoescht 33242分析产生的巨核细胞的倍数大于MKp群体的巨核细胞,表明更成熟的状态(图5C)。最后,在第3天对每个群体产生的细胞进行丙酸盐形成测定9。据观察,只有来自MKp群体的细胞在这种情况下才能够发射丙酸盐(图5D)。这表明MKp人群处于更高级的成熟阶段。此外,当培养持续时间延长至4-5天时,MEP产生的巨核细胞也会延长丙酸盐。

图2:谱系提交(Lin)细胞的磁耗竭。 (A) 磁耗竭方案的示意图。首先,用生物素偶联的大鼠抗小鼠抗体混合物标记未分类的骨髓细胞。然后将细胞与抗大鼠Ig包被的磁珠孵育,然后使用强磁铁进行磁耗尽。磁铁将保留标记的磁性Lin+分数靠在管壁上,而未标记的非磁性Lin-负部分将被收集在新管中。(B) 谱系承诺细胞可以使用荧光偶联链霉亲和素进行鉴定。磁性耗竭前(总骨髓)和磁耗竭后细胞谱系表达的典型分析(Lin-分数)N = 21。 请点击此处查看此图的放大版本。

图3:细胞分选门控策略(A)选择与活单细胞对应的事件。(B) MEP和MKp种群选择。(i) Lin Neg群体是从活的单细胞事件中选择的。(ii)然后选择表达c-试剂盒且Sca-1或CD16/32抗原表达低或无表达的祖细胞。(iii)CD9和CD150表达水平定义了四个细胞群。MKp被定义为CD9明亮的CD150+细胞,MEP被定义为CD9暗淡的CD150+。CD9dimCD150+群体的CD9表达的上限基于CD150-细胞的最大CD9表达水平。为了分析的目的,CD9dimCD150-细胞(祖细胞)和CD9-CD150- (双阴性:DN)也被分类。(C) 细胞分选门基于荧光减一 (FMO) 对照。(i) CD9 门的 FMO 控制 (ii) CD150 门的 FMO 控制。请点击此处查看此图的放大版本。

(A)流式细胞术分析(i)CD41表达,(ii)CD42c表达和(iii)CD9+ CD150dim(MEP)和CD9+CD150明亮(MKp)细胞群中的DNA含量(Hoechst33342)。(B) 从分类的细胞群中定量CFU-MK。CD9-CD150- (DN),CD9+CD150- (Prog),CD9+CD150 dim(MEP)和CD9+CD150明亮(MKp)细胞群根据制造商的说明进行分类并接种在胶原凝胶中。(C) 从分类的细胞群中定量BFU-E。CD9-CD150- (DN),CD9+CD150- (Prog),CD9+CD150dim (MEP)和CD9+CD150明亮(MKp)细胞群根据制造商的说明进行分类并接种在甲基纤维素凝胶中。请点击此处查看此图的放大版本。

图5:MEP和MKp的分化潜力。将CD9-CD150-(DN),CD9+CD150-(Prog),CD9+CD150 - (Prog),CD9 + CD150 dim(MEP)和CD9+CD150明亮(MKp)细胞群在补充有SCF(7.5ng / mL),Flt-3(5 ng / mL),IL-6(1 ng / mL)和TPO(10ng / mL)的StemSpan培养基中培养三天。(A)通过相差显微镜拍摄的代表性图像。(B) 然后通过流式细胞术评估CD41+CD42c+巨核细胞的百分比。N = 3。(C) 然后用Hoechst通过流式细胞术评估CD41+ CD42c+巨核细胞的倍体水平。N = 3。(D) 从 CD9 - CD150-(DN)、CD9+CD150-(Prog)、CD9+CD150dim(MEP) 和 CD9+CD150亮(MKp) 细胞群中收获第 3 天产生的细胞,并在补充有 50 ng/mL TPO、10 % 胎儿犊牛血清和 100 U/mL 水蛔蓝的 DMEM 培养基中培养。(i)培养物中形成丙酸盐的巨核细胞的比例是通过显微镜观察确定的。根据其大小和/或丙酸盐的存在来鉴定巨核细胞。N = 2。(ii) 通过相差显微镜拍摄的含有巨核细胞的丙酸盐的代表性照片。请点击此处查看此图的放大版本。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本文中描述的方法允许提取和纯化小鼠MEP和MKp。方案优化的一个重要参数是获得足够数量的细胞,这些细胞与大多数基于分子和细胞的测定相容。收集小鼠骨以进行造血细胞提取的一般做法通常包括收获每只小鼠的股骨和胫骨。因此,骨盆骨是造血材料的另一个来源,经常被忽视。不收集髂嵴的原因是对小鼠骨骼的内部解剖结构知之甚少,并且用户通常通过穿过或刚好在股骨头上方来收集后肢。此外,通常认为骨髓细胞不会有效地从髂嵴骨中排出,因为存在小梁,小梁在胫骨和股骨的中央部分不存在。在该协议中,解决了这两个问题,并提出了一种标准化,可靠且具有时效性的方法,该方法允许对每个后肢骨(包括盆骨)进行适当的冲洗。特别是,使用髂骨每只小鼠产生105±7×106个细胞,而经典方法通常产生42±5×106个细胞。这种方法的一个主要好处是减少了获得给定数量靶细胞所需的动物数量,从而提供了更合乎道德和更具成本效益的实验条件。因此,该程序也适用于任何需要骨髓细胞悬浮的研究,例如分离造血干细胞10或分析半固体条件下的造血祖细胞行为11。
与磁性富集技术相比,使用流式细胞术进行细胞分选是一种强大的技术,在纯度方面具有主要优势,但稀有种群的细胞分选产量可能低于更丰富的种群。因此,事先对不需要的细胞进行磁耗竭是增加目标细胞频率的有用方法。在这里,磁耗竭程序与制造商的建议不同,并考虑了用于去除不需要的谱系阳性细胞的表面标记物表达的异质性。使用典型的一步法,具有最高表面标记物表达的谱系阳性细胞将迅速使磁珠饱和。它们将防止随后通过竞争和空间位阻捕获剩余的标记细胞,从而显着降低消耗效率。为了解决这个问题,设计了一种两步磁耗竭,允许顺序去除所有谱系阳性细胞,从而允许适合细胞分选的严格耗竭。
实现有效耗竭的另一个关键参数是不需要的谱系阳性细胞的适当标记条件。因此,抗体滴定经过专门优化。使用较高浓度的抗体将导致磁珠过度膨胀和目标谱系阴性细胞的非特异性耗尽。使用高度纯化的MEP和MKp细胞群是研究巨核生成的重要工具。为了阐明控制这一过程的机制,该研究调查了细胞微环境的作用,并表明胎儿肝细胞基质细胞群将支持MKp10的分化。分类的群体也可用于基于分子或单细胞的分析。考虑到巨核细胞偏倚的HSC12,13,14的新兴概念,这将特别相关。直接从HSC群体中产生巨核细胞而不产生二能祖细胞将是应对压力的紧急途径13。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
作者声明没有竞争的经济利益。
Acknowledgments
作者希望感谢Monique Freund,Catherine Ziessel和Ketty的技术援助。这项工作得到了ARMESA(医学和公共发展协会)和Grant ANR-17-CE14-0001-01的支持,以 Henri.de la。大厅。
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
生物学,第171期,Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
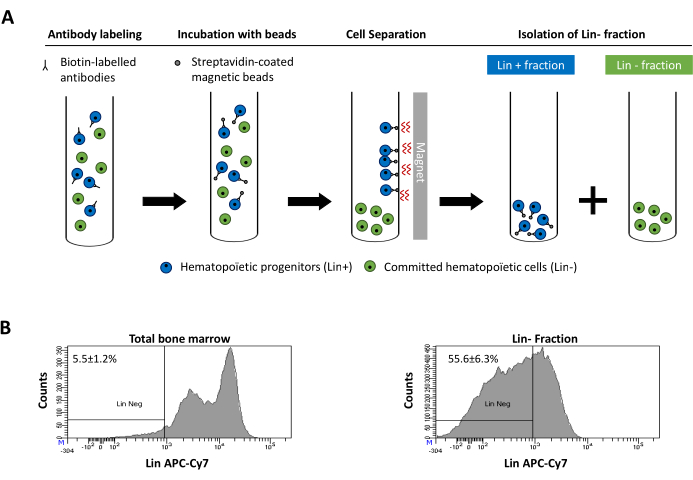
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
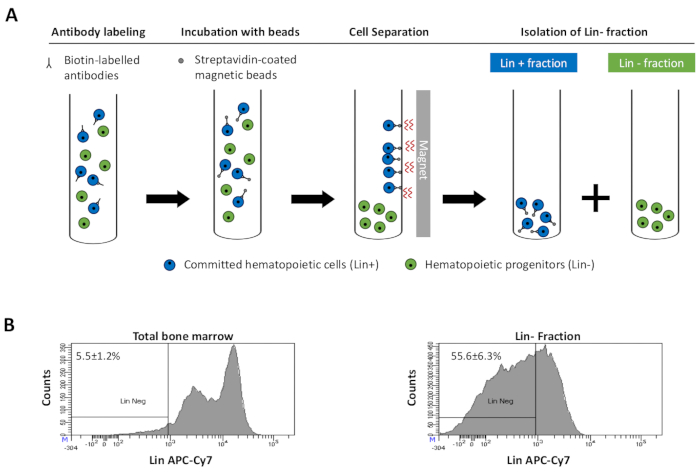
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



