ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denne metode beskriver rensningen ved flowcytometri af MEP og MKp fra mus lårben, skinneben og bækken knogler.
Abstract
Knoglemarvs megakaryocytter er store polyploidceller, der sikrer produktionen af blodplader. De stammer fra hæmatopoietiske stamceller gennem megakaryopoiesis. De sidste faser af denne proces er komplekse og involverer klassisk de bipotent Megakaryocyte-Erythrocyte Progenitors (MEP) og unipotent Megakaryocyte Progenitors (MKp). Disse populationer går forud for dannelsen af bona fide megakaryocytter, og som sådan kunne deres isolation og karakterisering give mulighed for en robust og upartisk analyse af megakaryocytdannelse. Denne protokol præsenterer i detaljer proceduren for indsamling af hæmatoopoietiske celler fra musebenmarv, berigelse af hæmatoopoietiske forfædre gennem magnetisk udtømning og endelig en cellesorteringsstrategi, der giver stærkt rensede MEP- og MKp-populationer. For det første opsamles knoglemarvsceller fra lårbenet, skinnebenet, og også iliaca crest, en knogle, der indeholder et stort antal hæmatopoietic forfædre. Brugen af iliac crest knogler drastisk øger det samlede celletal opnået pr mus og dermed bidrager til en mere etisk brug af dyr. En magnetisk afstamning udtømning blev optimeret ved hjælp af 450 nm magnetiske perler giver en meget effektiv celle sortering af flow cytometri. Endelig præsenterer protokollen mærknings- og gatingstrategien for sortering af de to stærkt rensede megakarycyt stamfaderpopulationer: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim) og MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9bright ). Denne teknik er let at gennemføre og giver nok cellulært materiale til at udføre i) molekylær karakterisering for en dybere viden om deres identitet og biologi, ii) in vitro differentiering assays, der vil give en bedre forståelse af mekanismerne for modning af megakaryocytter, eller iii) in vitro modeller af interaktion med deres mikromiljø.
Introduction
Blodplader produceres af megakaryocytter. Disse store polyploidceller er placeret i knoglemarven, og som for alle blodlegemer er de afledt af hæmatopoietiske stamceller (HSC)1. Den klassiske produktionsvej for megakaryocytter i knoglemarven stammer fra HSC og involverer generering af forskellige forfædre, der gradvist begrænser deres differentieringspotentiale2. Den første stamfader underskrive forpligtelsen til megakaryocytisk afstamning er Megakaryocyte-Erythrocyte Progenitor (MEP), en bipotent stamfader i stand til at producere både erythroid celler og megakaryocytter3,4,5. Mep'et producerer derefter en unipotent stamfader /forløber (MKp), der vil differentiere sig til en moden megakaryocyt, der er i stand til at producere blodplader. De mekanismer, der er involveret i dannelsen af disse forfædre, samt deres differentiering og modning til megakaryocytter er komplekse og kun delvist forstået. Desuden er det stadig uklart, om parlamentsmedlemmets forskelligartethed med hensyn til differentieringspotentiale og disse cellers iboende engagementsniveau er uensartet. For at dechifrere disse processer er det vigtigt at opnå (eller få adgang til) rensede populationer af MEP og MKp til fine molekylære og enkeltcelleanalyser.
Flere undersøgelser har vist særlige kombinationer af celleoverflade markører til identifikation af forfædre forpligtet til megakaryocytisk afstamning i musen6,7,8. Ud fra disse blev der udtænkt en metode, der gjorde det muligt at rense MEP og MKp fra mus. Denne metode blev optimeret til at opnå celler i tilstrækkeligt antal og kvalitet til et stort antal analyser. Med etiske overvejelser i tankerne, og for at minimere antallet af dyr, der er involveret i forsøgene, vi fremkaldte at høste knoglemarven fra lårbenet og skinnebenet, og også fra iliac crest. Denne knogle indeholder en høj frekvens og antallet af hæmatoopoietic forfædre og er det meste af tiden beskadiget under lang knogle høst. Præsenteret her er en detaljeret metode til pålidelig indsamling af denne knogle.
Det andet optimeringskriterier er at producere stærkt rensede cellepopulationer. Fluorescerende aktiveret cellesortering (FACS) er en metode til valg for at opnå rensede populationer af celler af interesse. Men lave udbytter nås, når cellepopulationen af interesse er meget sjælden. Det er derfor nødvendigt med berigningsprocedurer. I denne protokol blev en negativ udvælgelsesprocedure valgt ved hjælp af magnetiske perler.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokoller, der omfattede dyr, blev udført i overensstemmelse med CREMEAS's komité for etik i dyreforsøg ved universitetet i Strasbourg (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg). Tilladelsesnummer: E67-482-10).
1. Indsamling af museben
- Ofre dyret i overensstemmelse med de institutionelle retningslinjer.
BEMÆRK: De data, der præsenteres i dette manuskript, er hentet fra C57Bl/6 mus på 8 til 12 uger. Antallet af opnåede celler, og hyppigheden af citerede populationer kan variere med alder og mus stamme. - Spray kroppen med 70% ethanol.
- Brug en saks, lav en 0,5-1 cm snit af huden vinkelret på rygsøjlen og rive huden rundt om hele kroppen. Træk huden ned fra underkroppen og fjern huden.
- Placer dyret på dissektionspuden med forsiden nedad. Find bækkenbenene ved at skubbe fingrene langs den udsatte rygsøjle fra toppen til bunden. For at finde iliaca crest, identificere den lille bump i lænderegionen nær hindlimbs (anterosuperior regionen af bækkenbenet). Figur 1A, B præsenterer en skematisk repræsentation af musens anatomi.

Figur 1: Musens anatomi. (A) Mus X-Ray, der viser baglimb knoglerne. Bemærk afstanden mellem bækkenbenet og rygsøjlen (gul pil), hvor saksen skal indsættes for korrekt at adskille baglimberne fra musens krop (gul prikket linje). (B) Skematisk repræsentation af knoglemarvsrige knogler af interesse. Bækkenbenene er afbildet med rødt, lårbenene i lilla og skinnebenet i grønt. (C) Skematisk repræsentation af muse bækkenbenet. Ilium svarer til den marv-rige del af bækkenbenet og er fremhævet i rødt. Klik her for at se en større version af dette tal.
- Placer saksen parallelt med rygsøjlen mod ryghvirvlerne og tæt på iliac crest bump. Fortsæt med at skære musklerne langs siden af rygsøjlen over bækkenbenet ved at skubbe saksen langs ryghvirvlerne hele vejen ned til halen.
BEMÆRK: Denne første del af musklerne kan også udføres ved hjælp af en skalpelblad. - Læg saksen parallelt med rygsøjlen og fortsæt med at skære mellem ryghvirvlerne og iliaca crest, som angivet af den gule stiplede linje på figur 1A. Sørg for at forblive så tæt på ryghvirvlerne som muligt. Skær de resterende muskler til at løsne lemmerne fra kroppen.
BEMÆRK: Der bør være lidt eller ingen modstand. - Gentag på den anden side for at løsne det andet lem.
- Overfør lemmerne på en ren overflade og kassér resten af kroppen i overensstemmelse med de institutionelle retningslinjer.
- Eksponer bækken, lårben, og tibial knogler ved at fjerne så meget omgivende væv som muligt med sammentævninger og skalpeller.
- Fortsæt med forsigtigt at forvrede lårbenet hovedet fra bækkenbenet ved at holde den distale ende af lårbenet med sammentrækningerne, mens du forsigtigt udskæring musklerne omkring artikulation med skalpeller. Vrikke knoglerne for at lette dislokationen.
- Skrab de resterende muskler fra bækkenbenet og skær med en skalpel i midten af hulrummet, der holdt lårbenet hovedet. Ilium holdes som det er rig på hæmatopoietic forfædre, mens den trekantede meget tynde side af knoglen kasseres, som vist i figur 1C.
- Fjern restvævet omkring ilium med skalpellen og placer den rensede knogle i steril PBS suppleret med 2% Newborn Calf Serum (PBS-2%NBCS).
- Brug en saks, skær foden af benet ved anklen.
- Hold den nederste del af skinnebenet med sammentøverne og skrab musklen op mod knæet. Kassér fibulae og skære over tibial plateau med skalpellen. Placer skinnebenet i steril PBS-2%NBCS.
- Fjern restvævet omkring lårbenet med skalpeller.
- Hold oversiden af lårbenet med sammenkrump; skalpelbladet i bunden af knæskallen. Påfør en kraft mod knæskallen parallelt med lårbenet, indtil løsrivelse af knæskallen. Placer lårbenet i steril PBS-2%NBCS. Fjernelse af knæskallen giver en ren adgang til at indsætte nålen til marv skylning.
2. Magnetisk udtømning af afstamning positive celler
- I et laminar flow kabinet, overføre knoglerne i en steril Petri parabol fyldt med steril PBS-2%NBCS.
- Med en skalpel skåret af lårbenets hoved.
- Fyld en 1 mL sprøjte med steril PBS-2%NBCS og fastgør en 21 G nål til stikkontakten.
- Fyld et 5 mL polypropylenrør med 2 mL steril PBS-2%NBCS.
- Hold lårbenet med drivkræfterne; forsigtigt indsætte nålen i rillen tilbage efter knæskallen fjernelse. Påfør rotation på nålen, mens du indsætter for at undgå at tilslutte nålen. Sørg for, at nålen er helt indsat i knoglen op til facet.
- Overfør knoglen med nålen ind i røret, der indeholder 2 mL PBS-2%NBCS. Dispenser og aspirer PBS-2%NBCS fra sprøjten, indtil knoglen er klar.
- Fjern nålen fra lårbenet og sæt den i hullet på den modsatte side, hvor lårbenet hovedet var. Dispenser og aspirer bufferen igen, og kassér knoglen.
- For iliaca crest og skinneben, holde knoglen med sammenkræderne; sæt forsigtigt kanylen i den åbne side. Påfør rotation på nålen, mens du indsætter for at undgå at tilslutte nålen. Sørg for, at nålen er helt indsat i knoglen op til facet. Overfør knoglen med nålen ind i røret, der indeholder 2 mL PBS-2%NBCS. Dispenser og aspirer PBS-2%NBCS fra sprøjten, indtil knoglen er klar. Kassér knoglerne.
BEMÆRK: Knogler fra op til tre mus kan skylles i samme rør. Pool celle suspensioner. - Pass den poolede celle suspension gennem en 40 μm celle si hætte placeret på en steril 5 mL polystyren rør.
- Fortsæt med at tælle cellerne.
BEMÆRK: Celletælling kan udføres med ethvert hæmocytometer ved hjælp af Trypan Blue til levedygtighedsvurdering eller med enhver automatiseret celletæller. En mus giver typisk 105 ± 7 x 106 celler. - Tag 100 μL af celleaffjedringen til side som samlet knoglemarv, tilsæt 500 μL PBS-2%NBCS, og gem den på is til farvningsproceduren.
- Pellet den filtrerede suspension ved centrifugering ved 400 x g i 5 min ved 4 °C og kassér supernatanten.
BEMÆRK: Røde blodlegemer kan lyseres ved at genudsende pellet i frisklavet Lysis-opløsning (1/10th i dH2O). Inkuber i 5 min, indtil suspensionen bliver klar og lys rød og tilsæt 10 mængder steril PBS. Fortsæt med at vaske cellerne i PBS-2%NBCS ved centrifugering ved 400 x g i 5 minutter ved 4 °C. Vær forsigtig, når du fjerner supernatanten, da cellepillen er meget løs. Udfør en anden vask med PBS-2%NBCS ved centrifugering ved 400 x g i 5 min ved 4 °C og fortsæt til trin 2.13. - Brug cellepillen resuspend i frisklavet primær antistofcocktail med et forhold på 100 μL pr. 1 x 107 celler. Inkuber på is i 30-45 min.
| Antistof | Fortynding |
| Gr-1-biotin | 1:500 |
| B220-biotin | 1:500 |
| Mac-1-biotin | 1:500 |
| CD3-biotin | 1:500 |
| CD4-biotin | 1:500 |
| CD5-biotin | 1:500 |
| CD8-biotin | 1:500 |
| TER119-biotin | 1:1000 |
| CD127-biotin | 1:500 |
Tabel 1.
- Træk 10 μL af celleaffjedringen til et sterilt 5 mL polystyrenrør med navnet Lin-Pos Fraction. Tilsæt 90 μL PBS-2%NBCS og gem det på is til farvningsproceduren.
- Fortsæt med at vaske cellerne to gange med steril PBS-2%NBCS ved centrifugering ved 400 x g i 5 min ved 4 °C. Sørg for at gøre den sidste vask i en steril 5 mL polypropylen rør.
- Under vasketrinene forberedes perlerne til den magnetiske udtømning.
- Resuspend perlerne i hætteglasset ved grundigt hvirvler i 30 s.
- Overfør et volumen af perler svarende til to perler pr mål celle i en 5 mL polypropylen rør.
- Vask perlerne to gange med PBS-2%NBCS ved at placere røret på magneten og fjerne vaskebufferen ved hjælp af et sterilt glas Pasteur pipette.
- Resuspend perlerne i 500 μL steril PBS-2NBCS%.
- Resuspend pellet af mærkede celler i 250 μL af perler og bland forsigtigt i 5 min på is. Tilsæt 2 mL steril PBS-2%NBCS og bland forsigtigt. Ryst ikke røret.
- Placer røret på magneten i 2 min.
- Fortsæt med at indsamle den ikke-magnetiske fraktion med et sterilt glas Pasteur pipette og tilsæt den på de resterende 250 μL magnetiske perler. Forsegl røret med parafilm.
- Røret placeres på en rørrulle i 20 min ved 4 °C.
- Tilsæt 2 mL steril PBS-2%NBCS og bland forsigtigt. Ryst ikke røret.
- Placer røret i magneten i 2 min.
- Fortsæt med at opsamle den ikke-magnetiske fraktion i et sterilt 5 mL polypropylenrør mærket Lin-Neg Fraction med et sterilt glas Pasteur pipette.
- Pjecellerne ved centrifugering ved 400 x g i 5 min ved 4 °C og fjern supernatanten.
- Brug de ikke-magnetiske celler i 500 μL steril PBS-2%NBCS.
- Fortsæt med at tælle cellerne.
BEMÆRK: En mus giver typisk 3,9 ± 1,1 x 106 celler. Typisk afstamning farvning før og efter udtømning er præsenteret i figur 2B.
3. Cellesortering af megakaryocyt stamfaderer efter flowcytometri
- Tag rørene mærket Total Knoglemarv, Lin-Pos Fraction, og Lin-Neg Fraction.
- Fortsæt med at opdele indholdet af røret Total Knoglemarv ligeligt i seks sterile 5 ML polystyren rør. Mærk rørene med tallene 1-6.
- Fortsæt med at mærke røret Lin-Pos Brøk med tallet 7.
- Fortsæt med at opdele indholdet af røret Lin-Neg Fraction som følger.
- Overfør 50 μL til et sterilt 5 mL polystyrenrør, der indeholder 250 μL steril PBS-2%NBCS. Derefter opdeles indholdet ligeligt i 3 sterile 5 ML polystyrenrør. Mærk disse rør med tallene 8-10.
- De resterende 450 μL lin-neg fraktion celleaffjedring svarer til røret med tallet 11.
- Antistofferne til rørene tilføjes som beskrevet i tabel 2.
| Rør | Etiket | Antistofcocktail |
| Knoglemarv i alt | ||
| 1 | Ikke-farvet kontrol | |
| 2 | Enkelt farvet kontrol | CD45-FITC (1/200) |
| 3 | Enkelt farvet kontrol | CD45-PE (1/200) |
| 4 | Enkelt farvet kontrol | TER119-APC (1/200) |
| 5 | Enkelt farvet kontrol | CD45-PECy7 (1/200) |
| 6 | Enkelt farvet kontrol | CD45-APC-Cy7 biotin (1/200) |
| Lin-Pos Brøk | ||
| 7 | Enkelt farvet kontrol | Enkelt plettet kontrol. Streptavidin-APC-Cy7 (1/500) |
| Lin-Neg Brøk | ||
| 8 | FMO FITC-kontrol | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | FMO PE kontrol | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | FMO PECy7-kontrol | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Positivt rør til sortering | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tabel 2.
- Inkuber på is i 30-45 minutter i mørket.
- Cellerne vaskes med steril PBS-2%NBCS ved centrifugering ved 400 x g i 5 min ved 4 °C.
- Resuspend cellen pellets som følger.
- For rørene 1 til 10 skal pelleten genbruges i 300 μL steril PBS-2%NBCS suppleret med 7AAD (2,5 μg/mL endelig) (PBS-7AAD).
FORSIGTIG: 7AAD er et DNA-interkalt middel og skal derfor håndteres med passende PPE (handsker). - For rør 11 skal pellet genbruges i steril PBS-7AAD ved en maksimal koncentration på 5 x 106 celler pr. mL og et minimum volumen på 1 mL.
- For rørene 1 til 10 skal pelleten genbruges i 300 μL steril PBS-2%NBCS suppleret med 7AAD (2,5 μg/mL endelig) (PBS-7AAD).
- Forbered to polypropylenopsamlingsrør mærket MEP og MKp, der indeholder 2 mL PBS-2%NBCS.
BEMÆRK: Alternativt kan celler opsamles i kulturmedium- eller celle lysisbuffer afhængigt af den efterfølgende anvendelse af de sorterede celler. Brugen af polystyrenrør anbefales ikke på grund af mulig interferens med de ladede dråber, der indeholder cellerne af interesse. - Hold alle rør på is i mørke.
- Fortsæt til opsætningen af cellesortering.
- Brug rørene 1-7 til opsætning spænding og kompensation, rør 7-10 til at bestemme sortering porte til cellepopulationer af interesse og rør 11 for celle sortering.
- De første trin i gatingstrategien har til formål at udelukke dobbeltgængere og døde celler fra analysen som beskrevet i figur 3. Identificer enkelte levedygtige celler og vise SSC-vs Lin-APC-Cy7 prik plot for at bekræfte effektiviteten af slægten udtømning. Fra Lin- celler en port er indstillet til at vælge celler positive for c-kit og negativ eller dim for Sca-1 og CD16/32. Et CD9 vs CD150-udtryksdnop plot for de markerede celler gør det muligt at identificere fire populationer.
BEMÆRK: MEP- og MKp-celler er begge positive for CD150. Der kan defineres tre udtryksniveauer for CD9 (neg, dim og høj). MKp udtrykker et højt niveau af CD9 og MEP express CD9 på et mellemliggende fluorescensintensitetsniveau. MEP befolkning svarer til Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim og MKp befolkning svarer til Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9lyse. Forskelsbehandlingen mellem CD9-høj- og CD9-dim populationer for cd150-positive celler er baseret på det maksimale niveau for CD9-udtryk i cd150-negativ populationen. En mus giver typisk 5,3 ± 0,6 x 103 MKp og 27,2 ± 2,4 x 103 MEP.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Fænotypisk analyse af de celler, der blev identificeret som MEP og MKp, blev udført af flowcytometri. Cellerne blev mærket med fluorescens konjugeret antistoffer mod CD41a og CD42c, klassiske markører af megakaryotetik og blodplade slægter. Begge markører blev udtrykt af cellerne i MKp-populationen, mens disse markører endnu ikke er påvist på overfladen af cellerne i MEP-populationen (Figur 4Ai,4Aii). Polyploidy er et kendetegn for megakaryocytter. DNA-indholdet af de sorterede populationer blev også analyseret og påvist, at cellerne for det meste er 2N for MEP-populationen, og en lille del af MKp-cellerne er 4N, men højere ploidi opdages ikke signifikant i disse populationer (Figur 4Aiii).
For at bekræfte identiteten af de sorterede cellepopulationer blev der udført flere differentieringsanalyser for at evaluere deres evne til at differentiere sig mod de megakaryotetiske og erythroide slægter. For det første blev der udført halvfaste clonogenic assays for at kvantificere megakaryocytisk stamfader (CFU-MK) og erythroid stamfaderer (BFU-E). CFU-MK blev påvist i både MEP- og MKp-populationer, men ikke i den anden testede population (figur 4B). BFU-E blev ikke påvist i MKp-populationen, men blev påvist i MEP-populationen og CD150-CD9dim cell population (Figur 4C).
Differentiering af de sorterede celler blev også fulgt i flydende kultur i nærværelse af en lav koncentration af hæmatopoietiske cytokiner. Repræsentative billeder fra mikroskopisk observation på den3. dag for differentiering viser, at MEP og MKp hovedsagelig producerede megakaryocytter, der er identificeret som store celler (Figur 5Aiii,5Aiv). Megakaryocytter blev identificeret ved hjælp af CD41 og CD42c udtryk og repræsenterer 53,9 ± 10,4% og 82,0 ± 2,0% af de celler, der produceres fra MEP og MKp cellepopulationer, henholdsvis (Figur 5B). Mærkbart, ploidi af megakaryocytter produceret analyseret ved hjælp af DNA-markør Hoescht 33242, var større for megakaryocyt stammer fra MKp befolkning i forhold til MEP befolkning tyder på en mere moden tilstand (Figur 5C). Endelig blev de celler, der blev produceret fra hver population den3. Det blev observeret, at kun de celler, der stammer fra MKp-populationen, var i stand til at opnå emission i denne tilstand (figur 5D). Dette tyder på en mere avanceret modning fase for MKp befolkning. Desuden vil megakaryocytter, der genereres fra MEP, også udvide proplatelets, når kulturvarigheden forlænges op til 4-5 dage.

Figur 2: Magnetisk udtømning af slægtsdestruktionsceller (Lin). For det første er usorterede knoglemarvsceller mærket med den biotinkonjugerede rotte anti-mus antistofcocktail. Celler inkuberes derefter med anti-rotte Ig coated magnetiske perler og efterfølgende udsættes for den magnetiske udtømning ved hjælp af en stærk magnet. Magneten vil bevare den mærkede magnetiske Lin + fraktion mod rørvæggene, mens den umærkede ikke-magnetiske Lin-negative fraktion vil blive indsamlet i et nyt rør. (B) Slægtsdetalte celler kan identificeres ved hjælp af fluorescerende konjugeret streptavidin. Typisk analyse af slægtsekspressionen i celler før magnetisk udtømning (total knoglemarv) og efter magnetisk udtømning (Lin- Fraction) N = 21. Klik her for at se en større version af dette tal.

Figur 3: Cellesorteringsgatingstrategi. (A) Udvælgelse af hændelser, der svarer til levedygtige enkeltceller. (B) Mep og MKp befolkningsvalg. (i) Lin Neg-populationen vælges blandt de levedygtige enkeltcellehændelser. (ii) Der udvælges derefter stamfaderer, der udtrykker c-kit og med lav til ingen udtryk for Sca-1 eller CD16/32 antigen. (iii) Cd9- og CD150-udtryksniveauer definerer fire cellepopulationer. MKp er defineret som CD9lyseCD150+ celler, MEP er defineret som CD9dimCD150+. Den højere grænse for CD9-udtrykket for CD9-dim CD150+ -populationen er baseret på det maksimale CD9-udtryksniveau for CD150- cellerne. Med henblik på analyse blev CD9dimCD150- celler (forfædre) og CD9-CD150- (Double Negative: DN) også sorteret. (C) Cellesorteringsporte er baseret på fluorescens Minus One (FMO) kontrol. (i) FMO kontrol for CD9 porte (ii) FMO kontrol for CD150 porte. Klik her for at se en større version af dette tal.

Figur 4: Karakterisering af parlamentsmedlemmets og MKp-cellepopulationerne. (A) Flowcytometrianalyse af (i) CD41-udtryk, (ii) CD42c-udtryk og (iii) DNA-indhold (Hoechst33342) i CD9+CD150dim (MEP) og CD9+CD150lyse (MKp) cellepopulationer. (B) Kvantificering af CFU-MK fra de sorterede cellepopulationer. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) og CD9+CD150lyse (MKp) cellepopulationer blev sorteret og belagt i kollagengel i henhold til producentens anvisninger. (C) Kvantificering af BFU-E fra de sorterede cellepopulationer. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) og CD9+CD150lyse (MKp) cellepopulationer blev sorteret og forgyldt i methyl cellulosegel i henhold til producentens anvisninger. Klik her for at se en større version af dette tal.

Figur 5: Mep's og MKps differentieringspotentiale. CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) og CD9+CD150lyse(MKp) cellepopulationer blev kultiveret i tre dage i StemSpan medium suppleret med SCF (7,5 ng/mL), Flt-3 (5 ng/mL), IL-6 (1 ng/mL) og TPO (10 ng/mL). (A) Repræsentative billeder blev taget ved fase-kontrast mikroskopi. (B) Procentdelen af CD41+CD42c+ megakaryocytter blev derefter vurderet ved flowcytometri. N = 3. (C) Ploidyniveauet for CD41+CD42c+ megakaryocytter blev derefter evalueret med Hoechst af Flow cytometri. N = 3. (D) Celler produceret på dag 3 fra CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP), og CD9+CD150lyse(MKp) cellepopulationer blev høstet og kultiveret i DMEM medium suppleret med 50 ng/mL TPO, 10 % Fosterkalv Serum og 100 U/mL hirudin. (i) Andelen af proplateletdannende megakaryocytter i kulturen blev bestemt af mikroskopisk observation. Megakaryocytter blev identificeret baseret på deres størrelse og / eller tilstedeværelsen af proplatelets. N = 2. (ii) Repræsentativt fotografi af en proplatelet, der bærer megakaryocyt ved fasekontrastmikroskopi. Klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den metode, der er beskrevet i dette papir giver mulighed for udvinding og rensning af mus MEP og MKp. En vigtig parameter i optimeringen af protokollen var at opnå et tilstrækkeligt antal celler, der ville være kompatible med de fleste molekylære- og cellulære analyser. Den generelle praksis med indsamling af museben til hæmatoopoietisk celleudvinding består normalt i at høste både lårben og skinneben i hver mus. Bækkenbenet, en anden kilde til hæmatoopoietisk materiale, overses således ofte. Årsagerne til ikke at indsamle iliac crest er den dårlige viden om den interne anatomi af musen skelet og det faktum, at brugerne er klassisk indsamling hindlimbs ved at skære på tværs eller lige over lårbenet hovedet. Derudover antages det ofte, at marvcellerne ikke ville blive skyllet ud af iliaca crest knoglen effektivt på grund af tilstedeværelsen af trabeculae, som er fraværende i den centrale del af skinnebenet og lårbenet. I denne protokol, disse to bekymringer er behandlet og en standardiseret, pålidelig, og tidseffektiv metode præsenteres, der giver mulighed for korrekt rødmen af hver hindlimb knogler, herunder bækken knogle. Især giver brugen af iliaca knoglen 105 ± 7 x 106 celler pr. mus, mens den klassiske metode normalt giver 42 ± 5 x 106 celler. En væsentlig fordel ved denne metode er reduktionen i antallet af dyr, der er nødvendige for at opnå et givet antal målceller, hvilket giver mere etiske og omkostningseffektive forsøgsbetingelser. Denne procedure gælder derfor også for enhver undersøgelse, der kræver knoglemarvscellesuspension, såsom isolering af hæmatoopoietiske stamceller10 eller analyse af hæmatoopoiettisk stamfaderadfærd under semifaste forhold11.
Celle sortering ved hjælp af flow cytometri er en kraftfuld teknik med en stor fordel i form af renhed i forhold til magnetiske berigelse teknikker, men udbyttet af celle sortering for sjældne populationer kan være lavere end for mere rigelige populationer. Magnetisk udtømning af uønskede celler på forhånd er derfor en nyttig metode til at øge hyppigheden af de celler af interesse. Her adskiller den magnetiske udtømningsprocedure sig fra producentens anbefaling og tager højde for heterogeniteten i udtrykket af de overflademarkører, der bruges til at fjerne de uønskede afstamningspositive celler. Med de typiske, et-trins protokoller vil afstamningspositive celler med det højeste udtryk for overflademarkører hurtigt mætte de magnetiske perler. De vil forhindre efterfølgende fangst af de resterende mærkede celler ved konkurrence og sterisk hindring, hvilket reducerer udtømningseffekten betydeligt. For at løse dette problem blev der designet en to-trins magnetisk udtømning, der giver mulighed for sekventiel fjernelse af alle slægtspositive celler, hvilket giver mulighed for strenge udtømninger, der er egnede til cellesortering.
En anden kritisk parameter for at opnå en effektiv udtømning er de relevante mærkningsbetingelser for de uønskede slægtspositive celler. Antistoftreringen er derfor specielt optimeret. Ved hjælp af højere koncentrationer af antistoffer vil resultere i overdreven rosetter af de magnetiske perler og den ikke-specifikke udtømning af afstamning-negative celler af interesse. Brugen af stærkt rensede MEP- og MKp-cellepopulationer er et vigtigt redskab i studiet af megakaryopoiesis. For at belyse de mekanismer, der styrer denne proces, undersøgte undersøgelsen det cellulære mikromiljøs rolle og har vist, at en føtal levercelle stromal cellepopulation ville understøtte differentiering af MKp10. Den sorterede population kan også bruges til molekylære eller enkeltcellebaserede analyser. Dette vil være særlig relevant i betragtning af den nye opfattelse af megakaryocyt-partiske HSC12,13,14. Produktionen af megakaryocyt direkte fra HSC-befolkningen uden generering af en bipotent stamfader ville være en nødvej som reaktion på stress13.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne erklærer ingen konkurrerende finansielle interesser.
Acknowledgments
Forfatterne vil gerne takke Monique Freund, Catherine Ziessel og Ketty for teknisk bistand. Dette arbejde blev støttet af ARMESA (Association de Recherche et Développement en Médecine et Santé Publique) og af Grant ANR-17-CE14-0001-01 til Henri.de la. Salle.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
Biologi udgave 171Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
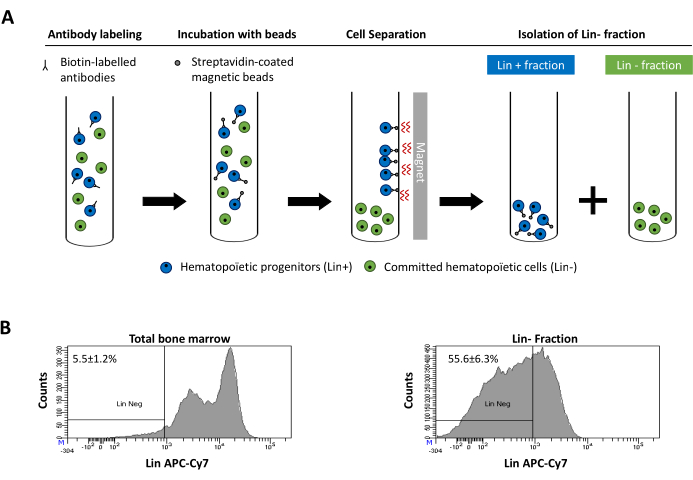
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
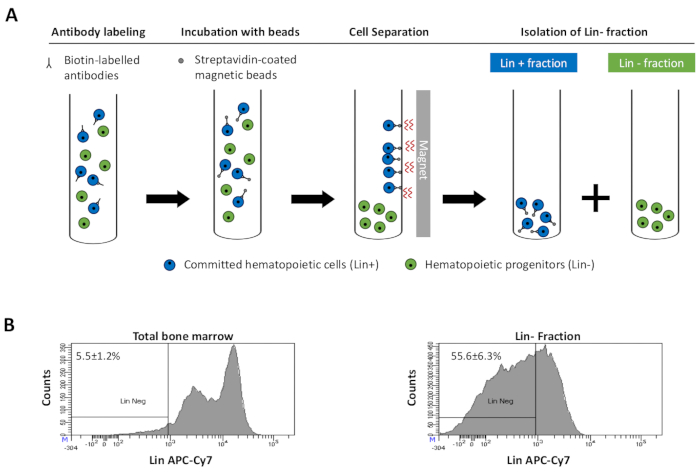
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



