ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Denna metod beskriver rening genom flöde cytometri av MEP och MKp från möss lårben, skenben och bäckenhålorna ben.
Abstract
Benmärg megakaryocyter är stora polyploida celler som säkerställer produktionen av blodplättar. De uppstår från hematopoetiska stamceller genom megakaryopoiesis. De sista stadierna av denna process är komplexa och klassiskt involvera bipotenta Megakaryocyte-Erythrocyte Progenitors (MEP) och den enpotenta Megakaryocyte Progenitors (MKp). Dessa populationer föregår bildandet av äkta megakaryocyter och som sådan kan deras isolering och karakterisering möjliggöra robust och opartisk analys av megakaryocytbildning. Detta protokoll presenterar i detalj förfarandet för att samla hematopoetiska celler från mus benmärg, berikning av hematopoetiska stamceller genom magnetisk utarmning och slutligen en cell sortering strategi som ger mycket renade MEP och MKp populationer. För det första samlas benmärgsceller in från lårbenet, skenbenet och även iliaca-krönet, ett ben som innehåller ett stort antal hematopoetiska stamceller. Användningen av iliaca crest ben ökar drastiskt det totala antalet erhållna per mus och bidrar därmed till en mer etisk användning av djur. En magnetisk härstamning utarmning optimerades med hjälp av 450 nm magnetiska pärlor vilket möjliggör en mycket effektiv cell sortering efter flöde cytometri. Slutligen presenterar protokollet märknings- och gatingstrategin för sortering av de två högt renade megakaryocytprogenitorpopulationerna: MEP (Lin-Sca-1-c-Kit+CD16/32-CD150+CD9dim) och MKp (Lin- Sca-1-c-Kit+CD16/32-CD150+CD9bright ). Denna teknik är lätt att implementera och ger tillräckligt cellulärt material för att utföra i) molekylär karakterisering för en djupare kunskap om deras identitet och biologi, ii) in vitro differentieringsanalyser, som kommer att ge en bättre förståelse för mekanismerna för mognad av megakaryocyter, eller iii) in vitro-modeller av interaktion med deras mikromiljö.
Introduction
Blodplättar produceras av megakaryocyter. Dessa stora polyploida celler finns i benmärgen och som för alla blodkroppar härrör de från hematopoetiska stamceller (HSC)1. Den klassiska produktionsvägen för megakaryocyter i benmärgen härstammar från HSC och involverar generering av olika föregångare som gradvis begränsar deras differentieringspotential2. Den första föregångaren som undertecknar åtagandet för den megakaryocytiska härstamningen är Megakaryocyte-Erythrocyte Progenitor (MEP), en bipotent stamfader som kan producera både erytroidceller och megakaryocyter3,4,5. Parlamentsledamoten producerar sedan en enpåtagen föregångare/föregångare (MKp) som kommer att differentieras till en mogen megakaryocyt som kan producera trombocyter. De mekanismer som är involverade i genereringen av dessa föregångare, liksom deras differentiering och mognad i megakaryocyter är komplexa och endast delvis förstådda. Dessutom är det fortfarande oklart om europaparlamentets befolkning är heterogen när det gäller differentieringspotential och den inneboende engagemangsnivån för dessa celler. För att dechiffrera dessa processer är det viktigt att få (eller ha tillgång till) renade populationer av parlamentsledamot och MKp för fina molekylära och encelliga analyser.
Flera studier har visat särskilda kombinationer av cellytans markörer för identifiering av stamceller som är engagerade i den megakaryocytiska härstamningen i musen6,7,8. Från dessa utformades en metod som möjliggör rening av parlamentsledamot och MKp från möss. Denna metod optimerades för att erhålla celler i tillräckligt antal och kvalitet för ett stort antal analyser. Med etiska överväganden i åtanke, och för att minimera antalet djur som deltar i experimenten, framkallade vi att skörda benmärgen från lårbenet och skenbenet, och även från iliaca crest. Detta ben innehåller en hög frekvens och antal hematopoetiska stamceller och skadas för det mesta under lång benskörd. Presenteras här är en detaljerad metod för tillförlitlig insamling av detta ben.
Det andra optimeringskriterierna är att producera högt renade cellpopulationer. Fluorescerande aktiverad cellsortering (FACS) är en valfri metod för att erhålla renade populationer av celler av intresse. Låga utbyten uppnås dock när cellpopulationen av intresse är mycket sällsynt. Anrikningsförfaranden är därför nödvändiga. I detta protokoll valdes en negativ urvalsprocedur med hjälp av magnetiska pärlor.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Protokoll som gällde djur har utförts i enlighet med CREMEAS Committee on the Ethics of Animal Experiments vid universitetet i Strasbourg (Comité Régional d'Ethique en Matière d'Expérimentation Animale Strasbourg. Tillståndsnummer: E67-482-10).
1. Insamling av musben
- Offra djuret i enlighet med de institutionella riktlinjerna.
OBS: De data som presenteras i detta manuskript erhölls från C57Bl/6 möss av 8 till 12 veckor gamla. Antalet celler som erhålls och frekvensen av citerade populationer kan variera med ålder och mus stam. - Spraya kroppen med 70% etanol.
- Använd sax, gör ett 0,5-1 cm snitt av huden vinkelrätt mot ryggraden och riva huden runt hela kroppen. Dra ner huden från underkroppen och ta bort huden.
- Placera djuret på dissekeringsplattan, vänd nedåt. Hitta bäckenbenen genom att skjuta fingrarna längs den exponerade ryggraden från toppen till botten. För att lokalisera iliac crest, identifiera den lilla gupp i ländryggen regionen nära hindlimbs (anterosuperior regionen bäckenbenet). Figur 1A,B presenterar en schematisk representation av musens anatomi.

Bild 1: Musanatomi( A) Musröntgen som visar bakbenen. Notera utrymmet mellan bäckenbenet och ryggraden (gul pil), där saxen måste sättas in för att ordentligt separera baklimbsna från musens kropp (gul prickad linje). (B) Schematisk representation av de benmärgsrika ben av intresse. Bäckenbenen avbildas i rött, lårbenen i lila och skenbenen i grönt. (C) Schematisk representation av mus bäckenbenet. Ilium motsvarar den märgrika delen av bäckenbenet och är markerat i rött. Klicka här för att se en större version av den här figuren.
- Placera saxen parallellt med ryggraden mot ryggkotorna och nära iliaca crest bump. Fortsätt att skära musklerna längs sidan av ryggraden ovanför bäckenbenet genom att skjuta saxen längs kotorna hela vägen ner till svansen.
OBS: Denna första del av musklerna kan också utföras med hjälp av ett skalpellblad. - Placera saxen parallellt med ryggraden och fortsätt att skära mellan ryggkotorna och iliaca-krönet, vilket anges av den gula prickade linjen på figur 1A. Se till att hålla dig så nära kotorna som möjligt. Skär de återstående musklerna för att lossa lemmen från kroppen.
OBS: Det bör finnas lite eller inget motstånd. - Upprepa på andra sidan för att lossa den andra delen.
- Överför lemmarna på en ren yta och kassera resten av kroppen i enlighet med de institutionella riktlinjerna.
- Exponera bäcken-, lårbens- och tibialbenen genom att ta bort så mycket omgivande vävnad som möjligt med tången och skalpellarna.
- Fortsätt att försiktigt flytta lårbenshuvudet från bäckenbenet genom att hålla lårbenets distala ände med tången medan du försiktigt skär musklerna runt artikulationen med skalpellarna. Vicka på benen för att underlätta förskjutningen.
- Skrapa av den återstående muskeln från bäckenbenet och skär med en skalpell i mitten av håligheten som höll lårbenets huvud. Iliumet hålls eftersom det är rikt på hematopoetiska stamceller medan den triangulära mycket tunna sidan av benet kasseras, som visas i figur 1C.
- Ta bort restvävnaderna runt iliumet med skalpellen och placera det rengjorda benet i steril PBS kompletterat med 2% nyfött kalvserum (PBS-2%NBCS).
- Skär av foten från benet vid fotleden med hjälp av en sax.
- Håll den nedre delen av skenbenet med tången och skrapa muskeln upp mot knäet. Kassera vadbenet och skär över tibialplatån med skalpellen. Placera skenbenet i steril PBS-2%NBCS.
- Ta bort de kvarvarande vävnaderna runt lårbenet med skalpeller.
- Håll lårbenets övre sida med tång; placera skalpellbladet vid knäskålens botten. Applicera en kraft mot knäskålen parallellt med lårbenet tills knäskålen lossnar. Placera lårbenet i steril PBS-2%NBCS. Avlägsnande av knäskålen ger en ren åtkomst för att sätta in nålen för märgspolning.
2. Magnetisk utarmning av härstamningspositiva celler
- I ett laminärt flödesskåp överför du benen i en steril Petri-skål fylld med steril PBS-2%NBCS.
- Med en skalpell skär av lårbenens huvud.
- Fyll en 1 ml spruta med steril PBS-2%NBCS och fäst en 21 G nål på utloppet.
- Fyll ett 5 ml polypropylenrör med 2 ml steril PBS-2%NBCS.
- Håll lårbenet med tångarna; sätt försiktigt in nålen i spåret som lämnas efter att knäskålen avlägsnats. Applicera rotation på nålen medan du sätter in för att undvika att nålen pluggas. Se till att nålen är helt försatt i benet upp till avfasningen.
- Överför benet med nålen till röret som innehåller 2 ml PBS-2%NBCS. Dispensera och aspirera PBS-2%NBCS från sprutan tills benet är klart.
- Ta bort nålen från lårbenet och sätt in den i hålet på motsatt sida där lårbenets huvud var. Dispensera och aspirera bufferten igen och kassera benet.
- För iliaca-krönet och skenbenet, håll benet med tångarna; för försiktigt in nålen på den öppna sidan. Applicera rotation på nålen medan du sätter in för att undvika att nålen pluggas. Se till att nålen är helt försatt i benet upp till avfasningen. Överför benet med nålen till röret som innehåller 2 ml PBS-2%NBCS. Dispensera och aspirera PBS-2%NBCS från sprutan tills benet är klart. Kasta benen.
OBS: Ben från upp till tre möss kan spolas i samma rör. Poola cellupphängningarna. - Passera den poolade cellupphängningen genom ett 40 μm cellsillock placerat på ett sterilt 5 ml polystyrenrör.
- Fortsätt att räkna cellerna.
OBS: Cellantal kan utföras med vilken hemocytometer som helst, med Trypan Blue för lönsamhetsbedömning eller med någon automatiserad cellräknare. En mus ger vanligtvis 105 ± 7 x 106 celler. - Ta bort 100 μL av cellupphängningen som total benmärg, tillsätt 500 μL PBS-2%NBCS och spara det på is för färgningsförfarandet.
- Pellet den filtrerade suspensionen genom centrifugering vid 400 x g i 5 min vid 4 °C och kassera supernatanten.
OBS: Röda blodkroppar kan lyseras genom att återanvända pelleten i nyberedd Lysis-lösning (1/10i dH2O). Inkubera i 5 min tills suspensionen blir klar och ljusröd och tillsätt 10 volymer steril PBS. Fortsätt att tvätta cellerna i PBS-2%NBCS genom centrifugering vid 400 x g i 5 minuter vid 4 °C. Var försiktig när du tar bort supernatanten eftersom cellpelleten är mycket lös. Utför en andra tvätt med PBS-2%NBCS genom centrifugering vid 400 x g i 5 min vid 4 °C och fortsätt till steg 2,13. - Återutnyttja cellpelleten i nyberedd primär antikroppscocktail med ett förhållande på 100 μL per 1 x 107 celler. Inkubera på is i 30-45 min.
| Antikropp | Utspädning |
| Gr-1-biotin | 1:500 |
| B220-biotin | 1:500 |
| Mac-1-biotin | 1:500 |
| CD3-biotin | 1:500 |
| CD4-biotin | 1:500 |
| CD5-biotin | 1:500 |
| CD8-biotin | 1:500 |
| TER119-biotin | 1:1000 |
| CD127-biotin | 1:500 |
Tabell 1.
- Ta bort 10 μL av cellupphängningen i ett sterilt 5 ml polystyrenrör märkt Lin-Pos Fraction. Tillsätt 90 μL PBS-2%NBCS och spara det på is för färgningsförfarandet.
- Fortsätt att tvätta cellerna två gånger med steril PBS-2%NBCS genom centrifugering vid 400 x g i 5 min vid 4 °C. Se till att göra den sista tvätten i ett sterilt 5 ml polypropylenrör.
- Under tvättstegen förbereder du pärlorna för den magnetiska utarmningen.
- Resuspend pärlorna i injektionsflaskan genom att noggrant virvla i 30 s.
- Överför en volym pärlor som motsvarar två pärlor per målcell till ett 5 ml polypropylenrör.
- Tvätta pärlorna två gånger med PBS-2%NBCS genom att placera röret på magneten och ta bort tvättbufferten med en steril pasteurpipett av glas.
- Återsuspend pärlor i 500 μL steril PBS-2NBCS%.
- Återanvänd pelleten av märkta celler i 250 μL pärlor och blanda försiktigt i 5 min på is. Tillsätt 2 ml steril PBS-2%NBCS och blanda försiktigt. Skaka inte röret.
- Placera röret på magneten i 2 minuter.
- Fortsätt att samla den icke-magnetiska fraktionen med en steril pasteurpipeett i glas och lägg den på de återstående 250 μL magnetiska pärlor. Försegla röret med parafilm.
- Placera röret på en rörrulle i 20 min vid 4 °C.
- Tillsätt 2 ml steril PBS-2%NBCS och blanda försiktigt. Skaka inte röret.
- Placera röret i magneten i 2 min.
- Fortsätt att samla den icke-magnetiska fraktionen i ett sterilt 5 ml polypropylenrör märkt Lin-Neg Fraction med en steril pasteurpipeett i glas.
- Pellet cellerna genom centrifugering vid 400 x g i 5 min vid 4 °C och ta bort supernatanten.
- Återanvänd de icke-magnetiska cellerna i 500 μL steril PBS-2%NBCS.
- Fortsätt att räkna cellerna.
OBS: En mus ger vanligtvis 3,9 ± 1,1 x 106 celler. Typisk härstamning av färgning före och efter utarmning presenteras i figur 2B.
3. Cellsortering av megakaryocytprogenitorer efter flödescytometri
- Ta rören märkta Total Bone Marrow, Lin-Pos Fraction och Lin-Neg Fraction.
- Fortsätt att dela upp innehållet i röret Total Bone Marrow lika i sex sterila 5 ml polystyrenrör. Märk rören med siffrorna 1-6.
- Fortsätt att märka röret Lin-Pos Fraction med siffran 7.
- Fortsätt att dela innehållet i röret Lin-Neg Fraction enligt följande.
- Överför 50 μL till ett sterilt 5 ml polystyrenrör som innehåller 250 μL steril PBS-2%NBCS. Dela sedan innehållet lika i 3 sterila 5 ml polystyrenrör. Märk dessa rör med siffrorna 8-10.
- De återstående 450 μL Lin-Neg Fraction cell suspensionen motsvarar röret med siffran 11.
- Tillsätt antikropparna i rören enligt tabell 2.
| Rör | Etikett | Antikroppscocktail |
| Totalt benmärg | ||
| 1 | Oförberövad kontroll | |
| 2 | Enkel färgad kontroll | CD45-FITC (1/200) |
| 3 | Enkel färgad kontroll | CD45-PE (1/200) |
| 4 | Enkel färgad kontroll | TER119-APC (1/200) |
| 5 | Enkel färgad kontroll | CD45-PECy7 (1/200) |
| 6 | Enkel färgad kontroll | CD45-APC-Cy7 biotin (1/200) |
| Lin-Pos fraktion | ||
| 7 | Enkel färgad kontroll | Enkel fläckig kontroll. Streptavidin-APC-Cy7 (1/500) |
| Lin-Neg fraktion | ||
| 8 | FMO FITC-kontroll | c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 9 | FMO PE-kontroll | CD9-FITC (1/200) + c-kit-APC (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 10 | FMO PECy7-kontroll | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + Streptavidin-APC-Cy7 (1/500) |
| 11 | Positivt rör för sortering | CD9-FITC (1/200) + c-kit-APC (1/200) + Sca-1-PE (1/200) + CD16/32-PE (1/200) + CD150-PECy7 (1/200) + Streptavidin-APC-Cy7 (1/500) |
Tabell 2.
- Inkubera på is i 30-45 min i mörkret.
- Tvätta cellerna med steril PBS-2%NBCS genom centrifugering vid 400 x g i 5 min vid 4 °C.
- Återanvänd cellpelletsen enligt följande.
- För rören 1–10 ska pelleten återanvändas i 300 μL steril PBS-2%NBCS kompletterad med 7AAD (2,5 μg/ml final) (PBS-7AAD).
VARNING: 7AAD är ett DNA-interkalant och måste därför hanteras med lämpliga PPE (handskar). - För rör 11 ska pelleten återanvändas i steril PBS-7AAD vid en maximal koncentration på 5 x 106 celler per ml och en minsta volym på 1 ml.
- För rören 1–10 ska pelleten återanvändas i 300 μL steril PBS-2%NBCS kompletterad med 7AAD (2,5 μg/ml final) (PBS-7AAD).
- Förbered två uppsamlingsrör för polypropylen märkta MEP och MKp som innehåller 2 ml PBS-2%NBCS.
OBS: Alternativt kan celler samlas in i odlingsmedium- eller celllysbuffert beroende på den efterföljande applikationen för de sorterade cellerna. Användning av polystyrenrör rekommenderas inte på grund av eventuell interferens med de laddade dropparna som innehåller de celler av intresse. - Håll alla rör på is i mörkret.
- Fortsätt till cellsorteraruppsättningen.
- Använd rören 1-7 för att ställa in spänning och kompensation, rör 7-10 för att bestämma sorteringsportarna för cellpopulationerna av intresse och rör 11 för cellsortering.
- De första stegen i gatingstrategin syftar till att utesluta dubbningar och döda celler från analysen, enligt beskrivningen i figur 3. Identifiera enstaka livskraftiga celler och visa SSC-vs Lin-APC-Cy7 prickdiagram för att bekräfta effektiviteten i härstamningen utarmning. Från Lin- celler är en grind inställd för att markera celler positiva för c-kit och negativa eller dim för Sca-1 och CD16/32. En CD9 vs CD150 uttrycks prick plot för de valda cellerna gör det möjligt att identifiera fyra populationer.
OBS: Parlamentsledamöternas och MKp-cellerna är båda positiva för CD150. Tre uttrycksnivåer för CD9 kan definieras (neg, dim och hög). MKp uttrycker hög nivå av CD9 och parlamentsledamot express CD9 på en mellanliggande fluorescensintensitetsnivå. Parlamentsledamots befolkning motsvarar Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9dim och MKp-populationen motsvarar Lin- c-Kit+ Sca-1-CD16/32-/dim CD150+ CD9ljus. Diskrimineringen mellan CD9-hög- och CD9-dimpopulationer för cd150-positiva celler fastställs baserat på den maximala cd9-uttrycksnivån i den negativa CD150-populationen. En mus ger vanligtvis 5,3 ± 0,6 x 103 MKp och 27,2 ± 2,4 x 103 MEP.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Fenotypisk analys av de celler som identifierats som MEP och MKp utfördes av flöde cytometri. Cellerna var märkt med fluorescence konjugerade antikroppar mot CD41a och CD42c, klassiska markörer för megakaryocytic och trombocyt härstamningar. Båda markörerna uttrycktes av cellerna i MKp-populationen medan dessa markörer ännu inte har upptäckts vid ytan av cellerna i den mesiska befolkningen (figur 4Ai,4Aii). Polyploidy är ett kännetecken för megakaryocyter. DNA-halten i de sorterade populationerna analyserades också och visade att cellerna mestadels är 2N för MEP-populationen och en liten andel av MKp-cellerna är 4N, men högre ploidy detekteras inte signifikant i dessa populationer (figur 4Aiii).
För att bekräfta identiteten av sorterade cellpopulationer utfördes flera differentieringsanalyser för att utvärdera deras förmåga att skilja sig mot megakaryocytic och erythroid härstamningar. Först utfördes halvfasta klonogena analyser för att kvantifiera megakaryocytisk stamfader (CFU-MK) och erythroid-stamceller (BFU-E). CFU-MK upptäcktes i både parlaments- och MKppopulationer men inte i den andra testade populationen (figur 4B). BFU-E upptäcktes inte i MKp-populationen men upptäcktes i europaparlamentets befolkning och befolkningen i CD150-CD9dimcell (figur 4C).
Differentieringen av de sorterade cellerna följdes också i flytande kultur i närvaro av en låg koncentration av hematopoetiska cytokiner. Representativa bilder från mikroskopisk observation på den3: e dagen av differentiering visar att parlamentsledamot och MKp producerade huvudsakligen megakaryocyter som identifieras som stora celler (figur 5Aiii,5Aiv). Megakaryocyter identifierades med CD41- och CD42c-uttryck och representerar 53,9 ± 10, 4% respektive 82,0 ± 2, 0% av de celler som produceras från MEP respektive MKp cellpopulationer (figur 5B). Märkbart var ploidy av megakaryocyter producerade analyserade med HJÄLP AV DNA-markör Hoescht 33242, större för megakaryocyten som härrör från MKp-befolkningen jämfört med MEP-befolkningen som tyder på ett mer moget tillstånd (figur 5C). Slutligen utsattes de celler som producerades från varje population den 3rd dagen för en proplateletbildningsanalys9. Det observerades att endast de celler som härrörde från MKp-populationen kunde driva utsläpp i detta tillstånd(figur 5D). Detta tyder på ett mer avancerat mognadsstadium för MKp-befolkningen. När odlingstiden förlängs upp till 4-5 dagar kommer dessutom megakaryocyter från parlamentsledamoten också att förlänga proplatelets.

Figur 2: Magnetisk utarmning av härstamningsceller (Lin). För det första är osorterade benmärgsceller märkta med den biotinkonjugerade råtta antimus antikroppscocktailen. Cellerna inkuberas sedan med anti-råtta Ig-belagda magnetiska pärlor och utsätts därefter för magnetisk utarmning med hjälp av en stark magnet. Magneten behåller den märkta magnetiska Lin+-fraktionen mot rörväggarna, medan den omärkta icke-magnetiska linnegativa fraktionen samlas i ett nytt rör. b)Härstamning engagerade celler kan identifieras med hjälp av fluorescerande konjugerade streptavidin. Typisk analys av härstamningsuttrycket i celler före magnetisk utarmning (total benmärg) och efter magnetisk utarmning (Lin- Fraction) N = 21. Klicka här för att se en större version av den här figuren.

Bild 3: Strategi förcellsortering. (A) Urval av händelser som motsvarar livskraftiga enskilda celler. b)Val av ledamöter av ledamöter och ledamöter av MKp. i) Lin Neg-populationen väljs ut bland de livskraftiga encellshändelserna. ii)Stamceller som uttrycker c-kit och med lågt eller inget uttryck för Sca-1- eller CD16/32-antigen väljs sedan. iii)CD9- och CD150-uttrycksnivåerna definierar fyra cellpopulationer. MKp definieras som CD9ljusaCD150+ celler, MEP definieras som CD9dimCD150+. Den högre gränsen för CD9-uttrycket för CD9dimCD150+ populationen baseras på den maximala CD9-uttrycksnivån för CD150-cellerna. För analysen sorterades cd9dimCD150- celler (Stamceller) och CD9-CD150- (Dubbelnegativ: DN) också. (C) Cellsorteringsgrindar är baserade på Fluorescence Minus One (FMO) kontroller. i)FMO-kontroll för CD9-grindar( ii) FMO-kontroll för CD150-grindar. Klicka här för att se en större version av den här figuren.

Figur 4: Karakterisering av mep- och MKp-cellpopulationerna. (A) Flödescytometrianalys av( i) CD41-uttryck,ii) CD42c-uttryck ochiii) DNA-innehåll (Hoechst33342) i cellpopulationerna CD9+CD150dim (MEP) och CD9+CD150ljus (MKp). b)Kvantifiering av CFU-MK från de sorterade cellpopulationerna. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) och CD9+CD150ljusa (MKp) cellpopulationer sorterades och pläterades i kollagengel enligt tillverkarens instruktioner. c)Kvantifiering av BFU-E från de sorterade cellpopulationerna. CD9-CD150- (DN), CD9+CD150- (Prog), CD9+CD150dim (MEP) och CD9+CD150ljusa (MKp) cellpopulationer sorterades och pläterades i metylcellulosagel enligt tillverkarens instruktioner. Klicka här för att se en större version av den här figuren.

Figur 5: Differentieringspotential för parlamentsledamöterna och MKp. CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) och CD9+CD150ljusa(MKp) cellpopulationer odlades i tre dagar i StemSpan medium kompletterat med SCF (7,5 ng/mL), Flt-3 (5 ng/mL), IL-6 (1 ng/mL) och TPO (1 ng/mL). (A) Representativa bilder togs genom faskontrastmikroskopi. (B) Procentandelen CD41+CD42c+ megakaryocyter bedömdes sedan efter flödescytometri. N = 3. (C) Ploidy-nivån hos CD41+CD42c+ megakaryocyterna utvärderades sedan med Hoechst by Flow cytometri. N = 3. (D) Celler som produceras på dag 3 från CD9-CD150-(DN), CD9+CD150-(Prog), CD9+CD150dim(MEP) och CD9+CD150ljusa(MKp) cellpopulationer skördades och odlades i DMEM-medium kompletterat med 50 ng/mL TPO, 10 % Fetal Calf Serum och 100 U/mL hirudin. i) Andelen proplateletbildande megakaryocyter i kulturen bestämdes av mikroskopisk observation. Megakaryocyter identifierades baserat på deras storlek och/eller förekomsten av proplatelets. N = 2. ii) Representativt fotografi av en proplatelet med megakaryocyt genom mikroskopi med faskontrast. Klicka här för att se en större version av den här figuren.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Metoden som beskrivs i detta dokument möjliggör extraktion och rening av mus mep och MKp. En viktig parameter i optimeringen av protokollet var att få tillräckligt antal celler som skulle vara kompatibla med de flesta molekylär- och cellbaserade analyser. Den allmänna praxisen för musben insamling för hematopoetisk cell extraktion består vanligtvis i att skörda både lårbenet och skenbenet i varje mus. Bäckenbenet, en annan källa till hematopoetetiskt material, förbises därför ofta. Anledningen till att inte samla iliaca crest är den dåliga kunskapen om musskelettets inre anatomi och det faktum att användare klassiskt samlar hindlimbs genom att skära över eller strax ovanför lårbenets huvud. Dessutom antas det ofta att märgcellerna inte skulle spolas ut ur iliac crest-benet effektivt på grund av närvaron av trabeculae, som är frånvarande i den centrala delen av skenbenet och lårbenet. I detta protokoll behandlas dessa två problem och en standardiserad, tillförlitlig och tidseffektiv metod presenteras som möjliggör korrekt spolning av varje hindlimb ben, inklusive bäckenhålorna ben. I synnerhet ger användningen av iliaca-benet 105 ± 7 x 106 celler per mus medan den klassiska metoden vanligtvis ger 42 ± 5 x 106 celler. En stor fördel med denna metod är minskningen av antalet djur som krävs för att erhålla ett visst antal målceller, vilket ger mer etiska och kostnadseffektiva försöksbetingelser. Detta förfarande är därför också tillämpligt för alla studier som kräver benmärgscellsavstängning såsom isolering av hematopoetiska stamceller10 eller analys av hematopoetiskt stambeteende i halvfasta förhållanden11.
Cellsortering med flödescytometri är en kraftfull teknik med en stor fördel när det gäller renhet jämfört med magnetiska anrikningstekniker, men utbytet av cellsortering för sällsynta populationer kan vara lägre än för mer rikliga populationer. Magnetisk utarmning av oönskade celler i förväg är därför en användbar metod för att öka frekvensen av de celler som är av intresse. Här skiljer sig den magnetiska utarmningsförfarandet från tillverkarens rekommendation och tar hänsyn till heterogeniteten i uttrycket av de ytmarkörer som används för att ta bort de oönskade härstamningspositiva cellerna. Med de typiska protokollen i ett steg kommer härstamningspositiva celler med det högsta uttrycket av ytmarkörer snabbt att mätta de magnetiska pärlorna. De kommer att förhindra efterföljande fångst av de återstående märkta cellerna genom konkurrens och steric hinder, vilket avsevärt minskar utarmningseffektiviteten. För att ta itu med detta problem utformades en tvåstegs magnetisk utarmning som möjliggör sekventiell borttagning av alla härstamningspositiva celler, vilket möjliggör stränga utarmningar som är lämpliga för cellsortering.
En annan kritisk parameter för att uppnå en effektiv utarmning är lämpliga märkningsförhållanden för de oönskade härstamningspositiva cellerna. Antikroppstitrering har därför optimerats specifikt. Användning av högre koncentrationer av antikroppar kommer att resultera i överdriven rosettering av de magnetiska pärlor och icke-specifik utarmning av härstamningsnegativa celler av intresse. Användningen av högt renade mep- och MKp-cellpopulationer är ett viktigt verktyg i studien av megakaryopoiesis. För att klargöra mekanismerna som styr denna process undersökte studien den cellulära mikromiljöns roll och har visat att en fetal levercells stromal cellpopulation skulle stödja differentiering av MKp10. Den sorterade populationen kan också användas för molekylära eller encellsbaserade analyser. Detta kommer att vara särskilt relevant med tanke på det framväxande begreppet megakaryocytbiasbias med HSC12,13,14. Produktionen av megakaryocyt direkt från HSC-befolkningen utan generering av en bipotent stamfader skulle vara en nödväg som svar på stress13.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna förklarar inga konkurrerande ekonomiska intressen.
Acknowledgments
Författarna vill tacka Monique Freund, Catherine Ziessel och Ketty för tekniskt stöd. Detta arbete stöddes av ARMESA (Association de Recherche et Développement en Médecine et Santé Publique) och av Grant ANR-17-CE14-0001-01 till Henri.de la. Salle.
Materials
| Name | Company | Catalog Number | Comments |
| 21-gauge needles | BD Microlance | 301155 | |
| 7AAD | Sigma-Aldrich | A9400 | |
| Antibody Gr-1-biotin | eBioscience | 13-5931-85 | Magnetic depletion |
| Antibody B220-biotin | eBioscience | 13-0452-85 | Magnetic depletion |
| Antibody Mac-1-biotin | eBioscience | 13-0112-85 | Magnetic depletion |
| Antibody CD3e-biotin | eBioscience | 13-0031-85 | Magnetic depletion |
| Antibody CD4-biotin | eBioscience | 13-9766-82 | Magnetic depletion |
| Antibody CD5-biotin | eBioscience | 13-0051-85 | Magnetic depletion |
| Antibody CD8a-biotin | eBioscience | 13-0081-85 | Magnetic depletion |
| Antibody TER119-biotin | eBioscience | 13-5921-85 | Magnetic depletion |
| Antibody CD127-biotin | eBioscience | 13-1271-85 | Magnetic depletion |
| Antibody CD45-FITC | eBioscience | 11-0451-85 | Cell sorting |
| Antibody CD45-PE | eBioscience | 12-0451-83 | Cell sorting |
| Antibody TER119-APC | eBioscience | 17-5921-83 | Cell sorting |
| Antibody CD45-PECy7 | eBioscience | 25-0451-82 | Cell sorting |
| Antibody CD45-biotin | eBioscience | 13-0451-85 | Cell sorting |
| Antibody CD9-FITC | eBioscience | 11-0091-82 | Cell sorting |
| Antibody c-kit-APC | eBioscience | 17-1171-83 | Cell sorting |
| Antibody Sca-1-PE | eBioscience | 12-5981-83 | Cell sorting |
| Antibody CD16/32-PE | eBioscience | 12-0161-83 | Cell sorting |
| Antibody CD150-PECy7 | eBioscience | 25-1502-82 | Cell sorting |
| Culture medium StemSpan-SFEM | Stemcell technologies | #09650 | |
| Dissection pad | Fisher Scientific | 10452395 | |
| DPBS | Life Technologies | 14190-094 | |
| Ethanol | vWR Chemicals | 83813.360 | |
| Forceps | Euronexia | P-120-AS | |
| Glass pasteur pipette | Dutscher | 42011 | |
| Magnet : DynaMag-5 | Thermo Fisher Scientific | 12303D | |
| Magnetic beads: Dynabeads Sheep Anti-Rat IgG | Thermo Fisher Scientific | 11035 | |
| Megacult | Stemcell technologies | #04970 | |
| MethoCult SF M3436 | Stemcell technologies | #03436 | |
| Newborn Calf Serum | Dutscher | 50750-500 | |
| Red Cell Lysis solution | BD Bioscience | 555899 | |
| Scalpels | Fisher Scientific | 12308009 | |
| Scissors | Euronexia | C-165-ASB | |
| Sterile 1 mL syringes | BD Bioscience | 303172 | |
| Sterile 15mL tubes | Sarstedt | 62.554.502 | |
| Sterile 5mL polypropylene tubes | Falcon | 352063 | |
| Sterile 5mL polystyrene tubes | Falcon | 352054 | |
| Sterile tubes with 70µm cell strainer cap | Falcon | 352235 | |
| Sterile petri dish | Falcon | 353003 | |
| Streptavidin-APC-Cy7 | BD Biosciences | 554063 | Cell sorting |
| Tube roller | Benchmark Scientific | R3005 |
References
- Kaushansky, K. Historical review: megakaryopoiesis and thrombopoiesis. Blood. 111 (3), 981-986 (2008).
- Akashi, K., Traver, D., Miyamoto, T., Weissman, I. L. A clonogenic common myeloid progenitor that gives rise to all myeloid lineages. Nature. 404 (6774), 193-197 (2000).
- Debili, N., et al. Characterization of a bipotent erythro-megakaryocytic progenitor in human bone marrow. Blood. 88 (4), 1284-1296 (1996).
- Forsberg, E. C., Serwold, T., Kogan, S., Weissman, I. L., Passegué, E. New evidence supporting megakaryocyte-erythrocyte potential of flk2/flt3+ multipotent hematopoietic progenitors. Cell. 126 (2), 415-426 (2006).
- Vannucchi, A. M., et al. Identification and characterization of a bipotent (erythroid and megakaryocytic) cell precursor from the spleen of phenylhydrazine-treated mice. Blood. 95 (8), 2559-2568 (2000).
- Pronk, C. J., et al. Elucidation of the phenotypic, functional, and molecular topography of a myeloerythroid progenitor cell hierarchy. Cell Stem Cell. 1 (4), 428-442 (2007).
- Nakorn, T. N., Miyamoto, T., Weissman, I. L. Characterization of mouse clonogenic megakaryocyte progenitors. Proceedings of the National Academy of Sciences of the United States of America. 100 (1), 205-210 (2003).
- Ng, A. P., et al. Characterization of thrombopoietin (TPO)-responsive progenitor cells in adult mouse bone marrow with in vivo megakaryocyte and erythroid potential. Proceedings of the National Academy of Sciences of the United States of America. 109 (7), 2364-2369 (2012).
- Strassel, C., et al. Hirudin and heparin enable efficient megakaryocyte differentiation of mouse bone marrow progenitors. Experimental Cell Research. 318 (1), 25-32 (2012).
- Brouard, N., et al. A unique microenvironment in the developing liver supports the expansion of megakaryocyte progenitors. Blood Advances. 1 (21), 1854-1866 (2017).
- Boscher, J., Gachet, C., Lanza, F., Léon, C. Megakaryocyte culture in 3D methylcellulose-based hydrogel to improve cell maturation and study the impact of stiffness and confinement. Journal of Visualized Experiments:JOVE. , (2021).
- Sanjuan-Pla, A., et al. Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature. 502 (7470), 232-236 (2013).
- Haas, S., et al. Inflammation-driven fast-track differentiation of HSCs into the megakaryocytic lineage. Experimental Hematology. 42 (8), 14 (2014).
- Shin, J. Y., Hu, W., Naramura, M., Park, C. Y. High c-Kit expression identifies hematopoietic stem cells with impaired self-renewal and megakaryocytic bias. The Journal of Experimental Medicine. 211 (2), 217-231 (2014).
Tags
Biologi nummer 171Erratum
Formal Correction: Erratum: Isolation of Mouse Megakaryocyte Progenitors
Posted by JoVE Editors on 07/28/2021.
Citeable Link.
An erratum was issued for: Isolation of Mouse Megakaryocyte Progenitors. A figure was updated.
Figure 2 was updated from:
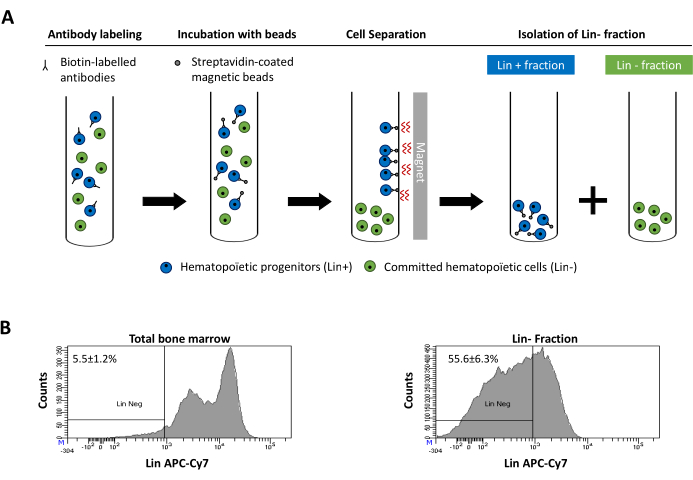
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.
to:
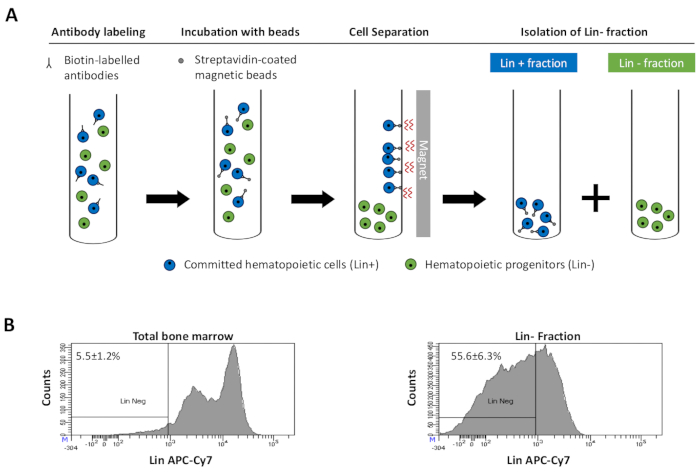
Figure 2: Magnetic depletion of lineage committed (Lin) cells. (A) Schematic representation of the magnetic depletion protocol. First, unsorted bone marrow cells are labeled with the biotin-conjugated rat anti-mouse antibody cocktail. Cells are then incubated with anti-rat Ig coated magnetic beads and subsequently subjected to the magnetic depletion using a strong magnet. The magnet will retain the labeled magnetic Lin+ fraction against the tube walls, while the unlabeled non-magnetic Lin- negative fraction will be collected in a new tube. (B) Lineage committed cells can be identified using fluorescent conjugated streptavidin. Typical analysis of the lineage expression in cells prior to magnetic depletion (total bone marrow) and after magnetic depletion (Lin- Fraction) N = 21. Please click here to view a larger version of this figure.



