Summary
הפרוטוקול הנוכחי מתאר מכשיר לבדיקת חיכוך המחיל החלקה הדדית בו-זמנית ועומס רגיל על שני גופנים ביולוגיים שבאים במגע.
Abstract
בדלקת מפרקים ניוונית ראשונית (OA), 'בלאי' תקין הקשור להזדקנות מעכב את יכולתו של הסחוס לקיים את תפקודי נושא העומס והשימון שלו, ומטפח סביבה פיזית מזיקה. האינטראקציות החיכוכיות של סחוס מפרקי וסינוביום עשויות להשפיע על הומאוסטזיס משותף באמצעות שחיקה ברמת הרקמה ומכנוטרנסדוקציה תאית. כדי לחקור את התהליכים המכניים והמכנוביולוגיים האלה, מתואר מכשיר המסוגל לשכפל את תנועת המפרק. מכשיר בדיקת החיכוך שולט בהעברת תנועת תרגום הדדית ועומס רגיל לשני פני נגד ביולוגיים מגע. מחקר זה מאמץ תצורת סינוביום-על-סחוס, ומדידות מקדמי חיכוך מוצגות לבדיקות המבוצעות באמבט מי מלח עם אגירת פוספט (PBS) או בנוזל סינוביאלי (SF). הבדיקה בוצעה עבור מגוון של לחצים במגע, תוך הדגשת תכונות הסיכה של SF תחת עומסים גבוהים. מכשיר בדיקת חיכוך זה יכול לשמש כביוריאקטור ביומימטי לחקר הוויסות הפיזי של רקמות מפרקים חיות בתגובה להעמסה פיזיולוגית יישומית הקשורה לביטוי מפרק היומן.
Introduction
דלקת מפרקים ניוונית (באנגלית: Osteoarthritis או OA) היא מחלת מפרקים ניוונית מתישה הפוגעת ביותר מ-32 מיליון מבוגרים אמריקאים, עם עלות בריאותית וסוציו-אקונומית של יותר מ-16.5מיליארד דולר. המחלה התאפיינה באופן קלאסי בהתדרדרות של סחוס מפרקי ועצם תת-כונדרלית; עם זאת, שינויים בסינוביום זכו לאחרונה להערכה מכיוון שסינוביטיס נקשרה לתסמיני OA ולהתקדמות 2,3,4. ב-OA ראשוני (אידיופטי), 'בלאי' תקין הקשור להזדקנות מעכב את יכולתו של הסחוס לקיים את תפקודי נושא העומס והשימון שלו. הלחצים הנוצרים על ידי מגע החלקה ממושך של שכבות סחוס מפרקיות או מגע מחליק של סחוס כנגד חומרי שתל הוכחו כמקלים על שחיקת דלמינציה באמצעות כשל עייפות תת-קרקעי 5,6. מכיוון שקיימת סביבה מכנית דינמית בתוך המפרק 7,8, האינטראקציות החיכוך של סחוס מפרקי וסינוביום עשויות להשפיע על הומאוסטזיס משותף באמצעות שחיקת רמת הרקמה ומכנוטרנסדוקציה תאית. כדי לחקור תהליכים מכניים ומכנוביולוגיים אלה, תוכנן מכשיר לשכפל את תנועת המפרק עם שליטה הדוקה על העמסה דחיסה וחיכוך 5,6,9,10,11,12,13.
הפרוטוקול הנוכחי מתאר מכשיר לבדיקת חיכוך המספק חומר גומלין, המתרגם תנועה ועומס דחיסה למשטחי מגע של רקמות חיות. המכשיר הנשלט על ידי מחשב מאפשר למשתמש לשלוט במשך כל בדיקה, בעומס המופעל, בטווח התנועה של שלב התרגום ובמהירות התרגום. המכשיר הוא מודולרי, ומאפשר בדיקה של גופנים נגדיים שונים, כגון רקמה על רקמה (סחוס על סחוס וסינוביום-על-סחוס) ורקמות על זכוכית. בנוסף למדידות הפונקציונליות המתקבלות על ידי הבודק, ניתן להעריך רכיבי אמבט רקמות ושימון לפני ואחרי הבדיקה כדי להעריך את השינויים הביולוגיים המועברים על ידי משטר ניסוי נתון.
מחקרים על טריבולוגיה של סחוס נעשו במשך עשרות שנים, וכמה טכניקות פותחו כדי למדוד מקדמי חיכוך בין סחוס לזכוכית וסחוס על סחוס14,15. הגישות השונות מונעות על ידי המפרק ו/או מנגנון הסיכה המעניין. לעתים קרובות יש פשרה בין שליטה על משתנים ניסיוניים לבין סיכום של פרמטרים פיזיולוגיים. התקנים בסגנון מטוטלת משתמשים במפרקים שלמים כ-fulcrum של מטוטלת פשוטה שבה משטח משותף אחד מתורגם בחופשיות על פני המשטח השני 14,16,17,18. במקום להשתמש במפרקים שלמים, ניתן לקבל מדידות חיכוך על ידי החלקת חומרי סחוס על פני משטחים רצויים 14,19,20,21,22,23,24,25. מקדמי החיכוך המדווחים של הסחוס המפרקי השתנו על פני טווח רחב (מ-0.002 ל-0.5) בהתאם לתנאי ההפעלה14,26. התקנים נוצרו כדי לשכפל תנועה סיבובית 23,27,28. Gleghorn et al.26 פיתחו טריבומטר מותאם אישית רב-באר כדי לצפות בפרופילי שימון סחוס באמצעות ניתוח עקומת סטריבק, ותנועת הזזה מתנדת ליניארית הופעלה בין סחוס כנגד פני נגד זכוכית שטוחים.
מכשיר זה נועד לבודד תגובות חיכוך ולחקור את המכנוביולוגיה של רקמות חיות בתנאי טעינה שונים. המכשיר משתמש במערך בדיקה פשוט המדמה את ביטוי המפרק באמצעות החלקה דחיסה, אשר יכול להעריך הן את תנועת הגלגול והן את תנועת ההחלקה מתוך הבנה שההתנגדות בתנועת גלגול טהורה היא זניחה ביחס למקדם החיכוך הנמדד של סחוס מפרקי29. הבודק, שנבנה במקור כדי לחקור את ההשפעות של לחץ נוזל אינטרסטיציאלי על תגובת החיכוך של סחוס מפרקי9, שימש מאז כדי לחקור נושאים כגון השפעות חיכוך של הסרת האזור השטחי של סחוס10, השפעות סיכה של נוזל סינוביאלי11, השערות שחיקת סחוס 5,6,30, ומדידות חיכוך סינוביום עלרקמה 13 . הביוריאקטור לבדיקת חיכוך יכול לערוך ניסויי חיכוך בתנאים סטריליים, ולספק מנגנון חדשני לחקור כיצד כוחות החיכוך משפיעים על התגובות המכנוביולוגיות של סחוס חי וסינוביום. תכנון זה יכול לשמש כביוריאקטור ביומימטי כדי לחקור את הוויסות הפיזי של רקמות מפרקים חיות בתגובה להעמסה פיזיולוגית יישומית הקשורה לביטוי מפרקים של יומן.
מחקר זה מציג תצורה לבדיקת חיכוך סינוביום על סחוס על פני מגוון של עקות מגע ובאמבטיות סיכה שונות. שטח הפנים המפרקי של רוב המפרקים הוא, במידה רבה, רקמה סינוביאלית31. בעוד שהחלקה של סינוביום על סחוס אינה מתרחשת במשטחים נושאי עומס ראשוניים, לאינטראקציות החיכוך בין שתי הרקמות עדיין עשויות להיות השלכות חשובות על תיקון רמת הרקמה ועל מכניוטרנסדוקציה של תאים. בעבר הוכח כי סינוביוציטים דמויי פיברובלסטים (FLS) השוכנים על השכבה האינטימית של הסינוביום הם מכניזנסיטיביים, ומגיבים ללחץ גזירה המושרה בנוזל32. כמו כן, הוכח כי מתיחהשל 33,34 ולחץ גזירה המושרה בנוזל35 מווסתים את ייצור חומרי הסיכה של FLS. לפיכך, מגע החלקה ישיר בין סינוביום לסחוס עשוי לספק גירוי מכני נוסף לתאים המתגוררים בסינוביום.
רק דיווחים מעטים על מקדמי חיכוך סינוביום פורסמו31,36. Estell et al.13 ביקשו להרחיב על האפיון הקודם על ידי שימוש בגופי נגד רלוונטיים מבחינה ביולוגית. עם יכולתו של מכשיר בדיקת החיכוך לבחון רקמות חיות, ניתן לחקות אינטראקציות של רקמות פיזיולוגיות במהלך ביטוי המפרקים כדי להבהיר את תפקידו של לחץ גזירה במגע על תפקוד הסינוביוציטים ואת תרומתו להצלבה בין סינוביום לסחוס. זה האחרון היה מעורב בתיווך דלקת מפרקים סינוביאלית בדלקת פרקים ולאחר פציעה. בשל הקרבה הפיזית של סחוס לסינוביום ונוזל סינוביאלי, המכילים סינוביוציטים המציגים יכולת מולטיפוטנטית, כולל כונדרוגנזה, ההנחה היא כי סינוביוציטים ממלאים תפקיד בהומאוסטזיס של סחוס ותיקון על ידי השתלה למשטח המפרקי. בהקשר זה, מגע פיזי וגזירה הדדית של סחוס-סינוביום וסינוביום-סינוביום עשויים להגביר את הנגישות של סינוביוציטים לאזורים של נזקי סחוס 37,38,39,40. מחקרים המשתמשים בתצורות של סינוביום על סחוס לא רק יספקו תובנות על מכניקת הרקמות הגסות והטריבולוגיה של המפרקים, אלא גם יובילו לאסטרטגיות חדשות לשמירה על בריאות המפרקים.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
מפרקי ברכיים של בקר צעירים, שהתקבלו מאבטויר מקומי, שימשו למחקר הנוכחי. מחקרים עם דגימות שור כאלה פטורים מהוועדה המוסדית לטיפול ושימוש בבעלי חיים בקולומביה (IACUC).
1. תכנון התקן בדיקת החיכוך
הערה: ייצוג סכמטי של התקן בדיקת החיכוך מוצג באיור 1. המכשיר בנוי על לוחית בסיס קשיחה (לא מוצגת), המשמשת כפלטפורמה לתמיכה מבנית.
- חברו מנוע צעד לשלב התרגום האופקי (ראו טבלת חומרים), ויצרו התקן לבדיקת חיכוך דו-צירי המספק תנועת תרגום הדדית למשטחי מגע.
- הרכיבו תא עומס רב-אקסיאלי בשלב התרגום (ראו טבלת חומרים). תא העומס המותקן ישמש למדידת העומס הרגיל בכיוון z (Fn), והעומס המשיק בכיוון x (Ft).
- ציידו את שלב התרגום במקודד ליניארי (ראו טבלת חומרים) כדי לרשום את התזוזה האופקית (ux) של השלב. יתר על כן, ציידו את שלב הטעינה במקודד ליניארי (ראו טבלת חומרים) כדי לרשום את התזוזה האנכית (uz) של הלוח.
הערה: מקודד שלב התרגום מתעד את התזוזה המשיקה היחסית של משטחי המגע, ומידע זה משמש לזיהוי תחילתו של כל מחזור חדש של החלקה הדדית. - הגדר את ציפוי ההעמסה (משטח מגע עליון) כזכוכית, סחוס או פני נגד סינוביום. חבר את הפלטה לשלב הטעינה באמצעות מוט תמיכה מושחל.
- חברו בסיס מגנטי בן שני חלקים לחלק העליון של תא העומס (ראו טבלת חומרים): (1) בסיס קבוע המחובר באופן קבוע לתא העומס ו-(2) בסיס נשלף המתחבר באופן מגנטי לבסיס הקבוע. ודא ששני החלקים יוצרים חיבור הדוק.
הערה: הבסיס הנשלף יחזיק את פני השטח הנגדיים המתרגמים (משטח יצירת קשר תחתון). - רשום עומס רגיל. השתמש במשקל מת המותקן על מסבים ליניאריים מעל לוחית ההעמסה ומוט התמיכה. לחלופין, ציין עומס באמצעות מפעיל סליל הקול (ראה טבלת חומרים), שיכול לטעון באופן דינמי את משטח המגע התחתון41.
- אחסנו את המכשיר בתוך מארז אקרילי ממוסגר מאלומיניום (ראו טבלת חומרים) כדי להגן על סביבתו מפני זיהום.
הערה: תוכנית LabVIEW מותאמת אישית שולטת בהתקן (ראה קבצי קידוד משלימים) עם בקרת משתמש על משך הזמן של כל בדיקה, כמו גם על נתיב הנסיעה של השלב, ההאצה (שינוי הכיוון) והמהירות. הכוח הרגיל, הכוח המשיק, תזוזת הבמה ותזוזת הזחילה מנוטרים לאורך כל הבדיקה באמצעות חומרה ותוכנה של רכישת נתונים (ראו טבלת חומרים).
2. הכנת דגימה והרכבה
- היכונו לקציר רקמות סטריליות לאחר השלבים הבאים.
הערה: אם לא רצוי קציר סטרילי, המשך לשלב 2.2.- לעקר כלי מתכת באוטוקלב. מרססים את מחזיקי המפרקים ב-70% אתנול ומניחים אותם בארון הבטיחות הביולוגי (BSC). סגור את הארון למחזור אולטרה סגול (UV) אחד.
- אחזר את הכלים מהקלקולה האוטומטית. הניחו את הכלים, הבטאדין, להבי האזמל הסטריליים והכוסות המכילות 70% אתנול ב-BSC.
- בתוך ה- BSC, פתח את הכלים והניח אותם בכוסות אתנול של 70%. חברו את להבי האזמל לידיות האזמל.
- הכינו את המפרק לקציר. מרססים את החלק החיצוני של המפרק ב-70% אתנול ועוטפים בנייר אלומיניום למשך 30 דקות. הקפידו לא לשבור את הקפסולה המשותפת.
הערה: מפרקי הברך של בקר הצעיר התקבלו כאשר עצם הירך והטיביה נחתכו כ-15 ס"מ עדיפים ונחותים מהמפרק כדי להבטיח קפסולה שלמה. - לאחר 30 דקות, הניחו את המפרק העטוף בתוך BSC. פתחו את נייר הכסף והצמידו את המפרק למחזיק שלו. מכסים את המפרק בבטאדין על ידי ניגוב עדין של הבטאדין על פני המפרק.
הערה: עיין בשלב 2.2 ובשלב 2.3 לקבלת הוראות ספציפיות לסינוביום והוראות ספציפיות לסחוס, בהתאמה.
- קציר את הסינוביום של שור הנוער בעקבות השלבים הבאים.
- מאבטחים את קפסולת המפרק הטיביופמורלית באמצעות מעמד טבעתי (ראו טבלת חומרים) כאשר הצד הקדמי פונה אל הדיסקטור. באמצעות מלקחיים ולהב אזמל, חותכים את גיד הפטלאר באמצעות חתך אופקי של 5-10 ס"מ (תלוי בגודל המפרק) עדיף על השוקה (איור 2A).
- החזיקו את גיד הפטלה המנותק עם מלקחיים. צרו שני חתכים קדמיים-אחוריים בצורת V (איור 2B,C). חתכים אלה אמורים לשחרר את הפטלה.
הערה: כאשר המפרק מתחיל להיפתח, היזהרו שלא לנתק את הרצועה הצולבת הקדמית (ACL), הרצועה הצולבת האחורית (PCL), הרצועה הבטוחה המדיאלית (MCL), הרצועה הצולבת הצידית (LCL) ומניסקוס. - סובבו את הפטלה מאחורי המפרק או הסירו אותה לחלוטין מהמפרק. הסר בזהירות את הרקמה השטחית לממברנה הסינוביאלית בצד המדיאלי והצידי של המפרק כדי לחשוף את הסינוביום.
- באמצעות להב אזמל, עקוב אחר קווי המתאר של אזור הסינוביום המעניין. באמצעות מלקחיים, תפסו קצה אחד של הסינוביום והתרוממו בעדינות כדי למתוח את הסינוביום הדיסטלי עד העצם שמתחת. השתמשו בלהב אזמל כדי להסיר את הסינוביום מהעצם (איור 2D,E).
- מניחים את הרקמה במדיית תרבית מתאימה או בודקים תמיסת אמבטיה. ניתן לתרבת את האקספלנט של הסינוביום לניסוי רצוי או להרכיבו ולהשתמש בו לבדיקה.
הערה: מדיה תרבותית / פתרונות אמבטיה לבדיקה עשויים להשתנות בהתאם להעדפת קבוצת המחקר. עבור אלה המותאמים אישית המשמשים למחקר הנוכחי, ראה טבלת חומרים.
- קוצרים את סחוס בקר הצעיר (תקעי עצם הירך ורצועות טיביאליות).
- הפרד את עצם הירך מהטיביה על ידי ניתוק ה-ACL, ה-PCL, ה-MCL וה-LCL. הקפידו לא לחתוך את סחוס הקונדיל של הירך או לפרוס דרך המניסקוס למישור הטיביאלי. מקם את הרקמות המופרדות במחזיקיהן המתאימים לניתוח (שלב 2.3.2 עבור עצם הירך ושלב 2.3.3 עבור שוקה).
- אבטחו את עצם הירך באמצעות מעמד טבעת. באמצעות אגרוף ביופסיה בעל צורה וגודל רצויים, דחפו את המכשיר הנורמלי למשטח הסחוס המפרקי של הקונדיל הירך עד שיגיעו לעצם (איור 3A).
- שחררו את החיבור של התקע לעצם על ידי הזזת האגרוף שמאלה לימין וקדימה אחורה. עשה זאת מבלי להסיר את האגרוף.
הערה: קולות פצפוץ עשויים להישמע כאשר העצם נפרדת מהסחוס. - הסר את האגרוף, ולכן את התקע, מהעצם הבסיסית (איור 3B). במידת הצורך, חזור על שלבים 2.3.2, 2.3.2.1 ו- 2.3.2.2 עבור המיקומים הנותרים שלא נגעו בהם על הקונדיל.
הערה: כהכנה להרכבת תקע הירך על בסיס בדיקה, ייתכן שיהיה צורך לגלח את הצד העמוק של התקע בצורה שטוחה. זה יכול להיעשות עם חותך קופסה או אזמל. - הניחו את הרקמה במדיה תרבית מתאימה או בדקו את תמיסת האמבטיה. תקע הירך עשוי להיות מתורבת לניסוי רצוי או מותקן ומשמש לבדיקה.
- שחררו את החיבור של התקע לעצם על ידי הזזת האגרוף שמאלה לימין וקדימה אחורה. עשה זאת מבלי להסיר את האגרוף.
- אבטחו את השוקה במחזיק מתכוונן (ראו טבלת חומרים). הסירו את המניסקוס בזהירות תוך הימנעות ממגע עם משטח הסחוס (איור 4A).
- בקצוות החיצוניים של הרמה הטיביאלית, השתמשו בחותך קופסה כדי לחתוך בניצב לסחוס לכיוון העצם. חותכים לחלוטין דרך הסחוס כדי ליצור קצוות/צדדים ישרים (איור 4B). התחילו את החתך במרחק של כ-2 מ"מ מכל קצה מישור טיביאלי והסירו עודפי רקמה. נקבו את הקצוות הפנימיים של הסחוס (איור 4C).
הערה: בשלב זה, העצם צריכה להיות גלויה מתחת לסחוס בקצוות החיצוניים של הרמה הטיביאלית. - בקצוות החיצוניים, השתמשו בחותך הקופסה כדי לבצע חיתוך נקי בממשק שבין העצם לסחוס (איור 4D).
הערה: החתך חייב להיות מקביל למשטח הסחוס וכ-5 מ"מ פנימה, עמוק מספיק כדי להתחיל להפריד בין הסחוס לעצם. - כדי להסיר את הרצועה הטיביאלית ממשטח המישור, הכנס בעדינות מברג שטוח מתחת לחתך שנעשה בשלב 2.3.3.2. סובבו בעדינות את המברג כדי לשחרר את הסחוס המפרקי מהעצם התת-כונדרלית (איור 4E).
הערה: קולות פצפוץ עשויים להישמע כאשר העצם נפרדת מהסחוס. - כאשר הדגימה מתרופפת, דוחפים באיטיות את המברג קדימה עד שרצועת הסחוס מתנתקת מהעצם. לדחוף את המברג לכיוון העצם, לא לכיוון הסחוס. חזרו על התהליך הזה במספר מוקדים עד שהסחוס המפרקי של הרמה הטיביאלית יוסר לחלוטין מהעצם שמתחתיו (איור 4F).
- באמצעות חותך קופסה, חותכים את משטח הרמה הטיביאלית כדי לייצר דגימות מלבניות בגודל ובעובי הרצויים.
הערה: עבור המחקר הנוכחי נחתכו רצועות של 10 מ"מ על 30 מ"מ, אך ניתן לגוון ממד זה בהתבסס על הניסוי הרצוי ועל מערך הבדיקה. - הניחו את הרקמה במדיה תרבית מתאימה או בדקו את תמיסת האמבטיה. הרצועה הטיביאלית עשויה להיות מתורבתת לניסוי רצוי או מורכבת ומשמשת לבדיקה.
- במידת הצורך, חזור על שלבים 2.3.3.1-2.3.3.3.6 עבור הרמה הטיביאלית השנייה.
- בקצוות החיצוניים של הרמה הטיביאלית, השתמשו בחותך קופסה כדי לחתוך בניצב לסחוס לכיוון העצם. חותכים לחלוטין דרך הסחוס כדי ליצור קצוות/צדדים ישרים (איור 4B). התחילו את החתך במרחק של כ-2 מ"מ מכל קצה מישור טיביאלי והסירו עודפי רקמה. נקבו את הקצוות הפנימיים של הסחוס (איור 4C).
- הר את הסינוביום ואת הסחוס בעקבות השלבים הבאים.
- אם תרצה, בחר דגימת רצועה טיביאלית לבדיקה.
הערה: ניתן לבדוק את הרצועה כגוף הנגד התחתון.- הסר את הבסיס המגנטי הנשלף (ראה טבלת חומרים) והדבק צלחת פטרי בקוטר 60 מ"מ למשטח העליון של הבסיס הנשלף.
- כאשר צלחת הפטרי מודבקת במקומה, חברו את הבסיס הנשלף לבסיס הקבוע וסמנו את צלחת הפטרי כדי לציין כיוון החלקה.
- יש למרוח כמות קטנה של ציאנואקרילט (ראו טבלת חומרים) על מרכז המנה. יישרו את הרצועה הטיביאלית עם כיוון ההחלקה של הבמה (כפי שמצוין בסימן על צלחת הפטרי מ-2.4.1.2). לחצו בעדינות את רצועת הסחוס על התבשיל. יש ליטול קרנוט כדי לגרד את משטח הסחוס.
הערה: כלי יניקה (ראה טבלת חומרים) יכול להפעיל לחץ עדין על הסחוס מבלי לפגוע במשטח כדי לעבור בדיקת חיכוך. - שחזרו את הבסיס המגנטי הנשלף (עם רצועת סחוס מחוברת) לבסיס המקובע המגנטי המשויך שלו בבוחן החיכוך. מלאו את צלחת הפטרי בתמיסת האמבטיה הרצויה. תמיסת האמבטיה הבודקת חייבת לכסות לחלוטין את הסחוס.
- אם תרצה, בחר תקע סחוס עצם הירך לבדיקה.
הערה: ניתן לבדוק את התקע כגוף הנגד התחתון או העליון.- אם הקונדיל של הירך משמש כגוף הנגד התחתון, הסר את הבסיס המגנטי הנשלף והדבק צלחת פטרי בקוטר 60 מ"מ למשטח העליון של הבסיס הנשלף.
- יש למרוח כמות קטנה של ציאנואקרילט על מרכז המנה. לחצו בעדינות על תקע הסחוס על המנה.
הערה: כלי יניקה יכול להפעיל לחץ עדין על הסחוס מבלי לפגוע במשטח כדי לעבור בדיקת חיכוך. - שחזר את הבסיס המגנטי הנשלף (עם תקע סחוס מחובר) לבסיס המקובע המגנטי המשויך שלו בבוחן החיכוך. מלאו את צלחת הפטרי בתמיסת האמבטיה הרצויה. תמיסת האמבטיה הבודקת חייבת לכסות לחלוטין את הסחוס.
- יש למרוח כמות קטנה של ציאנואקרילט על מרכז המנה. לחצו בעדינות על תקע הסחוס על המנה.
- אם סחוס הירך משמש כגוף הנגד העליון, הסר את לוחית ההעמסה ואת מוט התמיכה מבוחן החיכוך. במידת הצורך, הסר את הפלטה הקיימת ובחר לוחית חדשה המתאימה להרכבה על סחוס.
- יש למרוח כמות קטנה של ציאנואקרילט על משטח הלוחות. לחץ בעדינות על תקע הסחוס על הפלטה.
הערה: כלי יניקה יכול להפעיל לחץ עדין על הסחוס מבלי לפגוע במשטח כדי לעבור בדיקת חיכוך. - שחזרו את לוחית ההעמסה (עם תקע סחוס מחובר) ואת מוט התמיכה לבוחן החיכוך. התאם את הגובה האנכי של לוחית ההעמסה כך שתקע הסחוס מרחף מעל פני הדלפק התחתון ושקוע באמבט הבדיקה. הוסיפו עוד תמיסת אמבטיה לבדיקה במידת הצורך.
- יש למרוח כמות קטנה של ציאנואקרילט על משטח הלוחות. לחץ בעדינות על תקע הסחוס על הפלטה.
- אם הקונדיל של הירך משמש כגוף הנגד התחתון, הסר את הבסיס המגנטי הנשלף והדבק צלחת פטרי בקוטר 60 מ"מ למשטח העליון של הבסיס הנשלף.
- אם תרצה, בחר את דגימת הסינוביום לבדיקה.
הערה: ניתן לבדוק את הסינוביום כגוף הנגד התחתון או העליון.- אם הסינוביום משמש כגוף נגדי תחתון, הסר את הבסיס המגנטי הנשלף והדבק צלחת פטרי בקוטר 60 מ"מ למשטח העליון של הבסיס הנשלף.
- הדביקו למרכז המנה עמוד אקריליק-סיליקון עגול בהתאמה אישית בקוטר הרצוי.
- באמצעות מלקחיים, מניחים את הסינוביום על גבי העמוד. כדי לאבטח את הסינוביום, הפיצו טבעת O (ראו טבלת חומרים) על היקפה.
- באמצעות מלקחיים, משכו בעדינות את הסינוביום כדי למתוח את הרקמה הנלמדת והשטוחה מתחת לטבעת ה-O. לקצץ עודפי רקמות עם מספריים כירורגיים.
- שחזר את הבסיס המגנטי הנשלף (עם סינוביום מחובר) לבסיס המקובע המגנטי המשויך שלו בבוחן החיכוך. מלאו את צלחת הפטרי בתמיסת האמבטיה הרצויה. תמיסת האמבטיה הבדיקה חייבת לכסות לחלוטין את הסינוביום.
- אם הסינוביום משמש כגוף הנגד העליון, הסר את לוחית ההעמסה ואת מוט התמיכה מבוחן החיכוך. במידת הצורך, הסר את הפלטה הקיימת ובחר לוח עגול חדש המתאים להרכבה של סינוביום.
- באמצעות מלקחיים, מניחים את הסינוביום על גבי הלוח העגול. כדי לאבטח את הסינוביום, התפשטו טבעת O על היקפה.
- באמצעות מלקחיים, משכו בעדינות את הסינוביום כדי למתוח את הרקמה הנלמדת והשטוחה מתחת לטבעת ה-O. לקצץ עודפי רקמות עם מספריים כירורגיים.
- שחזר את לוחית הטעינה (עם סינוביום מחובר) ומוט תמיכה לבוחן החיכוך. התאם את הגובה האנכי של לוח ההעמסה כך שהסינוביום מרחף מעל פני הנגד התחתון ושקוע באמבט הבדיקה. הוסיפו עוד תמיסת אמבטיה לבדיקה במידת הצורך.
- אם הסינוביום משמש כגוף נגדי תחתון, הסר את הבסיס המגנטי הנשלף והדבק צלחת פטרי בקוטר 60 מ"מ למשטח העליון של הבסיס הנשלף.
- אם תרצה, בחר דגימת רצועה טיביאלית לבדיקה.
3. בדיקת חיכוך
הערה: תוכנית LabVIEW מותאמת אישית וחומרה משויכת (ראה קבצי קידוד משלימים) משמשות לבדיקות אלה. שים לב שהקוד המותאם אישית נבנה ב- LabVIEW 2010 ונשמר על אותה גרסה מדור קודם. כתוצאה מכך, ייתכן שהקוד לא יהיה תואם קדימה לגרסה העדכנית ביותר של התוכנה. שביתות הלחצנים הבאות והפניות לממשק משתמש יהיו רלוונטיות רק לקוד המותאם אישית. אם עובדים עם גרסת תוכנה אחרת, ניתן לכתוב תוכנית מותאמת אישית דומה על ידי שינוי הקוד.
- הכנס את הדגימות המותקנות (שלב 2.4) להתקן בודק החיכוך.
הערה: הדגימות צריכות להיות שקועות בתמיסת האמבטיה של הבדיקה, אך אסור שיהיו במגע זו עם זו. - פתח את התוכנה וקבע פרמטרים לבדיקה: מהירות שלב, האצת שלב, נתיב נסיעה (מרחק) ומשך הבדיקה (איור 5).
- פתח את שלושת החלונות בתוכנית: בניית נתונים אנלוגיים MFDAQ, אתחול טען PID והפעלת מתקשר דינמי.
- הפעל את החלון MFDAQ לבניית נתונים אנלוגיים על-ידי לחיצה על לחצן הפעל (חץ לבן).
- הפעל את החלון אתחול טען PID על-ידי לחיצה על לחצן הפעל (חץ לבן).
- נווט אל הכרטיסיה Stepper בחלון מפעיל מתקשר דינמי. ציין את ההאצה, המהירות והמרחק של שלב התרגום בתיבות הקלט של המשתמש.
הערה: ערך המרחק מגדיר את מסלול השחיקה באורך של חצי אורך. במילים אחרות, השלב יעבור ממיקום האפס שצוין (שלב 3.5) לערך המרחק שנקבע הן בכיווני x החיוביים והן בכיווני x השליליים. - בכרטיסיה Stepper, ציין את משך הבדיקה על-ידי בחירה בנתיב הקובץ Stepper Time Index . לחץ על לחצן פתח תיקיה בפינה השמאלית התחתונה של הטבלה מצב זמן ובחר את הקובץ.
- ציין את משך הבדיקה גם בכרטיסיה סליל קול. נווט אל הכרטיסיה סליל קול בחלון 'הפעל מתקשר דינמי'. בדומה לשלב 3.2.5, בחר בנתיב הקובץ אינדקס סליל קול על-ידי לחיצה על לחצן פתח תיקיה בפינה השמאלית התחתונה של הטבלה מצב זמן ובחר את הקובץ. משך הזמן חייב להיות תואם לזה של הכרטיסייה Stepper .
- רשום את העומס הרגיל. אם משתמשים במשקולות מתות, הניחו את המשקולות הרצויות על המסבים הליניאריים מעל לוח ההעמסה. ודא שהעומס המופעל בתוספת משקל לוח ההעמסה ומוט התמיכה אינם עולים על הקיבולת המדורגת של תא העומס.
- בחר את הנתיב ואת שם הקובץ לאחסון נתונים באמצעות לחצן התיקיה הפתוחה מימין לתיבה כתוב לקובץ? שמור את הקובץ עם סיומת ".txt".
- מרכזים את פני הנגד התחתונים מתחת לפניית הנגד העליונה. הגדר זאת כמיקום האפס x.
- הפעל את החלון 'הפעל מתקשר דינמי' על-ידי לחיצה על לחצן הפעל (חץ לבן). בכרטיסיה Stepper, לחץ על לחצן בית כדי להעביר את הבמה למצב x האפס שנשמר לאחרונה.
- אם פני הנגד אינם מיושרים, הזיזו את הבמה על ידי לחיצה על לחצני החצים הירוקים שמאלה וימינה. כאשר מגיעים למיקום הרצוי, לחץ על אפס כפתור כדי לשמור את מיקום השלב הנוכחי כמיקום x האפס החדש. עצור את החלון 'הפעל מתקשר דינמי' על-ידי לחיצה על לחצן עצור.
הערה: ניתן לשמור את מיקום הבמה רק בזמן שחלון ' הפעל מתקשר דינמי' פועל, אך השלב עדיין לא זז כפי שצוין על-ידי התוכנית. לחיצה על לחצן הפעלה (חץ לבן) בשלב 3.5.1 תפעיל מסגרת זמן של 15 שניות לפני שהבמה תתחיל לנוע. השתמש במסגרת זמן זו של 15 שניות כדי להזיז את השלב ולשמור את מיקום האפס הרצוי. - אם מיקום האפס הרצוי אינו מתקבל בניסיון הראשון, חזור על שלב 3.5.1.
הערה: זה עשוי לעזור ללחוץ על לחצן אפס לסירוגין כדי לשמור את מיקום הבמה כאשר המשתמש מזיז את הדלפק התחתון מתחת לפניית הנגד העליונה. נזכיר כי לחיצה על כפתור הבית תעביר את הבמה למיקום האחרון שנשמר על-ידי לחצן אפס .
- לאחר שהפנים הנגדיות העליונות והתחתונות ממורכזות, התחילו בבדיקות חיכוך של הדגימות על ידי התחלת התנועה המחזורית של השלב. לשם כך, הפעל את חלון ההפעלה של מתקשר דינמי על-ידי לחיצה על לחצן הפעל (חץ לבן).
- ברגע שהבמה זזה, הביאו לאט לאט את הדלפק העליון למגע עם החלק התחתון.
הערה: ניתן לאשר את ערך הטעינה המוחל על-ידי הצגת החלקה בזמן אמת של Fz בחלון התוכנה (איור 5A). - תן לבדיקה לרוץ, לאסוף את נתוני בדיקת החיכוך.
הערה: כל הנתונים שנרשמו במהלך שלב 3.5 יוחלפו. ניתן לצפות בהיסטרזיס בזמן אמת בחלון ' מתקשר דינמי' של 'טריגר' (איור 5C). - לאחר משך הבדיקה הרצוי, עצור את הבדיקה על ידי לחיצה על לחצן עצור ופריקת הדגימות על ידי הרמת פני הנגד העליונים והזזתו ממגע עם הדלפק התחתון.
4. עיבוד נתונים
הערה: תוכנית MATLAB מותאמת אישית משמשת לעיבוד נתונים (ראה קבצי קידוד משלימים). הקוד קורא לקבצי הפלט שצוינו על-ידי קוד LabVIEW המותאם אישית.
- השתמש בקוד המותאם אישית כדי לחשב את מקדם החיכוך ואת תזוזת הזחילה (עיוות רקמה תלוי זמן) לכל מחזור.
- ודא שכל הקודים הרלוונטיים נשמרים באותה תיקיה: "frictioncycle_fun.m", "frictioncycle_Hysteresis_plot.m", "frictioncycle_MU_plot.m", ו- "frictioncycle_run.m".
הערה: קודי MATLAB אלה נכתבו לשימוש עם הפלטים הספציפיים מקוד LabVIEW הנ"ל. אם המשתמש יצר קוד משלו או ביצע שינויים בקוד המתואר כאן, ייתכן שיהיה צורך לערוך את הסקריפטים של MATLAB כדי להתאים לשינויים אלה. - פתח את הקובץ frictioncycle_run.m. לחץ על לחצן הפעלה (חץ ירוק) בסקריפט. בחר את קובץ הנתונים הגולמי לניתוח ואת המיקום הרצוי לשמירת פלט MATLAB.
הערה: התוכנה עשויה לדרוש מספר דקות כדי לעבד נתונים בהתאם למשך הבדיקה.
- ודא שכל הקודים הרלוונטיים נשמרים באותה תיקיה: "frictioncycle_fun.m", "frictioncycle_Hysteresis_plot.m", "frictioncycle_MU_plot.m", ו- "frictioncycle_run.m".
- אם תרצה, בצע הערכות רקמות סטנדרטיות וניתוחי מדיה על המלקטים והאליקוטים שנבדקו של תמיסת האמבטיה הבודקת.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
תצורת סינוביום-על-סחוס שימשה לבדיקת חיכוך של חומרי בטן צעירים. הסינוביום הורכב על לוחית טעינה אקרילית בקוטר 10 מ"מ כך שהשכבה האינטימית תהיה במגע עם הסחוס הבסיסי. רצועה טיביאלית שימשה כנקודת הנגד של הסחוס (איור 6A). רצועות טיביאליות נחתכו בעומק של כ-1.4 מ"מ ובגודל של 10 מ"מ על 30 מ"מ. הדגימות נבדקו במשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס באמבט מלוחים עם מאגר פוספט (PBS) או באמבטיית נוזל סינוביאלי של בקר (SF). אמבט ה- SF כלל תערובת של 50/50 של PBS ו- SF בקר. תאוצת הבמה הייתה 100 מ"מ לשנייה2, מהירות הבמה הייתה 1 מ"מ לשנייה, ומרחק נתיב הבמה היה 2.5 מ"מ 6,9,42. משקולות מתות שימשו להפעלת עומסים נורמליים שונים וכתוצאה מכך נוצרו לחצים במגע של 180, 230 ו-300 kPa11,43.
לאחר שעה נפרקו הרקמות, והוערכו מקדמי החיכוך. מקדם חיכוך יעיל μ חושב מהממוצע של Ft/Fn על פני כל מחזור גומלין ולאחר מכן הותווה כנגד משך הבדיקה כדי להניב מקדם חיכוך לעומת. עלילת זמן (איור 6B). עבור כל בדיקה, ערכים של μ ממוצעים לאורך כל המבחן (כל המחזורים) כדי לייצר ממוצע μ. באמבט בדיקת PBS, הערכיםהממוצעים μ עלו ככל שהלחץ על המגע עלה. μהממוצע,PBS עלה מ-0.015 ± 0.005 ב-180 kPa, ל-0.019 ±-0.005 ב-230 kPa, ל-0.022 ± 0.010 ב-300 kPa. לעומת זאת, הערכים הממוצעים μ נשארו דומים ככל שהלחץ על המגע עלה באמבטיית SF (איור 6C). ממוצעμ,SF היה 0.013 ± 0.002 ב 180 kPa, 0.011 ± 0.001 ב 230 kPa, ו 0.011 ± 0.001 ב 300 kPa.
בסך הכל, התוצאות מדגימות את יכולתו של מכשיר בודק החיכוך להחיל במקביל החלקה הדדית ועומס תקין על שני גופי נגד ביולוגיים. במחקר זה, דגימות סינוביום על סחוס שנבדקו באמבט SF לא הראו עלייה במקדם החיכוך כאשר הלחץ על המגע הוגבר, ובכך תמכו ברעיון ש- SF תורם לתכונות השחיקה הנמוכות והחיכוך הנמוך של המפרק באמצעות מנגנון שימון גבול.
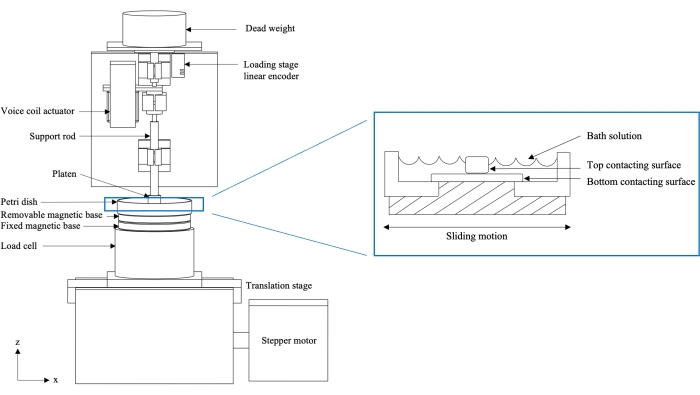
איור 1: סכמטי של התקן בדיקת חיכוך מותאם אישית בעל שני צירים (משמאל) וחתך רוחב של דגימה טעונה בצלחת פטרי (מימין). הבמה מחוברת למנוע אשר גורם לתנועת החלקה וגורמת למשטח המגע התחתון להתבטא כנגד משטח המגע העליון. תא העומס אוסף מדידות עומס בזמן אמת, בעוד המקודד הליניארי של שלב הטעינה אוסף מדידות תזוזת זחילה בזמן אמת. האיור שונה באישור הפניה10. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
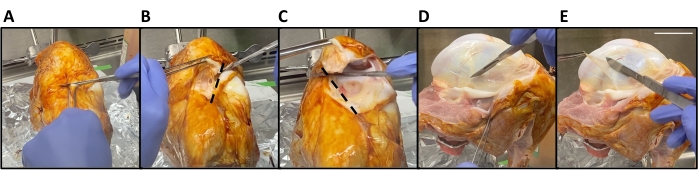
איור 2: קציר סינוביום בקר. (A) גיד הפטלר נקטע באמצעות חתך אופקי העולה על השוקה. (ב,ג) הפטלה מוסרת על ידי יצירת שני חתכים קדמיים לאחוריים בצורת V (קווים מנוקדים). (D) קווי המתאר של הסינוביום מסומנים בלהב אזמל. (E) לאחר מכן מותחים את הסינוביום באופן דיסטלי עד העצם שמתחתיו ומוסרים אותו. סרגל קנה מידה = 5 ס"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: קצירת תקע סחוס עצם הירך של בקר. (A) אגרוף ביופסיה בקוטר 15.9 מ"מ מוחדר באופן נורמלי למשטח הסחוס המפרקי של הקונדיל הקונדיל הירך עד שמגיעים לעצם. (ב) האגרוף והתקע מוסרים. סרגל קנה מידה = 16 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: קציר רצועת טיביאלית של סחוס בקר. (A) המניסקוס מוסר מהרמה הטיביאלית. (B) קצוות הרמה נחתכים כדי ליצור צדדים ישרים (משובצים). (C) החלק הפנימי של הרמה מובקע כדי ליצור רצועה. (D) חתך נעשה בממשק סחוס-עצם. (E) מברג מוכנס מתחת לחתך. (ו) הרצועה מוסרת. סרגל קנה מידה = 10 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: ממשק המשתמש של LabVIEW. התוכנית המותאמת אישית מאפשרת שליטה בפרמטרים שונים של הבדיקה כגון האצת שלב, מהירות שלב, נתיב נסיעה ומשך בדיקה. (A) חלקת טעינה שהוחלה בזמן אמת (Fz לעומת. t כאשר Fz הוא העומס הרגיל Fn), (B) מיקום חורג (ux לעומת. t), ו-(C) עלילת היסטרזיס (Fx לעומת. ux, כאשר Fxהוא הכוח המשיק Ft) מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: מדידות חיכוך של סינוביום על סחוס. (A) מכשיר בדיקת החיכוך מוגדר לסינוביום בקר צעיר (inset) על רצועת סחוס טיביאלית. (B) מקדם חיכוך מייצג (μ) כפונקציה של התוויית זמן. (C) מקדם החיכוך עבור עקות מגע שונות (180 kPa, כחול; 230 kPa, אדום; 300 kPa, ירוק) באמבט מלוחים עם מאגר פוספט (PBS, עיגול סגור) או בנוזל סינוביאלי בקר (SF, מעגל פתוח). פסי שגיאה הם ממוצעים עם סטיית תקן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 7: ביוריאקטור חיכוך. (A) סכמטית של ביוריאקטור חיכוך עם פני נגד עליונים נייחים ופניה תחתונה נעה. (B) מבט מהצד ו-(C) מבט תחתון של הביוריאקטור המחיל גזירה פיזיולוגית בתצורת סינוביום-על-סחוס. (D) הביוריאקטור שוכן בתוך חממת תרביות רקמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
קבצי קידוד משלימים. אנא לחץ כאן כדי להוריד קובץ זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
סביבה מכנית דינמית קיימת בתוך המפרק כאשר הסחוס נתון לכוחות דחיסה, מתיחה וגזירה, וללחצים הידרוסטטיים ואוסמוטיים44,45. למרות שהסחוס הוא הרקמה נושאת העומס העיקרית של המפרק, הסינוביום עובר גם אינטראקציות חיכוך עם משטח הסחוס ועם עצמו באזורים שבהם הרקמה מתקפלת. האינטראקציות הפיזיות בין הסחוס לסינוביום אחראיות ככל הנראה להעברת תאים ולשחרור תאי גזע מזנכימליים לסביבת המפרקים, ומציעות מקור תאי פוטנציאלי לתרום למנגנוני תיקון סחוס מפרקיים (מוגבלים) 37,38,39,40. לתכונות החיכוך הן של הסחוס והן של הסינוביום יש השלכות חשובות על תחזוקת המפרקים והתנוונותם באמצעות שחיקת רקמות13. מכשיר המסוגל לספק תנועה מתורגמת הדדית וטעינה דחיסה מוצג כדי לחקור את התהליכים המכניים והמכנוביולוגיים האחראים להומאוסטזיס משותף ולהתקדמות המחלה.
בחירת פרמטרי הבדיקה והרכבת הדגימה הם שני שלבים קריטיים של הפרוטוקול. המכשיר מפעיל עומס דחיסה עם משקולות מתות או מפעיל סליל קול. התוכנה המותאמת אישית מאפשרת שליטה על פרמטרים שונים כגון משך הבדיקה, מהירות השלב ונתיב הנסיעה. בעיה עלולה להתעורר אם משך הבדיקה קצר מדי; כאשר זה המקרה, משך הזמן הקצר אינו מאפשר למקדם החיכוך μ להגיע לשיווי משקל (μeq). אם μ פלט eq רצוי, על המשתמש לבחור משך בדיקה מתאים שיוכל ללכוד את התנהגות הרקמה עד שהיא תהפוך לקבועה. דגימות יכולות להגיע לשיווי משקל תוך מספר שעות מהבדיקה, בהתאם לגודל אזור המגע ברקמה46. יש לקחת בחשבון גם את סוג הבדיקה. המכשיר שימש באזור המגע הנייח ובתצורות אזור המגע הנודד כדי לחקור תכונות חיכוך סחוס 5,6,9,11,12,47. ניתן לתפעל את נתיב הנסיעה, מהירות הבמה וההתאמה של שני פני הנגד כדי לייצר את מצב הבדיקה הרצוי. מומלץ ליצור מגרשים בזמן אמת בממשק המשתמש של תוכנית LabVIEW כדי לסייע בניטור בדיקה. עלילות מועילות כוללות מיקום במה אופקי לעומת. זמן, כוח רגיל לעומת. זמן, וכוח משיק לעומת. מיקום במה אופקי (היסטרזיס, איור 5C). לדוגמה, הדלפק העליון חייב לנוח רק על הדלפק התחתון כדי להבטיח את העומס המלא שנקבע מוחל. ניתן לאשר את ערך הטעינה המוחל על-ידי הצגת החלקה הרגילה של טעינה בזמן אמת (איור 5A). הרכבה של דגימות חייבת להיות מאובטחת כדי למנוע החלקה או קריעה של רקמות שיספקו מדידות שגויות. קריעת סינוביום עקב הרכבה לא נכונה תגרום למקדם חיכוך שגוי, שכן משטח ההרכבה מתחת לסינוביום ייחשף. שגיאה זו עשויה להיות מזוהה על-ידי ניטור עקומות היסטרזיס בזמן אמת. ההערכה בזמן אמת של המכשיר של תכונות תפקודיות נבדלת ממערכות אחרות לבדיקת חיכוך.
כל הנתונים הגולמיים צריכים להיכתב לקובץ שניתן לייבא ולעבד על ידי תוכנת עיבוד הנתונים הרצויה. מומלץ לאסוף נתונים בתדירות של לפחות 10 נקודות נתונים לשנייה ולשמור נתונים גולמיים בקובץ .csv או .txt. ניתן לחשב את מקדם החיכוך עבור כל מיקום בכל מחזור באמצעות המשוואה  כאשר t ו-n מתייחסים לכוחות המשיקים והנורמליים, בהתאמה, ו- כאשר + ו- - מתייחסים למשיכות קדימה ואחורה, בהתאמה, לכל מחזור5. נוסחה זו מכירה בכך שהסימן של F-t הפוך לזה של F+t. כוח נורמלי (Fn) מוגדר ככוח התואם את העומס המופעל (z-direction, איור 1), בעוד שכוח משיק (Ft) הוא הכוח המקביל להחלקה (x-כיוון, איור 1). ניתן לחשב את מקדם החיכוך הממוצע במחזור על ידי לקיחת הממוצע של μ עבור כל המיקומים במחזור נתון. תזוזת הזחילה מחושבת על ידי נרמול התזוזה האנכית של פני הנגד העליונים כך שהתזוזה הראשונית היא אפס והתזוזות הבאות הן יחסיות לתזוזה הראשונית. במידת הצורך, ניתן לבצע הערכות רקמות סטנדרטיות וניתוחי מדיה על המלקטים והאליקוטים הנבדקים של תמיסת האמבטיה הבודקת. לפני הניתוח, מומלץ לרשום את נפח האמבטיה של הבדיקה שישמש לעיבוד נתונים או לנורמליזציה.
כאשר t ו-n מתייחסים לכוחות המשיקים והנורמליים, בהתאמה, ו- כאשר + ו- - מתייחסים למשיכות קדימה ואחורה, בהתאמה, לכל מחזור5. נוסחה זו מכירה בכך שהסימן של F-t הפוך לזה של F+t. כוח נורמלי (Fn) מוגדר ככוח התואם את העומס המופעל (z-direction, איור 1), בעוד שכוח משיק (Ft) הוא הכוח המקביל להחלקה (x-כיוון, איור 1). ניתן לחשב את מקדם החיכוך הממוצע במחזור על ידי לקיחת הממוצע של μ עבור כל המיקומים במחזור נתון. תזוזת הזחילה מחושבת על ידי נרמול התזוזה האנכית של פני הנגד העליונים כך שהתזוזה הראשונית היא אפס והתזוזות הבאות הן יחסיות לתזוזה הראשונית. במידת הצורך, ניתן לבצע הערכות רקמות סטנדרטיות וניתוחי מדיה על המלקטים והאליקוטים הנבדקים של תמיסת האמבטיה הבודקת. לפני הניתוח, מומלץ לרשום את נפח האמבטיה של הבדיקה שישמש לעיבוד נתונים או לנורמליזציה.
פני הנגד המודולריים אפשרו התאמה של תצורות בדיקה מרובות. מחקרים מוקדמים השתמשו בבדיקות זכוכית על סחוס כדי להבהיר את התפקיד של תמיכה בעומס נוזלים אינטרסטיציאליים בטריבולוגיה של סחוס 9,10. החשיבות של לחץ נוזל אינטרסטיציאלי אומתה עוד יותר על ידי השוואת בדיקות אזור מגע נייחות ונודדות עבור סחוס על סחוס וסחוס מול זכוכית11. Oungoulian et al.6 העריכו את מנגנון השחיקה של סחוס מפרקי נגד סגסוגות מתכת המשמשות בהמיארטרופלסטיות והראו כי הלחצים שנוצרו על ידי מגע החלקה במשך 4 שעות הקלו על שחיקת דלמינציה באמצעות כשל עייפות תת-קרקעי. עבודה זו לוותה ב-Durney et al.5, שהדגימו כי שחיקת דלאמינציה עדיין יכולה להתרחש כאשר החיכוך נותר נמוך תחת תצורת אזור מגע נודד. לאחרונה, Estell et al.13 דיווחו לראשונה על תכונות החיכוך של הסינוביום בתנאי בדיקה שחיקו אינטראקציות מקומיות עם רקמות בסיסיות (סחוס וסינוביום) ובתנאים שחיקו מצב אוסטאו-ארתריטי (אמבט נוזל סינוביאלי מדולל עם חלקיקי שחיקה סחוס). בסופו של דבר, הגמישות התכנונית של מכשיר בדיקת החיכוך אפשרה לערוך מגוון רחב של ניסויים, מה שתרם להבנה טובה יותר של סחוס וטריבולוגיה של סינוביום.
מגבלה אחת של המערכת הנוכחית היא שהיא יכולה לשמור על תנאי בדיקה אספטיים רק במשך כמה שעות. זה מושג באמצעות המארז האקרילי, עיקור רכיבים מגע עם מדיה באמצעות autoclave, וריסוס מכשיר הבדיקה עם 70% אתנול. המארז האקרילי כולל גם גוף חימום ויכולות ניטור טמפרטורה קבועות. גוף החימום מחמם את האוויר בתוך הקופסה, שולט בטמפרטורה של הסביבה הפנימית, וניתן לשלוט בו באופן חיצוני כדי למנוע חשיפת הדגימות לסביבה החיצונית. ניתן להשיג תנאים אספטיים נוספים על ידי קצירת הדגימות בארון בטיחות ביולוגי סטרילי (BSC) והרכבת הדגימות בתוך BSC בתוך מיכל סטרילי שיכול להתממשק עם מוט התמיכה והבסיס הקבוע. עבור מחקרים ארוכי טווח, ניתן לצייד את המארז האקרילי בחומרים הדרושים כדי לספק סביבה סטרילית יותר (אור אולטרה סגול, זרימת אוויר וסינון נאותים ובקרת טמפרטורה המווסתת את עצמה). מגבלה נוספת היא שהתקן בדיקת החיכוך הנוכחי מוגדר לבדיקת משטח נגדי עליון ותחתון יחיד. ניתן להשיג גישה נגדית מרובת דגימות על ידי שינוי לוח ההעמסה ועיצוב הבסיס הנשלף, המרת התקן בדיקת החיכוך הנוכחי לביוריאקטור בעל יכולת רב-בארות ליישום העמסה פיזיולוגית של סחוס-על-סחוס וסינוביום-על-סחוס. נוצר אב טיפוס עובד באמצעות צלחת בעלת 6 קידוחים (איור 7). העיצוב שומר לעצמו את היכולת לווסת את פני הנגד העליונים והתחתונים לפי הצורך. החלק העליון של הצלחת נייח ומאובטח למתלה חממת תרביות רקמה, ואילו החלק התחתון של הצלחת מחובר לשלב תרגום. בדומה למכשיר בדיקת החיכוך הנוכחי, ניתן להוסיף משקל מת כדי לרשום עומס רגיל. עם הביוריאקטור בסביבה סטרילית, ניתן לדגום מדיה לאורך זמן כדי להעריך תגובות ביולוגיות למשטרי העמסה. איטרציית העיצוב הבאה תחפש ליצור ביוריאקטור עצמאי המשלב תרגום מבוקר מחשב. אם המורכבות של מכשיר בדיקת החיכוך הייתה נשמרת בביוריאקטור, ניתן היה למדוד שינויים בתכונות מכניות ומכנוביולוגיות של רקמות לאורך.
מתואר מכשיר לבדיקת חיכוך המאפשר שליטה על העברת תנועת תרגום הדדית ועומס רגיל לשני פני נגד ביולוגיים מגע. במחקר זה נעשה שימוש בתצורת סינוביום-על-סחוס כדי להדגים את המודולריות של המכשיר ואת היכולת לחקור את תגובות החיכוך של רקמות חיות. התוצאות הייצוגיות אישרו מחדש את תפקידו של הנוזל הסינוביאלי במתן שימון גבולי כדי להפחית את השחיקה והחיכוך של המפרק היומן. המכשיר מאפשר ביצוע של ניסויים רב-ממדיים הנעים בין חיכוך בתפזורת למכנוטרנסדוקציה. התכנון יכול לפעול בתנאים סטריליים במשך מספר שעות וניתן להמירו לביוריאקטור ארוך טווח כדי לשחזר את ההחלקה הדחוסה של המפרק, ובכך להקל על חקר הביומכניקה, המכנוביולוגיה והוויסות הפיזיקלי של רקמות מפרקים חיות. מחקרים עתידיים יתרמו להבנת האופן שבו סביבות גופניות בריאות וחולות משפיעות על תחזוקת המפרקים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
למחברים אין מה לחשוף.
Acknowledgments
עבודה זו נתמכה על ידי הקרן למחקר מדעי אורתופדי, NIH 5R01 AR068133, NIH TERC 5P41EB027062, ו- NIGMS R01 692 GM083925 (מזהה מממן: 10.13039/100000057).
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum foil | Reynolds Group Holdings | Reynolds Wrap | Sterile tissue harvest |
| Aluminum-framed acrylic enclosure | Custom made | Friction tester component | |
| Autoclavable instant sealing sterilization pouches | Fisherbrand | 01-812-54 | Sterilization of tools |
| Autoclave | Buxton | Sterilization of tools | |
| Beaker (250 mL) | Pyrex Vista | 70000 | Tissue harvest |
| Betadine (Povidone Iodine Prep Solution) | Medline Industries, LP | MDS093906 | Sterile tissue harvest |
| Biological safety cabinet | Labconco | Purifier Logic+ Class II, Type A2 BSC | Sterile tissue harvest |
| Biospy punch | Steritool Inc. | 50162 | Tissue harvest |
| Box cutter | American Safety Razor Company | 94-120-71 | Tissue harvest |
| Circular acrylic-sillicone post (synovium) | Custom made | Tissue mounting | |
| Culture media | Custom made | DMEM (Cat No. 11-965-118; Gibco) supplemented with 50 μg/mL L-proline (Cat. No. P5607; Sigma), 100 μg/mL sodium pyruvate (Cat. No. S8636; Sigma), 1% ITS (Cat. No. 354350; Corning), and 1% antibiotic–antimycotic (Cat. No. 15-240-062, Gibco) | |
| Cyanoacrylate (Loctite 420 Clear) | Henkel | 135455 | Tissue mounting |
| Dead weights | OHAUS | Normal load | |
| Ethanol 200 proof | Decon Labs, Inc. | 2701 | Dilute to 70 % |
| Fixed base | ThorLabs, Inc. | SB1T | Friction tester component |
| Forceps (synovium harvest) | Fine Science Tools | 11019-12 | Tissue harvest |
| Forceps (synovium mounting) | Excelta | 3C-S-PI | Tissue mounting |
| Horizontal linear encoder (for translating stage) | RSF Electronics, Inc. | MSA 670.63 | Friction tester component; system resolution of 1 µm |
| Hot glue gun and glue | FPC Corporation | Surebonder Pro 4000A | Tissue mounting |
| LabVIEW | National Instruments Corporation | LabVIEW 2010 | Friction testing program |
| Load cell | JR3 Inc. | 20E12A-M25B | Friction tester component; 0.0019 lbs resolution in x&y, 0.0038 lbs resolution in z |
| Loading platen | Custom made | Tissue mounting | |
| O-ring | Parker | S1138AS568-009 | Tissue mounting |
| Petri dish (60 mm) | Falcon | 351007 | Tissue mounting |
| PivotLok Work Positioner (tibia holder) | Industry Depot, Pivot Lok | PL325 | Tissue harvest |
| Removable base | ThorLabs, Inc. | SB1B | Friction tester component |
| Ring stand | Tissue harvest | ||
| Scalpel blades | Havel's Inc. | FSC22 | Tissue harvest |
| Scalpel handle | FEATHER Safety Razor Co., Ltd. | No. 4 | Tissue harvest |
| Screwdriver | Wera | 3334 | Tissue harvest |
| Stage | JMAR | Friction tester component | |
| Stepper motor | Oriental Motor Co., Ltd. | PK266-03B | Friction tester component |
| Suction tool | Virtual Industries, Inc. | PEN-VAC Vacuum Pen | Tissue mounting |
| Support rod | Custom made | Tissue mounting | |
| Surgical scissors | Fine Science Tools | 14061-09 | Tissue mounting |
| Synovial fluid (bovine) | Animal Technologies, Inc. | Friction testing bath | |
| Testing bath | Custom made | Phosphate-Buffered Saline (PBS) with protease inhibitors: 0.04% isothiazolone-base biocide (Proclin 950 Cat. No. 46878-U; Sigma) and 0.1% protease inhibitor - 0.05 M ethylenediaminetetraacetic acid, EDTA (Cat. No. 0369; Sigma) | |
| Tissue culture incubator | Fisher Scientific | Isotemp | Sterile culture |
| Vertical linear encoder (for loading stage) | Renishaw | T1031-30A | Friction tester component; 20 nm resolution |
| Voice coil actuator | H2W Technologies | NCC20-15-027-1RC | Friction tester component |
References
- US Department of Health and Human Services. The Cost of Arthritis in US Adults. Centers for Disease Control and Prevention. , Available from: https://www.cdc.gov/arthritis/data_statistics/cost.htm (2020).
- Buckwalter, J. A., Mankin, H. J. Instructional course lectures, the American academy of orthopaedic surgeons - articular cartilage. Part II: degeneration and osteoarthrosis, repair, regeneration, and transplantation. JBJS. 79 (4), 612-632 (1997).
- Berenbaum, F. Osteoarthritis as an inflammatory disease (osteoarthritis is not osteoarthrosis). Osteoarthritis and Cartilage. 21 (1), 16-21 (2013).
- Sellam, J., Berenbaum, F. The role of synovitis in pathophysiology and clinical symptoms of osteoarthritis. Nature Reviews Rheumatology. 6 (11), 625-635 (2010).
- Durney, K. M., et al. Immature bovine cartilage wear by fatigue failure and delamination. Journal of Biomechanics. 107, 109852 (2020).
- Oungoulian, S. R., et al. Wear and damage of articular cartilage with friction against orthopedic implant materials. Journal of Biomechanics. 48 (10), 1957-1964 (2015).
- Ateshian, G. A. The role of interstitial fluid pressurization in articular cartilage lubrication. Journal of Biomechanics. 42 (9), 1163-1176 (2009).
- Sophia Fox, A. J., Bedi, A., Rodeo, S. A. The basic science of articular cartilage. Sports Health. 1 (6), 461-468 (2009).
- Krishnan, R., Kopacz, M., Ateshian, G. A. Experimental verification of the role of interstitial fluid pressurization in cartilage lubrication. Journal of Orthopaedic Research. 22 (3), 565-570 (2004).
- Krishnan, R., et al. Removal of the superficial zone of bovine articular cartilage does not increase its frictional coefficient. Osteoarthritis and Cartilage. 12 (12), 947-955 (2004).
- Caligaris, M., Ateshian, G. A. Effects of sustained interstitial fluid pressurization under migrating contact area, and boundary lubrication by synovial fluid, on cartilage friction. Osteoarthritis and Cartilage. 16 (10), 1220-1227 (2008).
- Caligaris, M., Canal, C. E., Ahmad, C. S., Gardner, T. R., Ateshian, G. A. Investigation of the frictional response of osteoarthritic human tibiofemoral joints and the potential beneficial tribological effect of healthy synovial fluid. Osteoarthritis and Cartilage. 17 (10), 1327-1332 (2009).
- Estell, E. G., et al. Attachment of cartilage wear particles to the synovium negatively impacts friction properties. Journal of Biomechanics. 127, 110668 (2021).
- Ateshian, G. A., Mow, V. C. Friction, lubrication, and wear of articular cartilage and diarthrodial joints. Basic Orthopaedic Biomechanics and Mechano-Biology. 3, 447-494 (2005).
- Bonnevie, E. D., Bonassar, L. J. A century of cartilage tribology research is informing lubrication therapies. Journal of Biomechanical Engineering. 142 (3), 031004 (2020).
- Unsworth, A., Dowson, D., Wright, V. Some new evidence on human joint lubrication. Annals of the Rheumatic Diseases. 34 (4), 277-285 (1975).
- Unsworth, A., Dowson, D., Wright, V. The frictional behavior of human synovial joints-part I: natural joints. Journal of Lubrication Technology. 97 (3), 369-376 (1975).
- Shirley Jones, E. Joint Lubrication. The Lancet. 227 (5879), 1043-1045 (1936).
- Ateshian, G. A., et al. The role of osmotic pressure and tension-compression nonlinearity in the frictional response of articular cartilage. Transport in Porous Media. 50 (1), 5-33 (2003).
- Forster, H., Fisher, J. The influence of loading time and lubricant on the friction of articular cartilage. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 210 (2), 109-119 (1996).
- McCutchen, C. W. The frictional properties of animal joints. Wear. 5 (1), 1-17 (1962).
- Pickard, J., Ingham, E., Egan, J., Fisher, J. Investigation into the effect of proteoglycan molecules on the tribological properties of cartilage joint tissues. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 212 (3), 177-182 (1998).
- Wang, H., Ateshian, G. A. The normal stress effect and equilibrium friction coefficient of articular cartilage under steady frictional shear. Journal of Biomechanics. 30 (8), 771-776 (1997).
- Walker, P. S., Dowson, D., Longfield, M. D., Wright, V. Boosted lubrication in synovial joints by fluid entrapment and enrichment. Annals of the Rheumatic Diseases. 27 (6), 512-520 (1968).
- Walker, P. S., Unsworth, A., Dowson, D., Sikorski, J., Wright, V. Mode of aggregation of hyaluronic acid protein complex on the surface of articular cartilage. Annals of the Rheumatic Diseases. 29 (6), 591-602 (1970).
- Gleghorn, J. P., Bonassar, L. J. Lubrication mode analysis of articular cartilage using Stribeck surfaces. Journal of Biomechanics. 41 (9), 1910-1918 (2008).
- Malcom, L. An experimental investigation of the frictional and deformational responses of articular cartilage interfaces to static and dynamic loading. , dissertation (1976).
- Schmidt, T. A., Sah, R. L. Effect of synovial fluid on boundary lubrication of articular cartilage. Osteoarthritis and Cartilage. 15 (1), 35-47 (2007).
- Ateshian, G. A., Wang, H. Rolling resistance of articular cartilage due to interstitial fluid flow. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 211 (5), 419-424 (1997).
- Oungoulian, S. R., et al. Articular cartilage wear characterization with a particle sizing and counting analyzer. Journal of Biomechanical Engineering. 135 (2), 0245011-0245014 (2013).
- Radin, E. L., Paul, I. L., Swann, D. A., Schottstaedt, E. S. Lubrication of synovial membrane. Annals of the Rheumatic Diseases. 30 (3), 322-325 (1971).
- Estell, E. G., et al. Fibroblast-like synoviocyte mechanosensitivity to fluid shear is modulated by Interleukin-1α. Journal of Biomechanics. 60, 91-99 (2017).
- Momberger, T. S., Levick, J. R., Mason, R. M. Hyaluronan secretion by synoviocytes is mechanosensitive. Matrix Biology: Journal of the International Society for Matrix Biology. 24 (8), 510-519 (2005).
- Momberger, T. S., Levick, J. R., Mason, R. M. Mechanosensitive synoviocytes: A Ca2+-PKCα-MAP kinase pathway contributes to stretch-induced hyaluronan synthesis in vitro. Matrix Biology. 25 (5), 306-316 (2006).
- Yanagida-Suekawa, T., et al. Synthesis of hyaluronan and superficial zone protein in synovial membrane cells modulated by fluid flow. European Journal of Oral Sciences. 121 (6), 566-572 (2013).
- Cooke, A. F., Dowson, D., Wright, V. Lubrication of synovial membrane. Annals of the Rheumatic Diseases. 35 (1), 56-59 (1976).
- Goldring, M. B., Berenbaum, F. Emerging targets in osteoarthritis therapy. Current Opinion in Pharmacology. 22, 51-63 (2015).
- Jones, E. A., et al. Synovial fluid mesenchymal stem cells in health and early osteoarthritis: Detection and functional evaluation at the single-cell level. Arthritis and Rheumatism. 58 (6), 1731-1740 (2008).
- Sampat, S. R., et al. Growth factor priming of synovium-derived stem cells for cartilage tissue engineering. Tissue Engineering. Part A. 17 (17-18), 2259-2265 (2011).
- Kurth, T. B., et al. Functional mesenchymal stem cell niches in adult mouse knee joint synovium in vivo. Arthritis and Rheumatism. 63 (5), 1289-1300 (2011).
- Krishnan, R., Mariner, E. N., Ateshian, G. A. Effect of dynamic loading on the frictional response of bovine articular cartilage. Journal of Biomechanics. 38 (8), 1665-1673 (2005).
- Bonnevie, E. D., Baro, V., Wang, L., Burris, D. L. In-situ studies of cartilage microtribology: roles of speed and contact area. Tribology Letters. 41 (1), 83-95 (2011).
- Bian, L., et al. Dynamic mechanical loading enhances functional properties of tissue-engineered cartilage using mature canine chondrocytes. Tissue Engineering. Part A. 16 (5), 1781-1790 (2010).
- Mow, V. C., Wang, C. C., Hung, C. T. The extracellular matrix, interstitial fluid and ions as a mechanical signal transducer in articular cartilage. Osteoarthritis and Cartilage. 7 (1), 41-58 (1999).
- Wang, C. C. -B., et al. The functional environment of chondrocytes within cartilage subjected to compressive loading: a theoretical and experimental approach. Biorheology. 39 (1-2), 11-25 (2002).
- Carter, M. J., Basalo, I. M., Ateshian, G. A. The temporal response of the friction coefficient of articular cartilage depends on the contact area. Journal of Biomechanics. 40 (14), 3257-3260 (2007).
- Jones, B. K., Durney, K. M., Hung, C. T., Ateshian, G. A. The friction coefficient of shoulder joints remains remarkably low over 24 h of loading. Journal of Biomechanics. 48 (14), 3945-3949 (2015).



