Overview
Fonte: Michael S. Lee1 e Tonya J. Webb1
1 Departamento de Microbiologia e Imunologia, Faculdade de Medicina da Universidade de Maryland e o Centro de Câncer Integral Marlene e Stewart Greenebaum, Baltimore, Maryland 21201
Imunohistoquímica (IHC) e imunocytoquímica (ICC) são técnicas utilizadas para visualizar a expressão e localização de antígenos específicos usando anticorpos. O primeiro uso publicado do IHC foi em 1941, quando Albert Coons usou a técnica para visualizar a presença de antígeno pneumocócico em seções de tecidos de camundongos infectados com Pneumococcus (1). O nome, imunohistoquímica, é derivado das raízes "imuno-", em referência a anticorpos, e "histo-", em referência às seções teciduais usadas no IHC. A raiz "cito-" na imunocitoquímica destaca a diferença fundamental entre ICC e IHC. Enquanto o IHC usa seções de tecido inteiro, o ICC usa células isoladas do tecido ou cultivadas na cultura. A diferença nas amostras utilizadas significa que a preparação da amostra difere tecnicamente entre iHC e ICC, mas caso contrário, os protocolos para ICC e IHC são idênticos e descobrirão que os termos são frequentemente usados de forma intercambiável.
Tanto no IHC quanto no ICC, anticorpos com etiquetas químicas ou fluorescentes, como peroxidase ou rhodamina, respectivamente, são usados para visualizar a distribuição de qualquer antígeno de interesse através de ligação específica do anticorpo marcado ao antígeno. No caso do IHC, finas fatias de tecido são imobilizadas em um slide para manter a estrutura do tecido antes de serem manchadas, permitindo a visualização de antígenos no contexto de tecidos inteiros (Figura 1). No caso do ICC, as células são distribuídas uniformemente em um slide antes de serem manchadas, permitindo a visualização da distribuição de antígenos dentro de células individuais, mas não dentro da estrutura de qualquer tecido específico. Devido às semelhanças entre os dois protocolos, este protocolo se concentrará no IHC para abordar as complexidades adicionais da preparação da amostra envolvida no IHC.
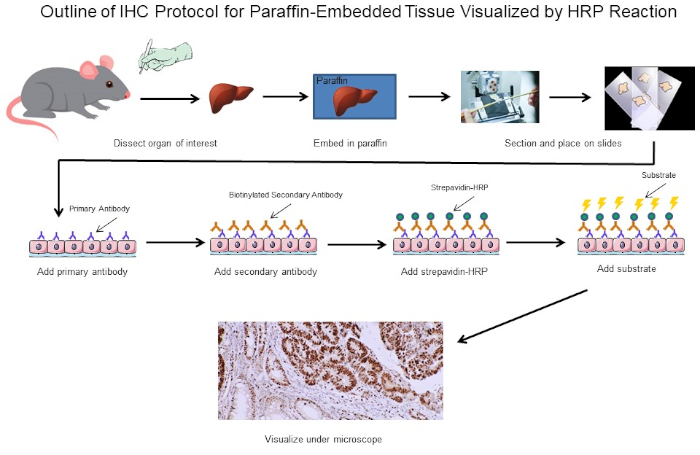
Figura 1: Esboço do Protocolo IHC. Esboço visual de um protocolo IHC para tecido embutido em parafina dissecado a partir de um rato. Este protocolo usa um anticorpo secundário biotinína e strepavidin-HRP para visualizar a localização da ligação de anticorpos. Outras opções, como anticorpos fluorescentes marcados, também são possíveis. Clique aqui para ver uma versão maior desta figura.
A primeira grande decisão ao realizar o IHC é como preparar as seções teciduais para manter a estrutura do tecido durante todo o processo de coloração. As duas principais opções são seções fixadas de formalina de tecido embutido em parafina ou seções frescas de tecido congelado. Não há uma resposta simples sobre qual método usar, pois depende de qual análise a jusante será conduzida. A fixação de formalina de tecidos incorporados para a parafina é geralmente pensada para preservar melhor a morfologia tecidual para uma imagem ideal, enquanto o congelamento de tecido fresco pode preservar a função proteica para ensaios subsequentes fora do IHC. Além disso, seções de tecido congelado fresco têm se mostrado mais adequadas para a análise da expressão genética (2). Uma terceira consideração é se os anticorpos para o seu antígeno de interesse são adequados para seções de tecido fixo ou congelado, pois alguns anticorpos só foram otimizados para um tipo específico de seção e podem não funcionar para outros. Por fim, também é preciso determinar quanto tempo eles precisam para armazenar as seções de tecido, uma vez que amostras congeladas frescas devem ser mantidas a -80°C e podem não durar mais de um ano enquanto seções fixas podem ser armazenadas por muito mais tempo à temperatura ambiente. Estas são algumas das principais considerações para determinar se usar seções fixas de formalina de tecido embutido parafina ou seções frescas de tecido congelado. Em última análise, se alguém tem tecido suficiente, talvez seja melhor ter alguns dos dois.
Neste experimento, nos propusemos a determinar se a expressão cyclin D1 foi aumentada em baços ampliados a partir de um modelo espontâneo de desenvolvimento de linfoma. Amostras de tecido esplênico foram isoladas pela primeira vez de camundongos do tipo selvagem, camundongos transgênicos que não têm linfoma, ou camundongos transgênicos que desenvolveram linfoma espontaneamente. As amostras de tecido de baço foram fixadas em paraformaldeído, embutidas em parafina, seccionadas, manchadas usando um anticorpo primário anti-cíclin D1 seguido por um anticorpo secundário anti-rato de cavalo, e desenvolvidas usando 3,3 diaminobenzidina (DAB). As seções foram então contra-manchadas na Solução de Hematoxilina Harris e, em seguida, as seções foram imagens em ampliação de 20X.
Reagentes
Seções incorporadas à parafina
- 4% paraformaldeído (PFA)
- Etanol (anidro desnaturado, grau histológico 100%, 95%, 80%, 75% e 50%). Pode ser diluído de estoque 100% usando água dupla destilada (ddH2O)
- Xileno
- Lâmina de vidro compatível com IHC para garantir que a seção tecidual permaneça presa durante todo o procedimento. Slides de vidro compatíveis com IHC têm um revestimento especializado e estão prontamente disponíveis em vários varejistas. Se estiver executando o ICC, use um slide com câmara. Os slides de câmara permitem que as células sejam semeadas nas câmaras e colocadas na incubadora até que as células se conectem ao slide e atinjam a confluência adequada, momento em que as câmaras podem ser removidas e a coloração pode proceder da mesma maneira que o IHC.
- Parafina
- 0,3% peróxido de hidrogênio (H2O2)/metanol: Para preparar, adicione 1 mL 30% H2O2 a 99 mL de metanol. Armazenar a -20°C
- Tampão de recuperação de antígeno: PH 6.0 tampão de citrato IHC
Seções congeladas frescas
- Composto de incorporação da temperatura de corte ideal (OCT)
- Fixação ideal: 4% PFA ou acetona que foi resfriado a -20°C
Mancha
- Tampão de bloqueio: Deve ser determinado pelo usuário. Um exemplo é o soro de cavalo diluído em 1X PBS
- Anticorpo primário diluído: veja as especificações do fabricante
- Anticorpo secundário biotinilado diluído: veja as especificações do fabricante
- Visão diluído peroxidase (HRP): Somente para visualização peroxidase. Veja as especificações do fabricante.
- DAB ou outro substrato compatível
- Contra-mancha (opcional)
- Etanol (anidro desnaturado, grau histológico 100% e 95%)
- Xileno
- Monte Organo/Limonene
Procedure
1. Preparação de Células para Imunocytoquímica
- Células de sementes de interesse em lâminas câmara ou tampas câmaras adicionando 0,5 mL de suspensão celular aos poços de uma placa de cultura de 24 poços.
Nota: Algumas células podem exigir crescimento em tampas tratadas, como deslizamentos tratados com poli-lisina. As condições ideais de tratamento devem ser determinadas pelo usuário, dependendo do tipo celular que está sendo utilizado. - Coloque a placa em uma incubadora de CO2 umidificada e permita que as células cresçam a 37°C até 50-70% confluentes.
- Uma vez que as células atinjam a confluência ideal, remova a mídia cultural de cada poço e, em seguida, fixe as células incubando-as em 0,5 mL de 4% PFA (diluída em 1X PBS) e incubar por 20 minutos à temperatura ambiente.
- Retire o fixador e lave os poços três vezes com 1 mL de PBS 1X.
- Em seguida, permeabilize as células adicionando 0,5 mL de 0,1% Triton-X-100 em 1X PBS para cada poço e incubar por 15 minutos à temperatura ambiente.
- Aspire o tampão de permeabilização e lave os poços três vezes com 1 mL de 1X PBS.
- As células em tampas são agora fixas e permeabilizadas. Proceda ao procedimento de coloração demonstrado para o seguinte exemplo de imunohistoquímica, com exceção de que as incubações devem ser realizadas dentro dos poços da placa de poço 24, em vez de diretamente em um slide de seção de tecido.
2. Preparação de Seções Parafina-Fixadas para Coloração
- Obter seções de tecido embutidas de formalina preparadas.
Desparafinação
- Mergulhe os slides em 100% xileno 2 vezes por 5 minutos cada.
Reidratação
- Mergulhe os slides em 100% etanol 2 vezes por 3 minutos cada.
- Mergulhe os slides em 95% de etanol por 3 min.
- Mergulhe os slides em 70% de etanol por 3 min.
- Mergulhe os slides em 50% de etanol por 3 min.
Bloqueando atividade peroxidase endógena
- Incubar os slides em 100 mL de 0,3% H2O2 por 30 min a temperatura ambiente.
- Lave os slides com 1X PBS 2 vezes por 5 minutos cada.
Recuperação de antígenos
- Mergulhe os slides no tampão citrato IHC (pH 6) e ferva-os por 20 minutos.
- As lâminas de tecido estão prontas para coloração.
3. Preparação de seções recém-congeladas e incorporadas oTC para coloração
- Coloque 5 mm de tecido fresco isolado em um molde e adicione OCT até que a seção esteja completamente coberta.
- Submergir lentamente o bloco tecidual em nitrogênio líquido até ficar completamente congelado. A amostra agora pode ser armazenada a -80°C por até 1 ano.
- Uma vez pronto para a secção, transfira o bloco de tecido congelado para um criostat e permita que toda a configuração chegue a -20°C.
- Corte seções de tecido de 5 a 10 μm de espessura usando um criostat e use pincel para colocar seções diretamente em lâminas de vidro compatíveis com IHC.
- Deixe os slides secarem durante a noite à temperatura ambiente. Os slides também podem ser armazenados a -80°C.
- Mergulhe os slides em 250 mL de 4% PFA por 15 minutos à temperatura ambiente para corrigir os slides antes da coloração. O método de fixação ideal deve ser determinado pelo usuário.
- Mergulhe os slides em 250 mL de 1X PBS 2 vezes por 5 min cada.
- Mergulhe os slides em 250 mL de 0,3% H2O2 por 30 min em temperatura ambiente, a fim de bloquear qualquer atividade peroxidase endógena.
- Mergulhe os slides em 250 mL de 1X PBS 2 vezes por 5 min cada.
- Os slides estão prontos para coloração.
4. Mancha
- Circule o tecido com uma barreira hidrofóbica usando uma caneta de barreira.
Bloqueio
- Usando uma pipeta, coloque 100 μL de tampão de bloqueio (soro de cavalo diluído em 1X PBS) - sobre a seção durante 1 hora em temperatura ambiente.
- Remova o tampão de bloqueio usando uma pipeta.
Incubação primária de anticorpos
- Incubar o tecido cercado com solução de anticorpos primários diluídos de 100 μL (cilina anti-humana do rato D1 diluída 1:100 no buffer de bloqueio) por 30 minutos à temperatura ambiente.
- Escorra o anticorpo primário de cada slide e lave os slides com 1X PBS 2 vezes por 5 minutos cada.
Incubação secundária de anticorpos
- Incubar a amostra com 100 μL de anticorpo secundário biotinilado diluído (cavalo antinacinado anti-rato IgG diluído 1:200) por 30 minutos à temperatura ambiente.
- Remova o anticorpo secundário drenando as seções e lave com 1X PBS 2 vezes por 5 minutos cada.
Desenvolvimento de cores
- Visualização usando HRP: Adicione 100 μL de reagente do complexo avidin-biotina (ABC) e incuba as seções no escuro por 30 minutos à temperatura ambiente
Nota: Anticorpos fluorescentes também podem ser usados e visualizados usando um microscópio apropriado. - Lave os slides com 1X PBS 2 vezes por 5 minutos cada.
- Desenvolva os slides incubando as seções em 100 μL de DAB por até 5 min.
- Pare o desenvolvimento adicionando água destilada (dH2O) por 5 min a temperatura ambiente.
Contra-retenção (se desejar)
- Mergulhe os slides brevemente na Solução de Hematoxilina Harris (ou 0,5% verde metil em acetato de sódio de 0,1M (pH 4,2)) por 10 minutos.
- Enxágüe a contra-mancha lavando slides em dH 2 O duasvezespor 5 min cada.
Desidratação
- Mergulhe os slides em 95% de etanol 2 vezes por 5 min cada.
- Mergulhe os slides em 100% etanol 2 vezes por 5 minutos cada.
- Mergulhe os slides em 100% xileno 2 vezes por 5 minutos cada.
- Borrida os slides com uma toalha de papel.
Aplicativo de montagem e coberturas
- Adicione uma gota de mídia de montagem, como Organo-Limonene Mount, aos slides e coloque um deslizamento sobre as seções.
Análise microscópica
- Observe as seções manchadas sob um microscópio apropriado para análise. Aqui um microscópio de luz padrão foi usado para observação e uma câmera digital montada foi usada para imagem.
A imunocitoquímica e a imunohistoquímica são métodos de coloração para uma proteína de interesse em células e tecidos cultos, respectivamente. O princípio básico de ambas as técnicas relacionadas envolve o uso de anticorpos específicos marcados com um sistema de detecção para identificar e visualizar a proteína e determinar sua localização dentro das células e tecidos, bem como os níveis relativos. O processo em qualquer experimento começa com a preparação da amostra.
Para a imunoctoquímica, que visualiza especificamente locais de proteínas ou antígenos nas células, isso envolve três passos. O primeiro passo é o revestimento, que implica a cultura das células em meios de crescimento em um deslizamento de cobertura ou slide, tipicamente, nos poços de uma placa de cultura. Isso é seguido pela fixação, onde um agente precipitante ou transligador como o paraformaldeído é adicionado às células para preservar a integridade estrutural das proteínas e evitar que a atividade enzimática as degrade. O último passo é a permeabilização, que envolve a adição de um detergente para tornar as membranas celulares permeáveis para a coloração.
No método de contrapartida, a imunohistoquímica, proteínas ou antígenos são visualizados em tecidos e a preparação da amostra tem cinco passos. Primeiro, todo o tecido é submetido à fixação, geralmente com paraformaldeído. Isso é seguido pela incorporação do tecido em um bloco de parafina, e, em seguida, secção deste bloco usando uma máquina chamada microtome para cortar o tecido em fatias finas que podem ser colocadas em lâminas. Em seguida, os slides são submetidos à desparafinação, ou remoção da parafina ao redor da fatia de tecido. Em seguida, um passo opcional de recuperação de antígeno pode ser realizado. Isso pode ser feito usando calor ou enzimas para desmascarar epítopos que foram cruzados durante a fixação, tornando-os disponíveis para ligação de anticorpos. Após a preparação adequada da amostra, um anticorpo primário específico do alvo é adicionado à amostra celular ou tecidual. Este anticorpo primário deve se ligar à proteína de interesse. Em seguida, um anticorpo secundário é adicionado, que detecta e se liga ao anticorpo primário. Este anticorpo secundário é conjugado ou pode se ligar a uma enzima chamada HRP. Quando seu substrato específico, DAB, é adicionado, o HRP converte isso em um precipitado marrom insolúvel. Esta mancha marrom marca a localização da proteína alvo. Os slides também estão manchados com hematoxilina, que rotula os núcleos em azul e fornece um ponto de referência espacial para determinar a localização subcelular. Depois disso, a mídia de montagem é adicionada ao slide, seguida de um deslizamento de cobertura, a fim de selar e preservar a amostra manchada. Finalmente, os slides podem ser imagens em um microscópio leve.
Neste vídeo, você observará a técnica de preparação da amostra para células banhadas e seções teciduais, seguida de imunossuagem das seções teciduais.
Primeiro, as células de interesse precisam estar sentadas em tampas. Para isso, trabalhando em uma capa de cultura de tecidos, coloque tampas individuais nos poços de uma placa de 24 poços. Em seguida, feche a faixa e ligue a luz UV para esterilizar as tampas por pelo menos 15 minutos. Em seguida, desligue a luz UV. Para levantar as células de interesse de um prato confluente de 10 centímetros, aspire a mídia, lave brevemente com PBS e adicione trippsina às células por 2 minutos. Em seguida, toque na lateral da placa para garantir que as células se despeçam e neutralizem o trypsin com a mídia. Em seguida, adicione 0. 5 mL da suspensão da célula em cada poço, certificando-se de cobrir as manchas. Coloque a placa em uma incubadora de CO2 umidificada e permita que as células cresçam a 37 graus celsius até que sejam 50-70% confluentes.
Uma vez que as células atinjam a confluência ideal, aspire o meio de cultura de cada poço e, em seguida, fixe as células incubando-as em . 5 mL de 4% de paraformaldeído diluído em 1X PBS por 20 minutos em temperatura ambiente. Depois de remover o fixador, enxágue as células adicionando 1 mL de 1X PBS sobre cada deslizamento de cobertura. Aspire imediatamente o PBS e repita a lavagem mais 2 vezes para um total de 3 lavagens.
Agora, permeablize as células adicionando 0,5 mL de Triton X-100 em 1X PBS a cada poço. Deixe a placa em temperatura ambiente por 15 minutos. Aspire o tampão de permeabilização e enxágue as células adicionando 1 mL de 1X PBS em cada poço. Aspire imediatamente o PBS e repita a lavagem mais 2 vezes para um total de 3 lavagens. Agora que as células das tampas são fixas e permeabilizadas, proceder ao procedimento de coloração demonstrado para o seguinte exemplo de imunohistoquímica, com exceção de que as incubações devem ser realizadas dentro dos poços da placa de 24 poços em vez de diretamente em uma lâmina de seção de tecido.
Para começar, obtenha seções de tecido preparadas, fixas em parafina. Desparafinar os slides colocando-os em um rack de slides e, em seguida, imerso completamente em 250 mL de 100% xileno. Deixe os slides incubarem por 5 minutos no xileno. Em seguida, retire os slides do recipiente, limpe-os com uma toalha de papel e coloque-os em um novo banho de xileno em um recipiente fresco por mais 5 minutos.
Em seguida, reidratar as seções em uma série de soluções de etanol classificados começando com 100% de etanol por 3 minutos. Limpe o rack de slides com uma toalha de papel e transfira os slides para um novo recipiente de 100% de etanol por mais 3 minutos. Continue este ciclo de lavagem, secagem com uma toalha de papel, e transferindo os slides para um novo banho seguindo as concentrações indicadas de etanol para o tempo especificado. Após a lavagem final do etanol, limpe o rack com uma toalha de papel e incuba os slides em 100 mL de peróxido de hidrogênio de 0,3% por 30 minutos à temperatura ambiente, a fim de bloquear qualquer atividade peroxidase endógena. Lave os slides em 250 mL de 1X PBS por 5 minutos. Repita esta lavagem em um recipiente de PBS 1X fresco por mais 5 minutos.
Em seguida, realize a recuperação de antígeno imergindo os slides em 250 mL de tampão citrato IHC no pH 6.0 e fervendo-os por 20 minutos. Em seguida, prossiga para o protocolo de coloração.
Para iniciar o processo de coloração para IHC, circule as seções com uma caneta hidrofóbica para identificar a área mínima que o buffer precisa cobrir. Em seguida, use uma pipeta para colocar 100 microliters de tampão de bloqueio, que neste experimento é o soro de cavalo diluído em 1X PBS, sobre a seção. Incubar os slides por 1 hora em temperatura ambiente. Depois disso, remova o tampão de bloqueio usando uma pipeta.
Em seguida, diluir o anticorpo primário e bloquear o buffer em uma diluição de 1:100 adicionando 990 microliters de soro de cavalo diluídos em 1X PBS em um 1. Tubo Eppendorf de 5 mL, seguido por 10 microlitres do anticorpo primário. Adicione 100 microliters do anticorpo primário diluído a cada seção e incubar os slides por 30 minutos à temperatura ambiente. Quando o temporizador soar, drene o anticorpo primário de cada lâmina e depois lave-os em 250 mL de 1X PBS por 5 minutos. Repita esta lavagem mais uma vez usando pbs 1X fresco.
Enquanto os slides estão lavando em 1X PBS, diluir o anticorpo secundário a uma diluição de 1:200 adicionando 995 microliters de tampão de bloqueio a um tubo de 1,5 mL seguido por 5 microliters do anticorpo secundário, que neste caso é o anti-rato de cavalo biotinilado IGG. Adicione 100 microlitres do anticorpo secundário diluído a cada seção e, em seguida, incubar os slides por 30 minutos à temperatura ambiente. Após 30 minutos, remova o anticorpo secundário drenando-o das seções e, em seguida, lave os slides em 250 mL de 1X PBS por 5 minutos. Repita esta lavagem usando pbs 1X fresco.
Agora, adicione 100 microliters de reagente complexo avidin-biotina, e incuba as seções no escuro por 30 minutos à temperatura ambiente. Em seguida, lave os slides imergindo-os em 250 mL de 1X PBS por 5 minutos. Semelhante aos passos de lavagem anteriores, repita esta lavagem mais uma vez usando pbs 1X fresco. Em seguida, desenvolva os slides incubando as seções em 100 microliters de DAB por até 5 minutos. Pare o desenvolvimento imergindo as seções em 250 mL de água destilada por 5 minutos.
Agora, slides podem ser neutralizado, se desejar. Para isso, mergulhe brevemente os slides em 250 mL da Solução harris hematoxylin. Enxágüe a contra-mancha lavando as lâminas em 250 mL de água destilada por 5 minutos. Repita esta lavagem mais 1 tempo usando água fresca destilada. Em seguida, desidratar as seções. Para isso, primeiro incubar os slides em 95% de etanol por 5 minutos. Borricar os slides em uma toalha de papel, e transferi-los para um novo recipiente de 95% de etanol fresco por mais 5 minutos. Continue o ciclo de lavagem, mancha com uma toalha de papel, e transfira os slides para um novo banho, seguindo as soluções indicadas por 5 minutos cada.
Após a incubação final, borre os slides com uma toalha de papel, em seguida, adicione uma gota de mídia de montagem, como Organo-Limonene Mount, aos slides. Agora, coloque uma mancha sobre as seções, tomando cuidado para não prender bolhas de ar. Os slides estão agora prontos para serem observados sob um microscópio para análise.
Para observar as seções manchadas, use um microscópio de luz padrão para visualizar a mancha e uma câmera digital para capturar a imagem. Neste exemplo particular de IHC, tecidos de baço do tipo selvagem e camundongos espontâneos, transgênicos duplos ou DTG, são comparados para estudar a expressão Dyclin D1 em linfoma. Os tecidos foram incorporados, seccionados e manchados com anticorpo anticiclina D1, e retratados a ampliação de 20X. As células expressas cyclin D1 são indicadas pela cor marrom-avermelhada contra o fundo do tecido azul. Comparando as intensidades de coloração entre as imagens dos vários camundongos, os baços não aumentados têm quantidades relativamente baixas de expressão Cyclin D1, independentemente do genótipo do rato. Em contraste, o baço ampliado do mouse DTG, mostra uma maior coloração marrom-avermelhada indicando uma correlação entre o desenvolvimento do câncer e a expressão Cyclin D1 neste modelo de mouse.
Subscription Required. Please recommend JoVE to your librarian.
Results
IHC e ICC têm uma vasta gama de aplicações. Por exemplo, um uso do IHC é examinar a expressão de oncogenes em modelos espontâneos de camundongos de desenvolvimento de tumores. Na Figura 2,nos propusemos a determinar se a expressão cyclin D1 foi aumentada em baços aumentados em um modelo de camundongo espontâneo de desenvolvimento de linfoma. As amostras de tecido esplênico foram fixadas em paraformaldeído, embutidas em parafina, seccionadas, manchadas usando um anticorpo anti-cíclin D1 (diluído 1:200 no buffer de bloqueio), e então as seções foram imagens em ampliação de 20X. As células expressas cyclin D1 são indicadas pela cor marrom-avermelhada contra o fundo do tecido azul. Esses resultados sugerem que a expressão cíclina D1 foi aumentada em baços aumentados, indicando uma correlação entre o desenvolvimento do câncer e a expressão cyclin D1 neste modelo.

Figura 2: Expressão de Cyclin D1 esplênica em um modelo de rato duplo transgênico espontâneo (DTG) de linfoma. Uma imagem de tecido esplênico manchado com um anticorpo primário anti-Cyclin D1, contra-manchado com verde metil, e visualizado usando um anticorpo secundário biotinína e reagente ABC ativado com substrato DAB. A cor marrom-avermelhada representa locais onde o anticorpo tem limite indicando a presença de Cyclin D1 expressando células tumorais dentro da estrutura do tecido esplênico que foi contra-manchado azul. Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Imunohistoquímica (IHC) e imunocytoquímica (ICC) são técnicas utilizadas para visualizar a expressão e localização de antígenos específicos usando anticorpos. Os tecidos são primeiro cortados em seções finas que mantêm a morfologia tecidual e colocados em um slide. Os anticorpos são então adicionados e ligarão o antígeno de interesse e são equipados com uma etiqueta específica que permite que eles sejam visualizados sob um microscópio. Assim, por meio desse conceito básico, a distribuição de antígenos no contexto da estrutura tecidual pode ser visualizada e estudada. No entanto, embora o conceito abrangente seja básico, existem múltiplas abordagens e variações diferentes que foram desenvolvidas que aumentam tanto a complexidade quanto a utilidade dessas técnicas. Este artigo abordou o conceito básico de IHC e ICC, as principais decisões que precisam ser consideradas ao utilizar essas técnicas, e um protocolo passo a passo detalhado. As imagens produzidas pelo IHC e pelo ICC são geralmente o produto final e podem ser publicadas como é para destacar diferenças óbvias em quantidades ou distribuição de manchas entre diferentes condições.
Subscription Required. Please recommend JoVE to your librarian.
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).




