Overview
מקור: מייקל ס. לי1 וטניה ג'יי ווב1
1 המחלקה למיקרוביולוגיה ואימונולוגיה, בית הספר לרפואה של אוניברסיטת מרילנד ומרכז הסרטן המקיף מרלן וסטיוארט גרינבאום, בולטימור, מרילנד 21201
אימונוהיסטוכימיה (IHC) ואימונוציטוכימיה (ICC) הן טכניקות המשמשות להדמיית הביטוי והלוקליזציה של אנטיגנים ספציפיים המשתמשים בנוגדנים. השימוש הראשון שפורסם ב- IHC היה בשנת 1941 כאשר אלברט קונס השתמש בטכניקה כדי לדמיין את נוכחותו של אנטיגן פנאומוקוק בחלקי רקמות מעכברים נגועים בפנאומוקוק (1). השם, אימונוהיסטוכימיה, נגזר מהשורשים "אימונו-", בהתייחס לנוגדנים, ו"היסטו-", בהתייחס למקטעי הרקמה המשמשים ב- IHC. השורש "ציטו-" בחיסון מדגיש את ההבדל העיקרי בין ICC ו- IHC. בעוד IHC משתמש בחלקים של רקמה שלמה, ICC משתמש בתאים כי כבר מבודדים רקמה או גדלו בתרבית. ההבדל בדגימות המשמשות פירושו הכנת מדגם מבחינה טכנית שונה בין IHC לבית הדין הפלילי הבינלאומי, אבל אחרת הפרוטוקולים עבור ICC ו- IHC זהים ואחד ימצא את המונחים משמשים לעתים קרובות לסירוגין.
הן ב- IHC והן ב- ICC, נוגדנים עם תגים כימיים או פלואורסצנטיים, כגון פרוקסידאז או רודמין, בהתאמה, משמשים להדמיה של כל אנטיגן של עניין באמצעות כריכה ספציפית של הנוגדן המתויג לאנטיגן. במקרה של IHC, פרוסות דקות של רקמה משותקות בשקופית כדי לשמור על מבנה הרקמה לפני שהוכתמה, ומאפשרת הדמיה של אנטיגנים בהקשר של רקמות שלמות (איור 1). במקרה של ICC, תאים מופצים באופן שווה על שקופית לפני שהם מוכתמים, ומאפשר הדמיה של הפצת אנטיגן בתוך תאים בודדים, אבל לא בתוך המבנה של כל רקמה ספציפית. בשל הדמיון בין שני הפרוטוקולים, פרוטוקול זה יתמקד ב- IHC כדי לטפל במורכבויות הנוספות של הכנת מדגם המעורבות ב- IHC.
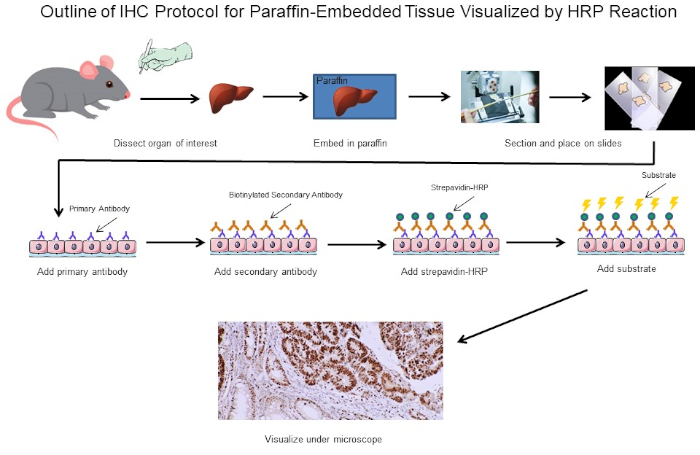
איור 1: חלוקה לרמות של פרוטוקול IHC. קו מיתאר חזותי של פרוטוקול IHC עבור רקמה מוטבעת פרפין ניתח מעכבר. פרוטוקול זה משתמש בנוגדן משני ביוטיניל וסטרפדין-HRP כדי לדמיין את המיקום של כריכת נוגדנים. אפשרויות אחרות, כגון נוגדנים מתויגים פלואורסצנטית, אפשריות גם כן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ההחלטה העיקרית הראשונה בעת ביצוע IHC היא כיצד להכין את קטעי הרקמה על מנת לשמור על מבנה הרקמה לאורך כל תהליך הכתמים. שתי האפשרויות העיקריות הן קטעים קבועים פורמלין של רקמה מוטבעת פרפין או חלקים טריים של רקמה קפואה. אין תשובה פשוטה באיזו שיטה להשתמש כפי שהוא תלוי מה ניתוח במורד הזרם יבוצע. קיבוע פורמלין של רקמות מוטבעות פרפין נחשב בדרך כלל כדי לשמר טוב יותר את מורפולוגיה של רקמות להדמיה אופטימלית בעוד הקפאת רקמה טרייה יכולה לשמר את תפקוד החלבון לבדיקות הבאות מחוץ ל- IHC. בנוסף, סעיפי רקמות קפואות טריות הוכחו כמתאימים יותר לניתוח ביטוי גנים (2). שיקול שלישי הוא האם הנוגדנים לאנטיגן שלך מתאימים לחלקי רקמות קבועים או קפואים, שכן נוגדנים מסוימים עברו אופטימיזציה רק לסוג מסוים של מקטע וייתכן שאינם מתאימים לאחרים. לבסוף, אחד גם צריך לקבוע כמה זמן הם צריכים לאחסן את קטעי הרקמות, כמו דגימות קפוא טרי חייב להישמר ב -80 מעלות צלזיוס ולא יכול להימשך מעבר לשנה אחת בעוד חלקים קבועים ניתן לאחסן הרבה יותר זמן בטמפרטורת החדר. אלה הם כמה מהשיקולים העיקריים לקביעת אם להשתמש בקטעים קבועים פורמלין של רקמה מוטבעת פרפין או חלקים טריים של רקמה קפואה. בסופו של דבר, אם לאחד יש מספיק רקמה, אולי עדיף רק שיהיו לך כמה משניהם.
בניסוי זה, יצאנו לקבוע אם ביטוי ציקלין D1 הוגדל בטחול מוגדל ממודל עכבר ספונטני של התפתחות לימפומה. דגימות רקמת הטחול בודדו תחילה מעכברים מסוג בר, עכברים מהונדסים שאין להם לימפומה, או עכברים מהונדסים שפיתחו לימפומה באופן ספונטני. דגימות רקמת הטחול תוקנו בפרפורמלדהיד, מוטבעות בפרפין, בחתך, מוכתמות באמצעות נוגדן ראשוני נגד ציקלין D1 של עכבר ואחריו נוגדן משני נגד עכברים, ופותחו באמצעות 3,3-דיאמינובנזידין (DAB). לאחר מכן, המקטעים הוטענו בפתרון האריס המטוקסילין ואז המקטעים צולמו בהגדלה של פי 20.
ריאגנטים
מקטעים מוטבעים בפרפין
- 4% Paraformaldehyde (PFA)
- אתנול (דנטורה נטולת מים, ציון היסתולוגי 100%, 95%, 80%, 75%, ו -50%). ניתן לדלל מ-100% מלאי באמצעות מים מזוקקים כפולים (ddH2O)
- קסילן
- שקופית זכוכית תואמת IHC כדי להבטיח שסעיף הרקמות יישאר מחובר לאורך כל ההליך. שקופיות זכוכית תואמות IHC כוללות ציפוי מיוחד והן זמינות בקלות מקמעונאים מרובים. אם אתה מבצע ICC, השתמש בשקופית עם תאים. שקופיות צמודות מאפשרות לזרע תאים בתאים ולהניח אותם באינקובטור עד שהתאים מתחברים לשקופית ומגיעים להשפעה נאותה, ובשלב זה ניתן להסיר את התאים ולהכתים יכולים להמשיך באותו אופן כמו IHC.
- פרפין
- 0.3% מי חמצן (H2O2)/מתנול: כדי להכין, להוסיף 1 מ"ל 30% H2O2 עד 99 mL מתנול. יש לאחסן ב-20°C
- מאגר אחזור אנטיגן: IHC ציטוט מאגר pH 6.0
חלקים קפואים טריים
- טמפרטורת חיתוך אופטימלית (OCT) הטמעה תרכובת
- קיבוע אופטימלי: 4% PFA או אצטון כי כבר מקורר כדי -20°C
כתמים
- מאגר חסימה: יש לקבוע על-ידי המשתמש. דוגמה אחת היא סרום סוס מדולל ב- PBS 1X
- נוגדן ראשי מדולל: ראה מפרטי היצרן
- נוגדן משני דילול ביוטיניל: ראה מפרט היצרן
- פרוקסידאז אבידין-חזרת מדולל (HRP): רק להדמיה של פרוקסידאז. ראה מפרטי היצרן.
- DAB או מצע תואם אחר
- tain נגדי (אופציונלי)
- אתנול (דנטורוס נטול מים, ציון היסתולוגי 100% ו-95%)
- קסילן
- הר אורגנו/לימונן
Procedure
1. הכנת תאים לאימונוציטוכימיה
- תאי זרעים מעניינים על מגלשות תאים או כיסויים מקוביים על ידי הוספת 0.5 מ"ל של השעיית תאים לבארות של צלחת תרבות 24 היטב.
הערה: תאים מסוימים עשויים לדרוש צמיחה על כיסויים מטופלים, כגון כיסויים שטופלו פולי-ליזין. תנאי טיפול אופטימליים צריכים להיקבע על ידי המשתמש בהתאם לסוג התא המשמש. - מניחים את הצלחת לתוך אינקובטור CO2 לח ולאפשר לתאים לגדול ב 37 מעלות צלזיוס עד 50-70% confluent.
- ברגע התאים להגיע למפגש אופטימלי, להסיר את מדיה תרבית מכל באר ולאחר מכן, לתקן את התאים על ידי דגירה אותם ב 0.5 מ"ל של 4% PFA (מדולל ב 1X PBS) ודגרה במשך 20 דקות בטמפרטורת החדר.
- הסר את הקיבעון ולשטוף את בארות שלוש פעמים עם 1 מ"ל של 1X PBS.
- לאחר מכן, לפרמיביל להפוך את התאים על ידי הוספת 0.5 מ"ל של 0.1% טריטון-X-100 ב 1X PBS לכל באר ודגרה במשך 15 דקות בטמפרטורת החדר.
- שאפו את חיץ permeabilization ולשטוף את בארות שלוש פעמים עם 1 מ"ל של 1X PBS.
- התאים על כיסויים קבועים כעת וחלחלו. המשך להליך הכתמים שהודגם עבור הדוגמה האימונוהיסטוכמית הבאה - למעט כי הדגירות צריכות להתבצע בתוך הבארות של צלחת 24 באר ולא ישירות על שקופית קטע רקמה.
2. הכנת מקטעים קבועים בפורמלין, משובצים פרפין להכתמה
- השג מקטעי רקמות מוטבעים בפורמלין קבועים, פרפין.
דפראפיניזציה
- לטבול את השקופיות 100% קסילן 2 פעמים במשך 5 דקות כל אחד.
התייבשות
- לטבול את השקופיות 100% אתנול 2 פעמים במשך 3 דקות כל אחד.
- לטבול את השקופיות ב 95% אתנול במשך 3 דקות.
- לטבול את השקופיות ב 70% אתנול במשך 3 דקות.
- לטבול את השקופיות ב 50% אתנול במשך 3 דקות.
חסימת פעילות פרוקסידאז אנדוגני
- לדגור על המגלשות ב 100 מ"ל של 0.3% H2O2 במשך 30 דקות בטמפרטורת החדר.
- לשטוף את השקופיות עם 1X PBS 2 פעמים במשך 5 דקות כל אחד.
אחזור אנטיגן
- לטבול את השקופיות במאגר ציטוט IHC (pH 6) ולהרתיח אותם במשך 20 דקות.
- שקופיות רקמות מוכנות כעת להכתמה.
3. הכנת חלקים טריים קפואים, משובצים ב-OTC להכתמה
- מניחים 5 מ"מ של רקמה מבודדת טרייה לתוך תבנית ומוסיפים OCT עד שהחלק מכוסה לחלוטין.
- לאט לאט להטביע את בלוק הרקמה לתוך חנקן נוזלי עד קפוא לחלוטין. המדגם יכול כעת להיות מאוחסן ב -80°C עד שנה אחת.
- לאחר מוכן לחיתוך, להעביר את בלוק הרקמה הקפואה להקפאה ולאפשר את ההתקנה כולה לבוא -20 מעלות צלזיוס.
- חותכים מקטעי רקמות בעובי 5-10 מיקרומטר באמצעות קריוסטט והשתמשו במברשת כדי למקם מקטעים ישירות על שקופיות זכוכית תואמות IHC.
- אפשרו לשקופיות להתייבש למשך הלילה בטמפרטורת החדר. ניתן גם לאחסן את השקופיות ב- -80°C.
- לטבול את השקופיות 250 מ"ל של 4% PFA במשך 15 דקות בטמפרטורת החדר כדי לתקן את השקופיות לפני הכתמים. שיטת קיבוע אופטימלית צריכה להיקבע על-ידי המשתמש.
- לטבול את השקופיות ב 250 מ"ל של 1X PBS 2 פעמים במשך 5 דקות כל אחד.
- לטבול את השקופיות 250 מ"ל של 0.3% H2O2 במשך 30 דקות בטמפרטורת החדר על מנת לחסום כל פעילות peroxidase אנדוגני.
- לטבול את השקופיות ב 250 מ"ל של 1X PBS 2 פעמים במשך 5 דקות כל אחד.
- השקופיות מוכנות כעת להכתמתם.
4. כתמים
- הקיפו את הרקמה במחסום הידרופובי באמצעות עט מחסום.
חסימת
- באמצעות פיפטה, מניחים 100 μL של חוצץ חסימה (סרום סוס מדולל ב- 1X PBS) - מעל המקטע במשך שעה אחת בטמפרטורת החדר.
- הסר מאגר חסימה באמצעות pipette.
דגירה ראשונית של נוגדנים
- לדגור את הרקמה המקיפה עם פתרון נוגדנים ראשוני מדולל 100 μL (עכבר אנטי אנושי ציקלין D1 מדולל 1:100 חוצץ חסימה) במשך 30 דקות בטמפרטורת החדר.
- מסננים את הנוגדן העיקרי מכל שקופית ושטפו את השקופיות עם 1X PBS 2 פעמים במשך 5 דקות כל אחת.
דגירה משנית של נוגדנים
- לדגור על המדגם עם 100 μL של נוגדן משני ביוטינילציה מדולל (ביוטינילציה סוס נגד עכבר IgG מדולל 1:200) במשך 30 דקות בטמפרטורת החדר.
- הסר את הנוגדן המשני על ידי ניקוז את החלקים לשטוף עם 1X PBS 2 פעמים במשך 5 דקות כל אחד.
פיתוח צבע
- הדמיה באמצעות HRP: הוסף 100 μL של קומפלקס אבידין-ביוטין (ABC) ריאגנט ודגרה את החלקים בחושך במשך 30 דקות בטמפרטורת החדר
הערה: נוגדנים מתויגים פלואורסצנטית ניתן גם להשתמש ודמיינו באמצעות מיקרוסקופ מתאים. - לשטוף את השקופיות עם 1X PBS 2 פעמים במשך 5 דקות כל אחד.
- לפתח את השקופיות על ידי דגירה של המקטעים ב 100 μL של DAB עד 5 דקות.
- עצור את הפיתוח על ידי הוספת מים מזוקקים (dH2O) למשך 5 דקות בטמפרטורת החדר.
תגובה נגדית (אם תרצה)
- לטבול את השקופיות בקצרה האריס המטוקסילין פתרון (או 0.5% מתיל ירוק ב 0.1M נתרן אצטט (pH 4.2)) במשך 10 דקות.
- יש לשטוף את הדלפק על ידי שטיפת מגלשות ב- dH2O פעמיים למשך 5 דקות כל אחת.
התייבשות
- לטבול את השקופיות 95% אתנול 2 פעמים במשך 5 דקות כל אחד.
- לטבול את השקופיות 100% אתנול 2 פעמים במשך 5 דקות כל אחד.
- לטבול את השקופיות 100% קסילן 2 פעמים במשך 5 דקות כל אחד.
- כתם את השקופיות במגבת נייר.
יישום הרכבה וכיסוי
- הוסף טיפה של מדיה הרכבה כגון Mount Organo-Limonene לשקופיות והנח כיסוי מעל המקטעים.
ניתוח מיקרוסקופי
- שים לב למקטעים המוכתמים תחת מיקרוסקופ מתאים לניתוח. כאן נעשה שימוש במיקרוסקופ אור סטנדרטי לתצפית ומצלמה דיגיטלית מותקנת שימשה להדמיה.
אימונוציטוכימיה ואימונוהיסטוכימיה מכתימות שיטות לחלבון בעל עניין בתאים ורקמות בתרבית, בהתאמה. העיקרון הבסיסי של שתי הטכניקות הקשורות כרוך בשימוש בנוגדנים ספציפיים המתויגים במערכת זיהוי כדי לזהות ולדמיין את החלבון ולקבוע את מיקומו בתוך התאים והרקמות, כמו גם את הרמות היחסיות. התהליך בכל אחד מהניסויים מתחיל בהכנת מדגם.
עבור אימונוציטוכימיה, אשר מדמה באופן ספציפי מיקומי חלבון או אנטיגן בתאים, זה כרוך בשלושה שלבים. הצעד הראשון הוא ציפוי, אשר כרוך פולחן התאים בתקשורת צמיחה על פתק כיסוי או שקופית, בדרך כלל, בבארות של צלחת תרבות. זה ואחריו קיבעון, שבו סוכן מזרז או crosslinking כמו paraformaldehyde מתווסף לתאים כדי לשמר את השלמות המבנית של החלבונים ולמנוע פעילות אנזימים מלהשפיל אותם. השלב האחרון הוא permeabilization, אשר כרוך הוספת חומר ניקוי כדי להפוך את קרום התא חדיר עבור הכתמים.
בשיטה המקבילה, אימונוהיסטוכימיה, חלבונים או אנטיגנים מוצגים ברקמות והכנת מדגם יש חמישה שלבים. ראשית, הרקמה כולה נתונה לקיבעון, בדרך כלל עם paraformaldehyde. זה ואחריו הטבעה של הרקמה בבלוק של פרפין, ולאחר מכן חתך של בלוק זה באמצעות מכונה הנקראת microtome לחתוך את הרקמה לפרוסות דקות אשר ניתן להציב על שקופיות. לאחר מכן, השקופיות כפופות deparaffinization, או הסרת פרפין מסביב לפרוסת הרקמה. לאחר מכן, ניתן לבצע שלב אחזור אנטיגן אופציונלי. זה יכול להיעשות באמצעות חום או אנזימים כדי לחשוף epitopes כי היו מקושרים צולבים במהלך קיבעון מה שהופך אותם זמינים עבור כריכת נוגדנים. לאחר הכנת המדגם המתאימה, נוגדן ראשוני ספציפי למטרה מתווסף לדגימת התא או הרקמה. הנוגדן העיקרי הזה צריך להיקשר לחלבון העניין. לאחר מכן, מתווסף נוגדן משני, אשר מזהה ונקשר לנוגדן העיקרי. נוגדן משני זה מצומד או יכול להיקשר אליו, אנזים הנקרא HRP. כאשר המצע הספציפי שלו, DAB, נוסף, HRP ממיר את זה למים חומים בלתי מסיסים. הכתם החום הזה מסמן את המיקום של חלבון המטרה. השקופיות מוכתמות גם בהמטוקסילין, המסמן את הגרעינים בכחול ומספק נקודת התייחסות מרחבית לקביעת לוקליזציה תת-תאית. לאחר מכן, מדיה הרכבה מתווספת לשקופית, ואחריה פתק כיסוי על מנת לאטום ולשמר את המדגם המוכתם. לבסוף, ניתן לדמיין את השקופיות במיקרוסקופ אור.
בסרטון זה, תוכלו לצפות בטכניקת הכנת המדגם עבור תאים מצופים וחלקי רקמות, ואחריו חיסון של מקטעי הרקמה.
ראשית, יש לשבת על גבי כיסויים. כדי לעשות זאת, עובד במכסה המנוע תרבית רקמות, למקם כיסויים בודדים לתוך בארות של צלחת 24-well. לאחר מכן, לסגור את אבנט ולהדליק את אור UV כדי לעקר את כיסויים במשך 15 דקות לפחות. לאחר מכן, כבה את אור UV. כדי להרים את התאים של עניין מצלחת 10 ס"מ, לשאוף את התקשורת, לשטוף לזמן קצר עם PBS, ולהוסיף טריפסין לתאים במשך 2 דקות. לאחר מכן, הקש על צד הצלחת כדי להבטיח שהתאים התנתקו וננטרלו את טריפסין באמצעות מדיה. לאחר מכן, הוסף 0. 5 מ"ל של השעיית התא לתוך כל באר, הקפדה לכסות את כיסויי. מניחים את הצלחת לתוך אינקובטור CO2 לח ולאפשר לתאים לגדול ב 37 מעלות צלזיוס עד שהם 50-70% מפגש.
ברגע התאים להגיע למפגש האופטימלי, לשאוף את המדיום התרבותי מכל באר, ולאחר מכן לתקן את התאים על ידי דגירה אותם . 5 מ"ל של 4% paraformaldehyde מדולל ב 1X PBS במשך 20 דקות בטמפרטורת החדר. לאחר הסרת הקיבעון, לשטוף את התאים להוסיף 1 מ"ל של 1X PBS מעל כל כיסוי. מיד לשאוף PBS, ולאחר מכן לחזור על לשטוף 2 פעמים נוספות עבור סך של 3 שטיפות.
עכשיו, לחלחל לתאים על ידי הוספת 0.5 מ"ל של 0.1% טריטון X-100 ב 1X PBS לכל באר. השאירו את הצלחת בטמפרטורת החדר במשך 15 דקות. שאפו את מאגר permeabilization ולאחר מכן לשטוף את התאים על ידי הוספת 1 מ"ל של 1X PBS לתוך כל באר. מיד לשאוף את PBS ולחזור על לשטוף 2 פעמים נוספות עבור סך של 3 שטיפות. עכשיו, כשהתאים על כיסויים קבועים ומחלחלים, המשיכו להליך ההכתמה שהודגם עבור הדוגמה האימונוהיסטוכימאית הבאה, למעט העובדה שהדגורות צריכות להתבצע בתוך הבארות של הצלחת 24-well ולא ישירות על שקופית מקטע רקמות.
כדי להתחיל, להשיג מוכנה, פורמלין קבוע, מקטעי רקמה מוטבע פרפין. Deparaffinize השקופיות על ידי הצבת אותם לתוך מתלה שקופיות ולאחר מכן לחלוטין לטבול אותם לתוך 250 מ"ל של 100% קסילן. אפשר לשקופיות לדגור במשך 5 דקות בקסילן. לאחר מכן, להסיר את השקופיות מן המיכל, לנגב אותם עם מגבת נייר, ומניחים אותם לתוך אמבט קסילן חדש במיכל טרי במשך 5 דקות נוספות.
לאחר מכן, rehydrate את החלקים בסדרה של פתרונות אתנול מדורג החל עם 100% אתנול במשך 3 דקות. נגב את מתלה השקופיות במגבת נייר והעביר את השקופיות למיכל חדש של 100% אתנול למשך 3 דקות נוספות. המשך מחזור זה של כביסה, ייבוש במגבת נייר, והעברת השקופיות לאמבטיה חדשה בעקבות הריכוזים המצוינים של אתנול לזמן שצוין. לאחר שטיפת האתנול הסופית, לנגב את המדף עם מגבת נייר ודגור את השקופיות ב 100 מ"ל של .3% מי חמצן במשך 30 דקות בטמפרטורת החדר על מנת לחסום כל פעילות peroxidase אנדוגני. לשטוף את השקופיות ב 250 מ"ל של 1X PBS במשך 5 דקות. חזור על שטיפה זו במיכל של PBS 1X טרי למשך 5 דקות נוספות.
לאחר מכן, לבצע אחזור אנטיגן על ידי טבילת השקופיות 250 מ"ל של IHC חוצץ ציטוט ב pH 6.0 והרתיח אותם במשך 20 דקות. לאחר מכן, המשך לפרוטוקול הכתמים.
כדי להתחיל את תהליך הכתם עבור IHC, הקיפו את המקטעים בעט הידרופובי כדי לזהות את האזור המינימלי שהמאגר צריך לכסות. לאחר מכן, השתמש פיפטה למקם 100 microliters של חוצץ חסימה, אשר בניסוי זה הוא סרום סוס מדולל 1X PBS, על החלק. לדגור על המגלשות במשך שעה בטמפרטורת החדר. לאחר מכן, הסר את מאגר החסימה באמצעות pipette.
לאחר מכן, לדלל את הנוגדן העיקרי וחסימת חוצץ ב 1:100 דילול על ידי הוספת 990 microliters של סרום סוס מדולל 1X PBS לתוך 1. צינור אפנדורף 5 מ"ל, ואחריו 10 מיקרוליטרים של הנוגדן העיקרי. מוסיפים 100 מיקרוליטרים של הנוגדן הראשי מדולל לכל קטע, ודגר את השקופיות במשך 30 דקות בטמפרטורת החדר. כאשר טיימר נשמע, לנקז את הנוגדן העיקרי מכל שקופית, ולאחר מכן לשטוף אותם ב 250 מ"ל של 1X PBS במשך 5 דקות. חזור על שטיפה זו פעם נוספת באמצעות PBS 1X טרי.
בזמן שהמגלשות נשטפות ב-1X PBS, מדללים את הנוגדן המשני לדילול של 1:200 על ידי הוספת 995 מיקרוליטרים של חסימת חוצץ לצינור 1.5 מ"ל ואחריו 5 מיקרוליטרים של הנוגדן המשני, שבמקרה זה הוא IGG נגד עכברים של סוסים ביוטינילציה. מוסיפים 100 מיקרוליטרים של הנוגדן המשני מדולל לכל מקטע, ולאחר מכן לדגור על השקופיות במשך 30 דקות בטמפרטורת החדר. לאחר 30 דקות, להסיר את הנוגדן המשני על ידי ניקוז אותו את החלקים, ולאחר מכן לשטוף את השקופיות ב 250 מ"ל של 1X PBS במשך 5 דקות. חזור על כביסה זו באמצעות PBS 1X טרי.
עכשיו, להוסיף 100 microliters של ריאגנט קומפלקס אבידין-ביוטין, ולדגירה את החלקים בחושך במשך 30 דקות בטמפרטורת החדר. לאחר מכן, לשטוף את השקופיות על ידי טבילת אותם 250 מ"ל של 1X PBS במשך 5 דקות. בדומה לשלבי הכביסה הקודמים, חזור על שטיפה זו פעם נוספת באמצעות PBS 1X טרי. לאחר מכן, לפתח את השקופיות על ידי דגירה של המקטעים ב 100 microliters של DAB עד 5 דקות. עצור את הפיתוח על ידי טבילת החלקים ב 250 מ"ל של מים מזוקקים במשך 5 דקות.
כעת, ניתן להכתים שקופיות, אם תרצה בכך. כדי לעשות זאת, לטבול בקצרה את השקופיות ב 250 מ"ל של האריס המטוקסילין פתרון. לשטוף את הדלפק על ידי שטיפת המגלשות ב 250 מ"ל של מים מזוקקים במשך 5 דקות. חזור על זה לשטוף 1 עוד זמן באמצעות מים מזוקקים טריים. לאחר מכן, ייבש את החלקים. כדי לעשות זאת, תחילה לדגור על השקופיות ב 95% אתנול במשך 5 דקות. כתם את השקופיות על מגבת נייר, ולהעביר אותם למיכל חדש של 95% אתנול טרי במשך 5 דקות נוספות. המשך מחזור הכביסה, סופג עם מגבת נייר, והעברת השקופיות לאמבטיה חדשה, בעקבות הפתרונות המצוינים במשך 5 דקות כל אחד.
לאחר הדגירה הסופית, כתם את השקופיות במגבת נייר, ולאחר מכן להוסיף טיפה של מדיה הרכבה, כגון אורגנו-לימונה מאונט, למגלשות. עכשיו, מניחים כיסוי מעל החלקים, דואגים לא ללכוד בועות אוויר. השקופיות מוכנות כעת לצפייה תחת מיקרוסקופ לניתוח.
כדי לבחון את המקטעים המוכתמים, השתמש במיקרוסקופ אור סטנדרטי כדי לדמיין את הכתם ובמצלמה דיגיטלית כדי ללכוד את התמונה. בדוגמה הספציפית הזו של IHC, רקמות טחול מסוג בר ועכברים ספונטניים, מהונדסים כפולים או DTG, משווים לחקר ביטוי Dyclin D1 בלימפומה. הרקמות היו משובצות פרפין, נותחו והוכתמו בנוגדן D1 אנטיציקלין, וצוו בהגדלה של פי 20. ציקלין D1 ביטוי תאים מסומנים על ידי צבע חום אדמדם על רקע הרקמה הכחולה. השוואת עוצמות הכתמים בין התמונות מהעכברים השונים, הטחול הלא מוגדל יש כמויות נמוכות יחסית של ביטוי ציקלין D1 ללא קשר לגנוטיפ העכבר. לעומת זאת, הטחול המוגדל מעכבר DTG, מראה כתמים אדמדמים-חומים מוגברים המצביעים על מתאם בין התפתחות הסרטן לביטוי ציקלין D1 במודל עכבר זה.
Subscription Required. Please recommend JoVE to your librarian.
Results
ל-IHC ול-ICC יש מגוון עצום של יישומים. לדוגמה, שימוש אחד ב- IHC הוא לבחון את הביטוי של אונקוג'נים במודלים ספונטניים של התפתחות הגידול. באיור 2, יצאנו לקבוע אם ביטוי ציקלין D1 הוגדל בטחול מוגדל במודל עכבר ספונטני של התפתחות לימפומה. דגימות רקמת הטחול תוקנו בפרפורמלדהיד, מוטבעות בפרפין, חלקיות, מוכתמות באמצעות נוגדן D1 נגד ציקלין (מדולל 1:200 במאגר חסימה), ואז המקטעים צולמו בהגדלה של פי 20. ציקלין D1 ביטוי תאים מסומנים על ידי צבע חום אדמדם על רקע הרקמה הכחולה. תוצאות אלה מצביעות על כך ביטוי ציקלין D1 הוגדל טחול מוגדל, המציין מתאם בין התפתחות הסרטן וביטוי ציקלין D1 במודל זה.

איור 2: הבעת ציקלין D1 בספונטנית כפולה מהונדסת (DTG) של לימפומה. תמונה של רקמת טחול מוכתמת בנוגדן ראשוני נגד ציקלין D1, מוכתמת בירוק מתיל, ומדמיינת באמצעות נוגדן משני ביוטינילציה וריגנט ABC מופעל עם מצע DAB. הצבע החום-אדמדם מייצג מקומות שבהם הנוגדן קשור המציין את נוכחותו של ציקלין D1 המבטאים תאים סרטניים בתוך המבנה של רקמת הטחול כי כבר נגד כחול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
אימונוהיסטוכימיה (IHC) ואימונוציטוכימיה (ICC) הן טכניקות המשמשות להדמיית הביטוי והלוקליזציה של אנטיגנים ספציפיים המשתמשים בנוגדנים. רקמות נחתכות תחילה לחלקים דקים השומרים על מורפולוגיה של הרקמה ומונחות על שקופית. לאחר מכן מוסיפים את הנוגדנים ויקשרו את האנטיגן של העניין ומצוידים בתג ספציפי המאפשר להם להיות חזותיים תחת מיקרוסקופ. לכן, באמצעות מושג בסיסי זה, ניתן לדמיין וללמד את התפלגות האנטיגנים בהקשר של מבנה הרקמה. עם זאת, בעוד מושג העל הוא בסיסי, ישנן גישות שונות רבות וריאציות שפותחו המגבירות הן את המורכבות והן את התועלת של טכניקות אלה. מאמר זה כיסה את הרעיון הבסיסי של IHC ו- ICC, את ההחלטות העיקריות שיש לקחת בחשבון בעת שימוש בטכניקות אלה, ופרוטוקול מפורט שלב אחר שלב. התמונות המיוצרות על ידי IHC ו- ICC הן בדרך כלל המוצר הסופי וניתן לפרסם כפי שהוא להדגיש הבדלים ברורים בכמויות או הפצה של כתמים בין תנאים שונים.
Subscription Required. Please recommend JoVE to your librarian.
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).




