Overview
ソース: ムニエシルヴァン1,2,3, パーチェットティボー1,2,3, ソフィー・ノヴォールト 4, レイチェル・ゴルブ1,2,3
リンパポイシスのための1ユニット、免疫学科、パスツール研究所、パリ、フランス
2 INSERM U1223, パリ, フランス
3ユニバーシテ パリ ディデロ, ソルボンヌ パリ シテ, セルレ パストゥール, パリ, フランス
4フローサイトメトリープラットから, サイトメトリーとバイオマーカー UtechS, 翻訳科学センター, パスツール研究所, パリ, フランス
養子細胞移植は、疾患を治療したり、血腫症などの生物学的プロセスを研究するために、患者または研究生物に細胞を導入する方法である。養子縁組移転の目的はさま々あります。それは基礎生物学だけでなく医学で使用することができる(1、2)。マウスモデルでは、転移した細胞の移動と分布を調べたり、追跡システム(細胞表面マーカー、CFSEによる染色など)を行うことができます。マウスモデルに関する癌研究では、特定の細胞集団の転移を腫瘍に対する実験的治療として用いることができる。この技術の別の例は、重篤な免疫不全表現型を有する照射マウスまたはマウスに骨髄細胞を移すことによってキメラマウスの作成である。このマウスモデルは、例えば特定の細胞集団に対する遺伝子欠失の影響を評価するために使用することができる。骨借用細胞の移動は、ヒトの治療にも使用されます。がん治療の場合に患者に照射される場合、骨髄の養子縁組は免疫系の再構成を可能にする。
この技術の最初のステップは、目的の細胞集団を得ることである。この母集団を分離するために選択される手法は、対象となる母集団の特異性のレベルに依存します。選択の最大のレベルは、臓器内に存在するすべての細胞集団が取られる臓器全体です。より正確な方法は、多くの場合、1つのセル表面マーカーによって選択されるターゲットセル母集団の選択です。この場合、細胞をソートする理想的な方法は、磁気ソートです。最後に、最も厳しいレベルは、非常に特定の細胞集団をソートするために、いくつかのセル表面マーカーによる細胞の選択です。フローサイトメトリーソートは、このレベルの選択に最も一般的な方法です。対象の母集団が取得されると、ホストに転送できます。養子移植の前に、宿主とドナーの間の互換性を確保することが不可欠です。実際、転写目標にかかわらず、細胞拒絶反応を起なさずに宿主による細胞の採用を保証するためには、互換性が重要である。
この実習では、CD45.2マウスからCD45.1 Ragγマウス(リンパ球欠損)に脾細胞を移移し、4日後にフローサイトメトリーを用いて脾細胞転移を確認することで、養子細胞転写技術を実証する(図1参照)。 ).
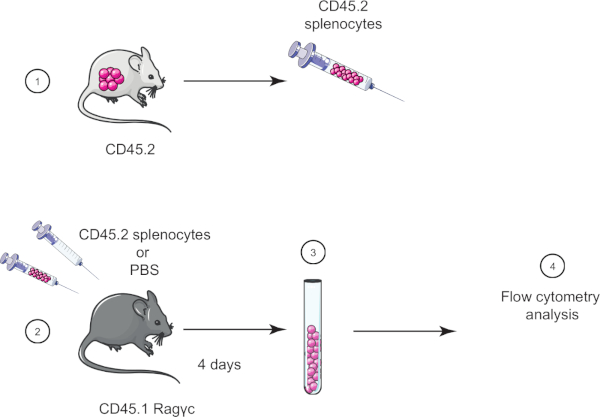
図1:養子転移の概略表現。(1)脾細胞はCD45.2マウスから単離され(2)CD45.1 Ragγマウスに転移し、対照マウスはPBSのみを注入する。 (3)養子転移の4日後に、脾細胞をマウスから回収し、(4)フローサイトメトリーにより分析した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
Procedure
1. 準備
- 始め始めの前に、実験室の手袋と適切な防護服を着用してください。
- すべての解剖ツールを殺菌し、まず洗剤で、次に70%のエタノールで乾燥させ、その後完全に乾燥させます。
- 2%の胎児子牛血清(FCS)を含むハンクのバランス塩溶液(HBSS)の50 mLを調調します。
2. 解剖
- 二酸化炭素送達システムを用いて、低酸素症でマウスを安楽死させる。サパンの位置の解剖プレート上で安楽死マウスを固定し、はさみと鉗子を使用して縦開腹術を行います。
- 鉗子を使用すると、腹部の右側に腸と胃を動かして胃と脾臓を露出させる。脾臓は胃に付着している。
- 鉗子を使用して慎重に胃から脾臓を取り外し、HBSS 2%FCSの5 mLを含むペトリ皿の上に置きます。
3. 免疫細胞分離
- 脾臓を40μmのセルストレーナーの上にペトリ皿の上に置きます。脾臓をプランジャーでつぶして解離します。
- HBSS 2%FCSの1 mLでプランジャーとストレーナーをすすいで付着した細胞を回収します。
- 解離した脾臓と流体を15 mL遠心管に移します。
- 5ミリリットルのHBSS 2%FCSでペトリ皿を洗浄し、15 mLチューブに流体を移します。
- チューブを10°Cで7分間370 x gで遠心し、ペレットを避けて上清を捨てます。
- 塩化カリウムピペの2 mLでペレットを再ステーペンし、ペレットを再中断し、赤血球をlysese.
- 2 分間待ち、HBSS 2% FCS を再懸濁ペレットに追加し、最大 14 mL のボリュームを得ます。
- 10°Cで7分間370 x gでチューブを再度遠心分離します。上清を捨て、上下にピペッティングしてHBSS 2%FCSの5 mLでペレットを再懸濁します。
- トリパンブルー染色アッセイを使用して細胞をカウントし、HBSS 2%FCSの適切な体積を使用して、最終的な細胞濃度を107細胞/mLに調整します。
4. 採用移転
- 5mL回収管で得られた細胞懸濁液の2mLを転送する。
- チューブを10°Cで7分間370 x gで遠心し、上清を捨てます。
- PBSの2 mLでペレットを再ステージェントし、10°Cで7分間370 x gでチューブを遠心分離します。
- PBSの200 μLで上清を廃棄し、ペレットを再懸濁します。
- 29G針を用いた0.5mL注射器を用いて、200μLの細胞懸濁液を静脈内にレトロ軌道血中洞に注入する。
- 対照として、200μLのリン酸緩衝生理食生を用いて同じ血液間部に第2のマウスを注入する。
5. 細胞の収穫と染色
- 養子移植の4日後に、マウスを安楽死させ、脾臓を取り除く。
- セクション3に記載されているように脾細胞を収穫する。
- 各マウスから100μLの細胞懸濁液を2つのFACSチューブに転送し、「制御」と「転写」というラベルを付けます。
- チューブを10°Cで7分間370 x gで遠心し、上清を捨てます。
- 表1に記載の希釈物に4つの抗体を含む混合物を調出す。
| 抗体 | フルオロクロム | 希釈 |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | APCCy7 | 1/400 |
| CD4 | バンブ786 | 1/1600 |
| CD3 | BV421 | 1/200 |
表1:抗体混合組成物。濃縮抗体蛍光コンジュゲートおよびHBSSを用いた4つの抗体カクテル調製製剤。
- 各チューブに100μLのミックスを追加し、暗闇の中で氷の上で20分間インキュベートします。
- HBSS 2%FCSの1 mLを追加し、10°Cで3分間370 x gでチューブを遠心分離します。
- 上清を廃棄し、HBSS 2% FCSの200 μLでペレットを再懸濁します。
- 再懸濁したセルを、ラベル付きの新しい FACS チューブに転送します。
- フローサイトメトリーを用いて、FACSプロトコルに示すように、CD45.2陽性リンパ球の存在を評価する。
6. データ分析
- "FlowJo"ソフトウェアを開き、各チューブのファイルを [すべてのサンプル]ウィンドウでドラッグします。
- 「転送済み」ファイルをダブルクリックすると、そのサンプルから記録されたセルがドット プロットに表示され、Y 軸に前方散布 "SSC-A"が表示され、X 軸上にサイド スキャッタ"FSC-A"が表示されます。
- 「ポリゴン」をクリックし、リンパ球を選択するゲーティング戦略を作成し、細胞表面マーカー(CD45.1、CD45.2)を使用してドナー細胞と宿主細胞を区別し、CD45.2+細胞集団(CD3、CD4)を特徴付けます。
- "コントロール マウス"ファイルで解析手順を繰り返します。
- セルの母集団を視覚化するには、[レイアウト エディタ]をクリックします。
- "転送されたセル"と "転送された CD4 セル"の母集団を "転送"ファイルと "コントロール"ファイルを "レイアウト エディタ] タブにドラッグします。
- CD45.2+細胞およびCD4リンパ球を表すドットプロットが現れる。
- CD45.2 転送されたセルは、"転送されたマウス"ドット プロットにのみ表示されます。
養子細胞移植は、目的の細胞を生物に導入する方法である。これは、免疫細胞の特定のクラスの作用を含む様々な生物学的メカニズムを研究するための強力な技術です。さらに、養子移植は、患者自身のT細胞を抽出し、癌細胞を認識して破壊するために変更することができる骨髄移植や癌治療を必要とするものなど、多くの条件のための有望な新規治療であり、その後、腫瘍と戦うために体に戻りました。
実験室では、動物モデルは、多くの場合、養子移植を研究するために使用されます。例えば、CD45.1ラグガンマ-cノックアウトマウスは、造血幹細胞をリンパ球に正常に分化するために不可欠な多くのサイトカインの基本的な受容体を欠いている。その結果、ノックアウトマウスは、リンパ球の発達が損なわれ、ナチュラルキラー、またはNK、細胞、T細胞、またはB細胞を有しない。
養子移植は、これらの侵害されたマウスに欠損した免疫細胞を導入するために使用することができ、まず脾臓などの高濃度の免疫細胞を含むドナーマウス組織を採取する。その後、組織は解離され、免疫細胞を含む様々な脾臓細胞が単離される。次に、不要な赤血球、または赤血球は、塩化カリウムのライシングバッファーと残りの白血球、または脾細胞の添加を介して、遠心分離を使用して細胞破片から分離することによってlysを行うことができる。
最後に、精製された脾細胞を免疫不全マウスに注入し、これらの細胞の機能の詳細な研究を容易にする。数日後、養子免疫細胞移植の成功は、ドナー組織と同様に宿主脾臓を最初に分離および準備することによって確認することができる。次いで、これらの細胞は、ドナー免疫細胞マーカーに対して標識抗体を用いて染色され、FACSを用いて検証およびソートすることができる。
まず、実験室用手袋と適切な保護具を着用してください。次に、鉗子を洗い、洗剤でハサミを解剖し、次に70%のエタノールで洗い流し、清潔なペーパータオルで乾かします。ハンクのバランス塩溶液(HBSS)の50ミリリットルを2%の胎児子牛血清、またはFCSで50ミリリットルのチューブに49ミリリットルのHBSSと組み合わせることによって準備します。溶液を約10回上下にゆっくりとピペッティングして混ぜます。
安楽死マウスを解剖し、脾臓Bリンパ球分離のためのJoVEビデオプロトコルFACS技術で示されているように脾臓を除去する。免疫細胞を分離するには、まず脾臓を40マイクロメートルのセルストレーナーにペトリ皿に置きます。脾臓をプランジャーでつぶし、皿に切り離します。HBSS 2%FCSの1ミリリットルでプランジャーとストレーナーをすすいで付着した細胞を回収します。次に、ペトリ皿から50ミリリットルの遠心管に解離された脾臓と流体をピペットする。5ミリリットルのHBSS 2%FCSでペトリ皿を洗い、15ミリリットルのチューブに流体を移します。
10°Cで7分間370回gでチューブを遠心分離し、ペレットを邪魔しないように慎重にチューブを取り出します。次に、ペレットを乱さずに上清を取り出し、適切な廃棄物容器に液体を捨てます。次に、遠心管に塩化カリウム分解能の2ミリリットルを加え、ペレットを再中断し、赤血球を分解するために上下にピペットを追加します。2 分間待ってから、HBSS 2% FCS を再懸濁ペレットに追加し、合計値 14 ミリリットルを取得します。遠心分離を繰り返します。慎重にチューブを取得し、上清を廃棄します。次いで、上下にピペッティングして5ミリリットルHBSS 2%FCSでペレットを再中断する。次に、懸濁液中のセルをカウントします。5マイクロリットルのトリパンブルーを5マイクロリットルのセルサスペンションに加え、ピペッティングでよく混ぜます。次に、カバーガラスとマラセススライドの間に5マイクロリットルの希釈セル懸濁液を静かに堆積させます。顕微鏡を40倍の倍率に設定し、細胞数をカウントします。HBSS 2% FCSの適切な体積を加えることによって、1ミリリットル当たり7セルに細胞濃度を10に調整します。
養子転写を開始するには、細胞懸濁液の2ミリリットルを5ミリリットルの回収管に移す。10°Cで7分間370回gでチューブを遠心分離し、上清を捨てます。次に、ペレットを2ミリリットルのリン酸緩衝生理食塩水で再中断し、チューブを10°Cで7分間370回gで遠心分離する。上清を捨てます。次いで、リン酸緩衝生理食塩水の200マイクロリットルでペレットを再中断する。29ゲージの針を持つ0.5ミリリットルの注射器を使用して、200マイクロリットルの細胞懸濁液を実験マウスに静脈内に静脈内に注入する。
養子移植の4日後に、マウスを安楽死させ、脾臓を取り除く。次いで、セクション3に記載されている免疫細胞を収穫する。次に、各マウスから100マイクロリットルの細胞懸濁液を、標識された2本のFACSチューブに転送し、制御して転送する。10°Cで7分間370回gでチューブを遠心分離し、上清を捨てます。さて、表1に記載されている希釈で4つの抗体を含む混合物を調記する。各チューブにミックスの100マイクロリットルを追加し、暗闇の中で氷の上に20分間インキュベートします。次に、各チューブにHBSS 2%FCSの1ミリリットルを追加し、10°Cで3分間370回gでチューブを遠心分離します。上清を廃棄し、HBSS 2%FCSの200マイクロリットルでペレットを再懸濁します。再懸濁したセルを新しい標識FACSチューブに移します。ここで、FACS プロトコルに示すようにフローサイトメトリーを使用して、CD45 の存在を評価します。2陽性リンパ球。
次に、CD45から単離したCD45.2リンパ球の存在を判定する。1宿主脾臓。開始するには、FlowJo アイコンをダブルクリックし、すべてのサンプル ウィンドウで各チューブのファイルをドラッグします。次に、転送されたファイルをダブルクリックして、そのサンプルから記録されたセルをドット プロットに表示し、X 軸に前方散布 FSCA を表示し、Y 軸上に SSCA を横散乱します。ポリゴンをクリックしてリンパ球集団を円で囲みます。新しいサブ人口識別ウィンドウが表示されます。[OK] をクリックします。次に、Y 軸を FSC-W に、X 軸を FSC-A に設定します。前に示したように、ポリゴン ツールを使用して単一セルの作成を選択します。
次に、円で囲まれた人口をダブルクリックして、選択したセルの新しいウィンドウを作成します。新しいウィンドウで、YのCD45.2を選択し、XのCD45.1を選択し、Tアイコンをクリックし、軸をカスタマイズしてプロットを拡大します。次に、ポリゴンをクリックして CD45.2 陽性セルを丸で囲みます。サブ人口識別ウィンドウで、セル母集団に転送されたセルに名前を付け、[OK] をクリックします。同じウィンドウで、四角形をクリックして CD45.2 負のセルを選択します。サブ人口識別ウィンドウで、セル母集団ホストセルに名前を付け、[OK] をクリックします。次に、CD45.2 円で囲まれた母集団をダブルクリックして、選択したセルの新しいウィンドウを作成します。新しいウィンドウで、Y の CD3 と X の CD4 を選択します。
次に、ポリゴンをクリックして CD4 CD3 陽性セルを丸で囲みます。このサブ人口識別ウィンドウで、セル母集団が転送された CD4 セルに名前を付けます。次に、コントロール マウス ファイルで前の解析手順を繰り返します。最後に、セルの母集団を視覚化するには、[レイアウト エディタ] をクリックします。転送されたセルと転送された CD4 セルの作成を、転送されたファイルから[レイアウト エディタ]タブにドラッグしてコントロールファイルにドラッグします。CD45.2陽性細胞とCD4リンパ球を表すドットプロットが現れる。CD452 つの転送されたセルは、転送されたマウス ドット プロットにのみ表示されます。
Subscription Required. Please recommend JoVE to your librarian.
Results
Ragγマウスは、主にリンパ球を欠いている免疫系組成を変化させた。脾細胞の養子移植は、TおよびB細胞などの欠けている集団の導入を可能にする。我々の染色には、宿主細胞とドナー細胞をそれぞれ区別するために、細胞表面マーカーCD45.1とCD45.2が含まれていた(図2A)。また、CD4 T細胞などのRagγマウスに存在しない細胞集団を強調する他の細胞表面マーカーも含まれていた(図2B)。予想通り、対照マウスはCD45.2陽性細胞(図2B、トップパネル)を持っていなかったし、転移したマウスは(図2B、下部パネル、全細胞の71.2%)を持っていた。また、転移細胞内のCD4T細胞(CD45.2細胞の22.1%)を特異的に検出することもできました。

図2:養子縁組移転の代表的な結果(A)PBS(対照群)を注射したマウス由来のCD45.2細胞のヒストグラム(破線)とCD45.2脾細胞(試験群)を注射したマウス(実線)。(B)PBS(トップパネル)を注射した対照マウスにおけるCD45.2陽性細胞のゲーティング戦略と、CD45.2脾細胞(下部パネル)を注射したマウス。ドナーおよび宿主細胞は、細胞表面マーカー(CD45.1、CD45.2)を用いて区別され、次いでCD45.2陽性細胞集団が特徴付けされる(CD3、CD4)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
養子縁組移転は、医学の応用を伴う科学の異なる分野における翻訳技術です。この技術は、特定の細胞集団における細胞移動およびトロピズムまたはタンパク質欠乏の発生率を研究するために使用することができる。最後のケースでは、異なる技術、特に特定の細胞集団が本質的に欠乏しているGMOマウスを使用することができます。しかし、GMOマウスを得るための遺伝的構築は、非常に複雑で長いプロセスであり得る。この場合、欠乏細胞集団の養子転移は容易かつ迅速である。
養子縁組の移転は医学の直接適用を持っている。例えば、がん治療中に照射された患者の骨髄移植片は、免疫系を再構成するために使用される。近年、医療分野では養子縁組移転の他の応用が用いられてきた。人工T細胞(CAR T細胞と呼ばれる)は、いくつかの癌を認識し、排除するように設計されています。さらに、これらの設計された細胞は宿主による拒絶反応の危険を減衰させるために造られる。CAR T細胞の転写は現在臨床試験で試験されている。
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




