Overview
Fonte: Elizabeth Suter1, Christopher Corbo1, Jonathan Blaize1
1 Departamento de Ciências Biológicas, Wagner College, 1 Campus Road, Staten Island NY, 10301
A coluna Winogradsky é um ecossistema em miniatura e fechado usado para enriquecer comunidades microbianas de sedimentos, especialmente aquelas envolvidas no ciclismo de enxofre. A coluna foi usada pela primeira vez por Sergei Winogradsky na década de 1880 e desde então tem sido aplicada no estudo de muitos microrganismos diversos envolvidos na biogeoquímica, como fotossintingesizers, oxidantes de enxofre, redutores de sulfato, methanogens, oxidantes de ferro, ciclodificadores de nitrogênio e muito mais (1,2).
A maioria dos microrganismos na Terra são considerados inculturais,o que significa que eles não podem ser isolados em um tubo de ensaio ou em uma placa de petri (3). Isso se deve a muitos fatores, incluindo que os microrganismos dependem de outros para certos produtos metabólicos. As condições em uma coluna de Winogradsky imitam de perto o habitat natural de um microrganismo, incluindo suas interações com outros organismos, e permitem que eles sejam cultivados em laboratório. Por isso, essa técnica permite que os cientistas estudem esses organismos e entendam como eles são importantes para os ciclos biogeoquímicos da Terra sem ter que cultivá-los isoladamente.
Os ambientes da Terra estão cheios de microrganismos que prosperam em todos os tipos de habitats,como solos, água oceânica, nuvens e sedimentos em alto mar. Em todos os habitats, os microrganismos dependem uns dos outros. À medida que um microrganismo cresce, ele consome substratos particulares, incluindo combustíveis ricos em carbono, como açúcares, bem como nutrientes, vitaminas e gases respiratórios como oxigênio. Quando esses recursos importantes se esgotam, diferentes microrganismos com diferentes necessidades metabólicas podem então florescer e prosperar. Por exemplo, na coluna Winogradsky, os micróbios primeiro consomem o material orgânico adicionado enquanto esgotam o oxigênio nas camadas inferiores da coluna. Uma vez que o oxigênio é usado, organismos anaeróbicos podem então assumir e consumir diferentes materiais orgânicos. Esse desenvolvimento consecutivo de diferentes comunidades microbianas ao longo do tempo é chamado de sucessão (4). A sucessão microbiana é importante em uma coluna winogradsky, onde a atividade microbiana altera a química do sedimento, que então afeta a atividade de outros micróbios e assim por diante. Muitos microrganismos em solos e sedimentos também vivem ao longo de gradientes,que são zonas transitórias entre dois tipos diferentes de habitats baseados nas concentrações de substratos (5). No ponto correto no gradiente, um micróbio pode receber quantidades ideais de diferentes substratos. À medida que uma coluna winogradsky se desenvolve, ela começa a imitar esses gradientes naturais, particularmente em oxigênio e sulfeto (Fig. 1).
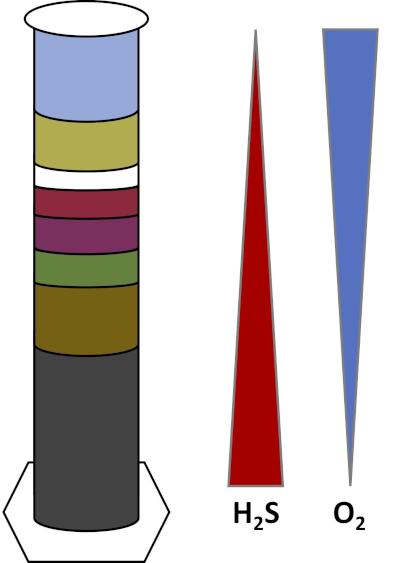
Figura 1: Uma representação dos gradientes de oxigênio (O2) e sulfeto (H2S) que se desenvolvem em uma coluna winogradsky.
Em uma coluna winogradsky, lama e água de um lago ou pântano são misturados em uma coluna transparente e permitidos a incubação, tipicamente à luz. Substratos adicionais são adicionados à coluna para dar à comunidade fontes de carbono, geralmente sob a forma de celulose, e enxofre. Fotossintificadores normalmente começam a crescer nas camadas superiores do sedimento. Esses microrganismos fotossintéticos são em grande parte compostos por cianobactérias,que produzem oxigênio e aparecem como uma camada verde ou marrom-vermelha (Fig. 2, Tabela 1). Enquanto a fotossíntese produz oxigênio, o oxigênio não é muito solúvel em água e diminui abaixo dessa camada (Fig. 1). Isso cria um gradiente de oxigênio, variando de altas concentrações de oxigênio nas camadas superiores a zero oxigênio nas camadas inferiores. A camada oxigenada é chamada de camada aeróbica e a camada sem oxigênio é chamada de camada anaeróbica.
Na camada anaeróbica, muitas comunidades microbianas diferentes podem proliferar dependendo do tipo e quantidade de substratos disponíveis, da fonte dos micróbios iniciais e da porosidade do sedimento. No fundo da coluna, organismos que aeróbios quebram matéria orgânica podem prosperar. A fermentação microbiana produz ácidos orgânicos a partir da quebra da celulose. Esses ácidos orgânicos podem então ser usados por redutores de sulfato,que oxidam esses orgânicos usando sulfato, e produzem sulfeto como subproduto. A atividade dos redutores de sulfato é indicada se o sedimento ficar preto, pois o ferro e o sulfeto reagem para formar minerais pretos de ferro-sulfeto (Fig. 2, Tabela 1). O sulfeto também difunde para cima, criando outro gradiente no qual as concentrações de sulfeto são altas na parte inferior da coluna e baixas na parte superior da coluna (Fig. 1).
Perto do meio da coluna, os oxidantes de enxofre aproveitam o fornecimento de oxigênio de cima e sulfeto de baixo. Com a quantidade certa de luz, oxidantes de enxofre fotossintéticos podem se desenvolver nessas camadas. Esses organismos são conhecidos como bactérias de enxofre verde e roxo , e muitas vezes aparecem como filamentos e manchas verde, roxo ou roxo-vermelho (Fig. 2, Tabela 1). As bactérias de enxofre verde têm maior tolerância ao sulfeto e geralmente se desenvolvem na camada diretamente abaixo das bactérias do enxofre roxo. Acima das bactérias de enxofre roxo, bactérias não-enxofre roxas também podem se desenvolver. Esses organismos fotossintestêm usando ácidos orgânicos como doadores de elétrons em vez de sulfeto e muitas vezes aparecem como uma camada vermelha, roxa, laranja ou marrom. Oxidantes de enxofre não fotosintéticos podem desenvolver-se acima das bactérias não-enxofre roxas, e estes geralmente aparecem como filamentos brancos (Fig. 2, Tabela 1). Além disso, bolhas também podem se formar na coluna Winogradsky. Bolhas nas camadas aeróbicas indicam a produção de oxigênio pelas cianobactérias. Bolhas nas camadas anaeróbicas são provavelmente devido à atividade de metanogens, organismos que aeróbicamente quebram matéria orgânica e formam metano como subproduto.
| Posição na Coluna | Grupo funcional | Exemplos de organismos | Indicador Visual |
| Início | Fotossintificadores | Cianobactérias | Camada verde ou marrom-avermelhada. Às vezes bolhas de oxigênio. |
| Oxidantes de enxofre não fotosintéticos | Beggiatoa | Camada branca. | |
| Bactérias não-enxofre roxas | Rhodomicrobium, Rhodospirilum, Rhodopseuodmonas | Camada vermelha, roxa, laranja ou marrom. | |
| Bactérias de enxofre roxo | Chromatium | Camada roxa ou roxa-vermelha. | |
| Bactérias de enxofre verde | Clorobio | Camada verde. | |
| Bactérias redutoras de sulfato | Desulfovibrio, Desulfotomaculum, Desulfobacter, Desulfuromonas | Camada preta. | |
| Fundo | Methanogênios | Metanoococcus | Às vezes bolhas de metano. |
Tabela 1: Os principais grupos de bactérias que podem aparecer em uma coluna clássica de Winogradsky, de cima a baixo. Exemplos de organismos de cada grupo são dados, e os indicadores visuais de cada camada de organismos são listados. Baseado em Perry et al. (2002) e Rogan et al. (2005).
Procedure
1. Configuração
- Para configurar uma coluna Winogradsky, você precisará de alguns suprimentos básicos:
- Uma pá, balde e garrafa para coletar as amostras no campo
- Um vaso vertical e transparente, como um cilindro graduado ou garrafa de água plástica de cerca de 1L
- Plástico e elásticos
- grandes tigelas de mistura e colher grande para mexer
- Uma fonte de enxofre (gema de ovo ou sulfato de cálcio)
- Uma fonte de carbono orgânico (celulose, na forma de jornal desfiado)
- Uma fonte de luz (janela ensolarada ou lâmpada de mesa)
- Solo ou lama coletados de um pântano, pântano, lagoa ou córrego
- Água do mesmo habitat
- OPCIONAL O seguinte será necessário para alguns dos experimentos opcionais descritos neste protocolo:
- Sal de mesa
- Celofane de cores diferentes
- Uma fonte de ferro (como uma unha ou lã de aço)
- Uma geladeira com uma fonte de luz
- Um radiador perto de uma fonte de luz
- Se usar uma garrafa de água de plástico, corte a área do pescoço para que a coluna seja cilídricamente em forma. Remova os invólucros para que a luz possa penetrar através do plástico.
- Os ovos crus podem conter Salmonella e devem ser manuseados com cuidado. Devem ser seguidas técnicas adequadas de lavagem das mãos. Alternativamente, o ovo cozido pode ser usado. Além disso, não há como saber ao certo se lama ou sedimento está contaminado com esgoto ou outra substância nociva. As luvas devem ser usadas ao misturar a lama e configurar a coluna.
2. Montagem de uma Coluna Winogradsky
- Usando a pá, desenterre e colete lama no balde. Os sedimentos devem estar perto da borda da água e completamente saturados com água. Você precisará de lama suficiente para encher cada coluna winogradsky. Coletar um pouco de água da mesma fonte na garrafa de amostra (aproximadamente 3000 mL por coluna é necessário).
- No laboratório, transfira lama suficiente para a primeira tigela de mistura para encher ~75% da sua coluna de volume de 1 litro. Em seguida, peneirar para remover grandes pedras, galhos ou folhas enquanto usa a colher para quebrar aglomerados.
- Adicione um pouco da água que você coletou na tigela de mistura enquanto mexe. Adicione até que a consistência da mistura água-lama seja como um milkshake. Continue se certificando de que não há aglomerados.
- Transfira cerca de 1/3 do milkshake de lama d'água para a segunda tigela. Adicione a gema de ovo e um punhado de jornal desfiado e misture.
- Adicione a mistura de lama, gema de ovo e jornal à coluna até que a coluna esteja cerca de 1/4 cheia.
- Adicione a mistura regular de lama d'água na coluna até que a coluna esteja cerca de 3/4 cheia.
- Adicione a água adicional à coluna, deixando apenas um pequeno espaço (~1/2 polegada) de ar por cima.
- Cubra a coluna com plástico e fixe com um elástico.
- Incubar a coluna na luz à temperatura ambiente.
- Durante as próximas 4 a 8 semanas, monitore as mudanças na coluna Winogradsky para o desenvolvimento de diferentes camadas coloridas e a formação de bolhas, conforme descrito na Tabela 1. Além disso, você deve registrar o tempo que leva para diferentes camadas se desenvolverem.
3. Modificações opcionais na Coluna Winogradsky Clássica
- Adicione 25-50g de sal por coluna Winogradsky 1L à lama coletada antes de adicionar água e mexer (passo 2.3). A adição de sal seleciona para bactérias halófilas (amantes de sal).
- Substratos alternativos, como o ferro, na forma de uma unha ou lã de aço, podem ser adicionados à coluna juntamente com a gema de ovo e o jornal desfiado (passo 2.4). Isso enriquecerá bactérias oxidantes de ferro, como Gallionella,e aparecerá como uma camada cor de ferrugem.
- Em vez da temperatura ambiente (passo 2.9), a coluna pode ser incubada perto de um radiador para selecionar bactérias termofílicas (que amam o calor) ou em uma geladeira com uma fonte de luz para selecionar para bactérias psicofílicas (que amam o frio).
- A quantidade de luz que uma coluna recebe à medida que incuba (passo 2.9) também pode ser variada colocando diferentes colunas em alta luz, pouca luz ou escuridão.
- O comprimento de onda da luz de entrada pode ser limitado cobrindo a coluna com celofófanes diferentemente sombreados à medida que incuba (passo 2.9) para determinar quais cores selecionam para diferentes grupos bacterianos.
4. Análise de dados
- Após 1-3 semanas, alguma coloração verde no topo da camada de lama da coluna clássica winogradsky deve ser visível (Fig. 2A). Estes são os primeiros sinais de crescimento da camada cianobacteriana.
- Com o tempo, continue monitorando a aparência e evolução das diferentes camadas, cada uma indicando os diferentes tipos bacterianos. DICA: Consulte os Conceitos e a Tabela 1 para entender quais bactérias contribuem para as diferentes camadas.

Figura 2A: Uma foto de uma coluna clássica de Winogradsky que incuba a temperatura ambiente por 21 dias. Note o sedimento verde, indicativo de cianobactérias, na porção superior da coluna.
- Se também foram preparadas modificações na coluna clássica de Winogradsky, compare os resultados de cada coluna.
- Observe as camadas em cada uma das colunas winogradsky modificadas. Anote o seguinte:
- As colunas exibem o mesmo número de camadas?
- As camadas são da mesma cor e espessura?
- As camadas ocorrem nas mesmas profundidades?
- Quanto tempo levou para cada coluna se desenvolver?
- Uma coluna se desenvolveu mais lentamente do que as outras?
- Observe as camadas em cada uma das colunas winogradsky modificadas. Anote o seguinte:
A maioria dos microrganismos da Terra não pode ser cultivada em laboratório, muitas vezes porque eles dependem de outros micróbios dentro de suas comunidades nativas. Uma coluna de Winogradsky, nomeada para seu inventor Sergei Winogradsky, é um ecossistema em miniatura e fechado que enriquece as comunidades microbianas dentro de uma amostra de sedimentos, permitindo que os cientistas estudem muitos dos micróbios que desempenham um papel vital nos processos biogeoquímicos da Terra, sem a necessidade de isolá-los e cultuá-los individualmente.
Normalmente, lama e água de um ecossistema, como um lago ou um pântano, são misturados. Como um experimento opcional, o sal pode ser adicionado a esta mistura para enriquecer várias espécies halófilas. Em seguida, uma pequena porção da mistura é suplementada com carbono, geralmente na forma de celulose do jornal, e enxofre, geralmente de uma gema de ovo. Para outro experimento opcional, uma unha pode ser adicionada a esta mistura para enriquecer certas espécies de Gallionella. Esta nova mistura é então adicionada a uma coluna transparente, de modo que a coluna esteja um quarto cheia. Finalmente, o resto da mistura de lama e mais água é adicionada à coluna até que esteja a maior parte do caminho cheia.
A sucessão, que se refere ao desenvolvimento consecutivo de diferentes comunidades microbianas ao longo do tempo, pode ser observada em tempo real com uma coluna winogradsky. À medida que micróbios crescem dentro da coluna, consomem substratos específicos e mudam a química de seu ambiente. Quando seus substratos estão esgotados, os micróbios originais morrem e micróbios com diferentes necessidades metabólicas podem florescer no ambiente alterado. Com o tempo, camadas visivelmente distintas começam a se formar, cada uma contendo partes de uma comunidade bacteriana com diferentes necessidades microambientais.
Por exemplo, micróbios fotossintéticos, em grande parte compostos de cianobactérias, formam camadas verdes ou vermelhas perto do topo da coluna. Uma vez que a fotossíntese produz oxigênio, muitas vezes visto como bolhas na parte superior da coluna, um gradiente é formado com as maiores concentrações de oxigênio perto do topo, e o mais baixo em direção ao fundo. Dependendo dos substratos disponíveis, diferentes comunidades microbianas podem crescer na camada inferior anaeróbica. Bolhas nesta camada podem indicar a presença de metanogênios, que criam gás metano através da fermentação. Aqui, a fermentação microbiana da celulose resulta em ácidos orgânicos. Redutores de sulfato oxidam esses ácidos para produzir sulfeto, e sua atividade é indicada por sedimentos negros. O sulfeto difunde para cima na coluna, criando mais um gradiente onde as concentrações de sulfeto são mais altas em direção à parte inferior da coluna, e mais baixas perto da parte superior. No meio da coluna, os oxidantes de enxofre utilizam o oxigênio de cima e sulfeto de baixo. Com luz adequada, oxidantes de enxofre fotossintético, como bactérias de enxofre verde e roxo, se desenvolvem. Bactérias de enxofre verde toleram maiores concentrações de sulfeto. Assim, eles crescem diretamente abaixo das bactérias de enxofre roxo. Diretamente acima desta camada, bactérias roxas não-enxofre formam uma camada vermelho-laranja. Oxidantes de enxofre não fotosintéticos são indicados pela presença de filamentos brancos.
Condições como luz e temperatura também podem ser variadas para enriquecer outras comunidades. Neste vídeo, você aprenderá a construir uma coluna winogradsky, e variará as condições de crescimento e substratos para enriquecer comunidades microbianas específicas.
Primeiro, localize um ecossistema aquático apropriado, como um lago ou pântano. As amostras de sedimentos devem vir da área próxima à borda da água, e estar completamente saturadas com água. Em seguida, use uma pá e um balde para coletar de um a dois litros da lama saturada. Em seguida, obtenha aproximadamente três litros de água doce da mesma fonte e retorne ao laboratório com as amostras de campo.
No laboratório, coloque os equipamentos de proteção pessoal apropriados, incluindo um jaleco e luvas. Agora, transfira aproximadamente 750 mililitros de lama para uma tigela de mistura. Em seguida, peneirar através da lama para remover grandes pedras, galhos ou folhas e usar uma colher para quebrar qualquer aglomerado. Em seguida, adicione um pouco da água fresca na tigela de mistura, e mexa com uma colher grande. Adicione água até que a consistência da mistura água-lama seja semelhante a um milkshake. Continue se certificando de que não há aglomerados.
Como um experimento opcional, selecione para bactérias halofílicas adicionando 25 a 50 miligramas de sal à mistura de lama.
Em seguida, transfira aproximadamente 1/3 da mistura água-lama para uma segunda tigela de mistura. Adicione uma gema de ovo e um punhado de jornal desfiado na tigela. Em seguida, adicione esta mistura à coluna, até que esteja cerca de 1/4 cheia. Em seguida, adicione a mistura água-lama sem o ovo e o jornal à coluna, até que esteja aproximadamente 3/4 cheia. Em seguida, adicione mais água à coluna, deixando um espaço de 1/2 polegada por cima. Cubra a coluna com plástico e fixe-a com um elástico.
Incubar a coluna na luz perto de uma janela em temperatura ambiente pelas próximas quatro a oito semanas. Durante todo o período de incubação, monitore as mudanças na coluna Winogradsky pelo menos uma vez por semana para o desenvolvimento de diferentes camadas coloridas e a formação de bolhas. Além disso, registo o tempo necessário para que diferentes camadas se desenvolvam.
Outra modificação que pode ser feita é incubar a coluna perto de um radiador para selecionar bactérias termofílicas, ou em uma geladeira para selecionar bactérias psicofófilas. Varie as condições de luz colocando diferentes colunas em alta luz, pouca luz ou escuridão para incubar. Alternativamente, limitar o comprimento de onda da luz de entrada cobrindo a coluna com diferentes tons de celofane para determinar quais cores selecionam para diferentes grupos bacterianos. Para outro experimento opcional, para enriquecer bactérias oxidantes de ferro, adicione uma unha à mistura de água de lama antes da adição de jornal e uma gema de ovo.
Após uma a duas semanas, o crescimento da camada cianobacteriana é indicado por uma película verde ou marrom-vermelha no topo da camada de lama da coluna clássica winogradsky. Com o tempo, a aparência e evolução das diferentes camadas é monitorada, cada um indicativo dos diferentes tipos de bactérias presentes. Ao comparar uma coluna cultivada no escuro com uma coluna tradicional de Winogradsky, vemos que o tratamento escuro produz a camada negra na parte inferior da coluna, indicativo de bactérias redutoras de sulfato.
A coluna escura também pode render outras camadas, dependendo de outras condições de incubação. Além disso, a coluna escura não produz a camada cianobacteriana verde, nem as camadas vermelhas, roxas ou verdes indicativas de bactérias roxas não-enxofre, enxofre roxo e enxofre verde, respectivamente. Esses grupos dependem da luz para o crescimento.
Subscription Required. Please recommend JoVE to your librarian.
Results
Neste experimento, água e sedimentos foram coletados de um habitat de água doce. Duas colunas winogradsky foram construídas e permitidas a desenvolver: uma coluna clássica de Winogradsky incubada na luz à temperatura ambiente (Fig. 2A) e uma coluna winogradsky incubada no escuro à temperatura ambiente (Fig. 2B).

Figura 2B: Uma foto da coluna clássica winogradsky (à esquerda), incubada à temperatura ambiente em luz por 68 dias e uma coluna winogradsky incubada à temperatura ambiente no escuro por 68 dias (à direita).
Depois de permitir que as colunas se desenvolvam por 7-9 semanas, as camadas da coluna clássica podem ser comparadas com a coluna incubada no escuro (Fig. 2B). Na coluna clássica de Winogradsky, uma camada cianobacteriana verde pode ser observada perto do topo do tubo. Perto do centro do tubo, pode-se observar uma camada vermelho-roxo, indicativo de bactérias não-enxofre roxas. Sob esta camada, observa-se uma camada vermelho-roxo, indicativo de bactérias de enxofre roxo. Diretamente sob essa camada, sedimentos negros podem ser observados na região anaeróbica da coluna, indicativo de bactérias redutoras de sulfato.
A coluna cultivada no escuro (Fig. 2B) desenvolveu-se de forma diferente da clássica coluna winogradsky. Como a coluna clássica, a coluna escura produziu sedimentos pretos perto da parte inferior da coluna, indicativo de bactérias redutoras de sulfato. A coluna escura não produziu a camada cianobacteriana verde, nem as camadas vermelhas, roxas ou verdes indicativas de bactérias roxas não-enxofre, enxofre roxo e enxofre verde, respectivamente. Esses grupos dependem da luz para o crescimento e, portanto, incapazes de crescer no escuro.
Os resultados precisos de cada coluna winogradsky variam amplamente com suas condições de incubação e seus habitats de origem.
Comunidades microbianas originárias de habitats de água doce não estarão acostumadas a altas concentrações de sal e a adição de sal pode retardar ou inibir o crescimento. Por outro lado, pode haver bactérias halofílicas suficientes em habitats salgados e de água salgada para que a adição de sais não faça diferença ou mesmo aumente o crescimento de camadas específicas quando comparadas a uma coluna sem sais adicionados.
Sedimentos arenosos são mais porosos do que sedimentos lamacentos. Se o sulfeto suficiente for produzido em tais sedimentos porosos, sulfetos podem difundir todo o caminho até o topo da coluna e inibir o crescimento de organismos aeróbicos. Neste caso, a coluna pode conter apenas camadas indicativas de anaerobes e não pode conter aerobes, como as cianobactérias.
A água doce geralmente contém menos sulfato do que água salgada. O sulfato é importante para o crescimento de bactérias redutoras de sulfato. Os redutores de sulfato criam sulfeto como subproduto e são indicados pelo desenvolvimento de uma camada preta na parte inferior da coluna. Se o sulfato não for complementado para comunidades de água doce, os redutores de sulfato podem não produzir sulfeto suficiente. A criação do subproduto sulfeto é importante para o crescimento das bactérias de enxofre verde e roxo e os oxidantes de enxofre não fotosintéticos. Nestes casos, os oxidantes de enxofre ainda podem crescer usando a gema de ovo como fonte de enxofre, mesmo que os redutores de sulfato (camada negra) nunca se desenvolvam.
Diferentes comprimentos de onda de luz devem ser selecionados para organismos com diferentes pigmentos de absorção. Uma coluna mantida no escuro só permitirá que organismos não fotosintéticos cresçam, incluindo redutores de sulfato, oxidantes de ferro e methanogens. Fotossintéticos têm pigmentos que absorvem luz em diferentes comprimentos de onda dentro da faixa visível (~400-700nm). Ao cobrir uma coluna com, por exemplo, celofane azul, a luz azul (~450-490nm) está bloqueada de entrar na coluna. Todos os fotossintéticos da coluna possuem pigmentos que requerem os comprimentos de onda azuis (6) e seu crescimento deve ser inibido. Por outro lado, o celofane vermelho bloqueará a luz de ~635-700nm. Esses comprimentos de onda são importantes para os pigmentos usados pelas cianobactérias (6), enquanto o enxofre roxo, o enxofre verde e as bactérias não-enxofre roxas ainda podem ser capazes de crescer.
Diferentes comunidades microbianas podem ter habilidades adaptativas muito diferentes para lidar com mudanças nas temperaturas. Altas temperaturas podem aumentar as taxas de atividade microbiana quando há termofófilos suficientes. Por outro lado, na ausência de termofilos, altas temperaturas podem diminuir a atividade microbiana global. Da mesma forma, as baixas temperaturas podem diminuir a atividade microbiana global, a menos que a comunidade microbiana contenha psicobrófilos suficientes.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
A coluna Winogradsky é um exemplo de um ecossistema microbiano interdependente. Depois de misturar lama, água e substratos adicionais de carbono e enxofre em uma coluna vertical, o ecossistema estratificado deve estabilizar-se em zonas separadas e estáveis ao longo de várias semanas. Essas zonas são ocupadas por diferentes microrganismos que florescem em um determinado ponto ao longo do gradiente entre o sedimento rico em sulfeto no fundo e o sedimento rico em oxigênio no topo. Manipulando as condições e substratos dentro da coluna Winogradsky, a presença e a atividade de diferentes microrganismos como halofilos, termófilos, psicofilos, oxidantes de enxofre, redutores de enxofre, oxidantes de ferro e fotossintéticos podem ser observados.
Subscription Required. Please recommend JoVE to your librarian.
References
- Zavarzin G. (2006). Winogradsky and modern microbiology. Microbiology 75(6): 501-511. doi: 10.1134/s0026261706050018
- Esteban DJ, Hysa B, and Bartow-McKenney C (2015). Temporal and Spatial Distribution of the Microbial Community of Winogradsky Columns. PLoS ONE 10(8): e0134588. doi:10.1371/journal.pone.0134588
- Lloyd KG, Steen AD, Ladau J, Yin J, and Crosby L. (2018). Phylogenetically novel uncultured microbial cells dominate Earth microbiomes. mSystems 3(5): e00055-18. doi:10.1128/mSystems.00055-18
- Anderson DC, and Hairston RV (1999). The Winogradsky Column & Biofilms: Models for Teaching Nutrient Cycling & Succession in an Ecosystem. The American Biology Teacher, 61(6): 453-459. doi: 10.2307/4450728
- Dang H, Klotz MG, Lovell CR and Sievert SM (2019) Editorial: The Responses of Marine Microorganisms, Communities and Ecofunctions to Environmental Gradients. Frontiers in Microbiology 10(115). doi: 10.3389/fmicb.2019.00115
- Stomp M, Huisman J, Stal LJ, and Matthijs HCP. (2007) Colorful niches of phototrophic microorganisms shaped by vibrations of the water molecule. ISME Journal. 1(4): 271-282. doi:10.1038/ismej.2007.59
- Perry JJ, Staley JT, and Lory S. (2002) Microbial Life, First Edition, published by Sinauer Associates
- Rogan B, Lemke M, Levandowsky M, and Gorrel T. (2005) Exploring the Sulfur Nutrient Cycle Using the Winogradsky Column. The American Biology Teacher, 67(6): 348-356. doi: 10.2307/4451860




