6.5:
Quantificazione del lavoro
6.5:
Quantificazione del lavoro
Quando un sistema subisce un cambiamento, la sua energia interna può cambiare e l’energia può essere trasferita dal sistema all’ambiente circostante o dall’ambiente circostante al sistema.
Il trasferimento di energia avviene attraverso il calore e il lavoro. La relazione tra energia interna, calore e lavoro è rappresentata dall’equazione:
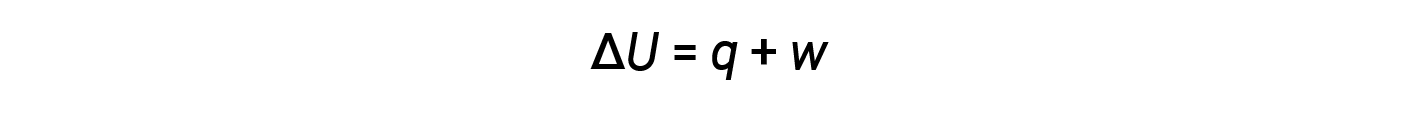
Mentre il calore è una funzione di un cambiamento di temperatura osservato, il lavoro è una funzione di un cambiamento di volume osservato chiamato lavoro pressione-volume. Il lavoro (w) può essere definito come una forza (F) che agisce attraverso una distanza (D).
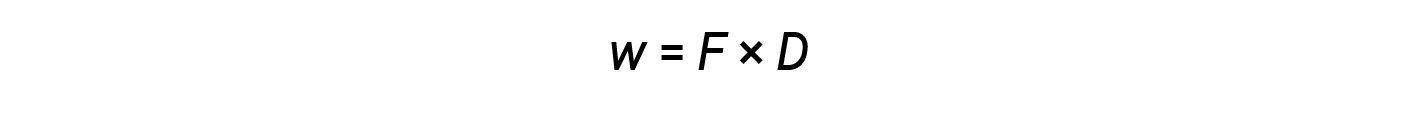
Il lavoro pressione-volume (o lavoro di espansione) si verifica quando un sistema spinge indietro l’ambiente circostante contro una pressione di contenimento o quando l’ambiente circostante comprime il sistema. Un esempio di ciò si verifica durante il funzionamento di un motore a combustione interna. La reazione di combustione di benzina e ossigeno è esotermica. Parte di questa energia viene eso via come calore, e alcune vengono eseguite come lavoro espandendo i gas nel cilindro, spingendo così il pistone verso l’esterno. Le sostanze coinvolte nella reazione sono il sistema, e il motore e il resto dell’universo sono l’ambiente circostante. Il sistema perde energia sia riscaldando che facendo lavoro sull’ambiente circostante, e la sua energia interna diminuisce.
Quando il volume di un cilindro aumenta (cioè, il gas si espande), spinge contro una forza esterna, che è la pressione definita come forza per unità di area.
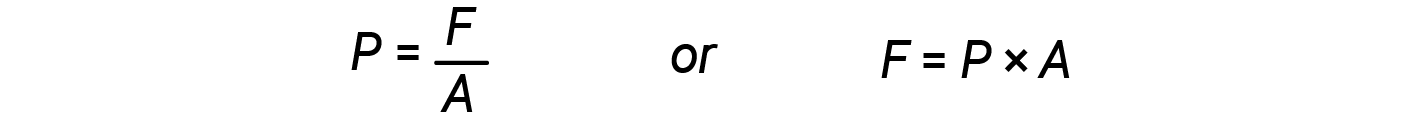
Dalle equazioni 2 e 3:
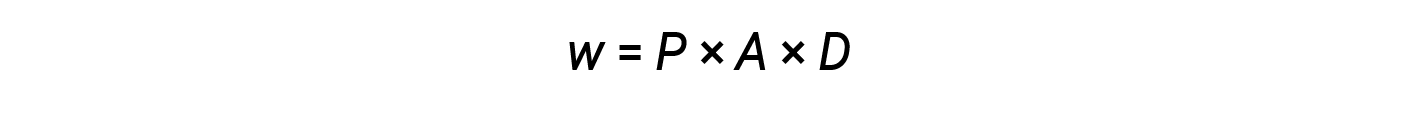
Il prodotto dell’area e della distanza (A × D) è uguale alla variazione di volume (ΔV) del gas nel cilindro.
Quindi

Poiché il volume aumenta durante l’espansione, Vfinale > Vinizialee ΔV è positivo. Tuttavia, per un’espansione positiva (cioè, quando il sistema funziona sull’ambiente circostante), w dovrebbe essere negativo, e quindi, un segno negativo viene aggiunto all’equazione.
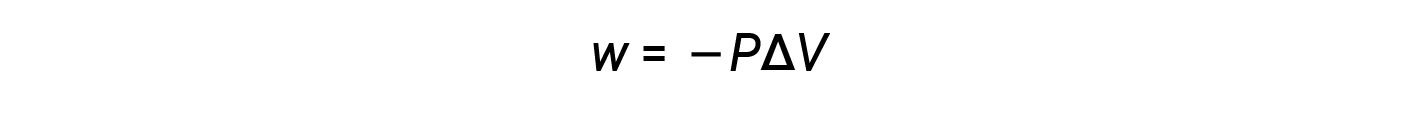
Secondo questa equazione, il lavoro pressione-volume è il negativo della pressione esterna (o pressione opposta) moltiplicato per la variazione di volume.
L’unità di lavoro basata su questa equazione è L·atm. Alcuni altri fattori di conversione utili sono:
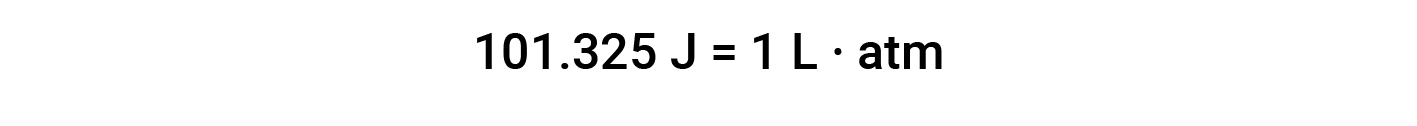
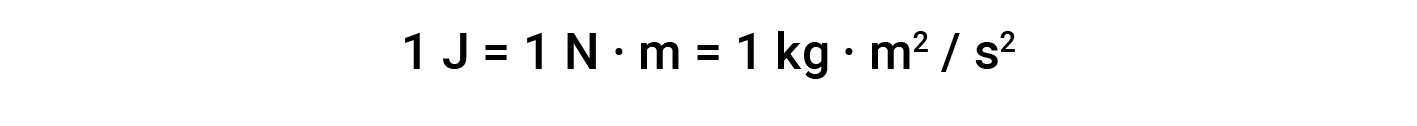
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.3: Entalpia.
Suggested Reading
- Schmidt-Rohr, Klaus. "Expansion work without the external pressure and thermodynamics in terms of quasistatic irreversible processes." Journal of Chemical Education 91, no. 3 (2014): 402-409.
- Gislason, Eric A., and Norman C. Craig. "General definitions of work and heat in thermodynamic processes." Journal of Chemical Education 64, no. 8 (1987): 660.
- O'Loane, J. Kenneth. "Adiabatic changes: Reversible and irreversible changes involving only pressure-volume work." Journal of Chemical Education 30, no. 4 (1953): 190.
