6.5:
일의 수량화
6.5:
일의 수량화
시스템이 변화를 겪으면서 내부 에너지가 변할 수 있으며, 에너지는 시스템에서 주변 환경, 또는 주변 환경에서 시스템으로 전송될 수 있습니다.
에너지 전달은 열과 작업을 통해 발생합니다. 내부 에너지, 열 및 작업 간의 관계는 방정식으로 표시됩니다.
열은 관찰된 온도 변화의 함수이지만, 작업은 압력 볼륨 작업이라고 하는 관찰된 부피 변화의 함수입니다. 작업(w)은거리(D)를통해 작용하는힘(F)으로정의될 수 있다.
압력 볼륨 작업(또는 확장 작업)은 시스템이 억제 압력에 대해 주변 환경을 밀어내거나 주변 환경이 시스템을 압축할 때 발생합니다. 이 예는 내연 기관의 작동 중에 발생합니다. 가솔린과 산소의 연소 반응은 변외적이다. 이 에너지 중 일부는 열로 주어지며, 일부는 실린더의 가스를 확장하여 피스톤을 바깥쪽으로 밀어 내어 작업으로 수행됩니다. 반응에 관련된 물질은 시스템이며, 엔진과 우주의 나머지 는 주변입니다. 이 시스템은 난방과 주변 작업으로 에너지를 잃고 내부 에너지가 감소합니다.
실린더의 부피가 증가하면(즉, 가스가 팽창함) 단면면적당 힘으로 정의된 압력인 외부 힘에 대해 밀어넣습니다.
수학식 2 및 3에서:
영역 및거리(a × D)의생성물은 실린더 내의 가스의 부피(ΔV)의변화와 동일하다.
따라서

확장 시 볼륨이 증가하기 때문에 V최종 > V초기및 ΔV는 양수입니다. 그러나, 긍정적 인 확장 (즉, 시스템이 주변에서 작동 할 때) w는 음수해야하므로, 방정식에 부정적인 기호가 추가됩니다.
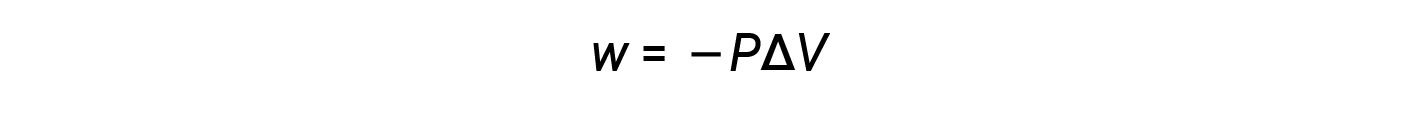
이 방정식에 따르면 압력 볼륨 작업은 볼륨의 변화를 곱한 외부 압력(또는 반대 압력)의 음수입니다.
이 방정식을 기반으로 하는 작업 단위는 L/atm입니다. 다른 유용한 변환 요소는 다음과 같습니다.
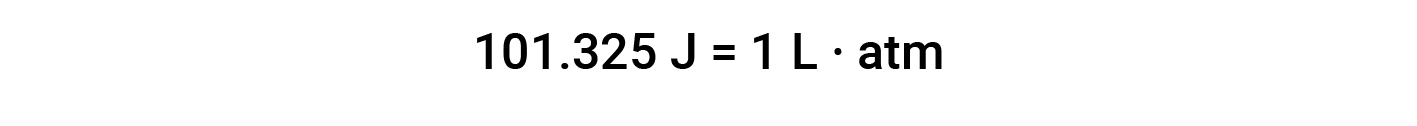
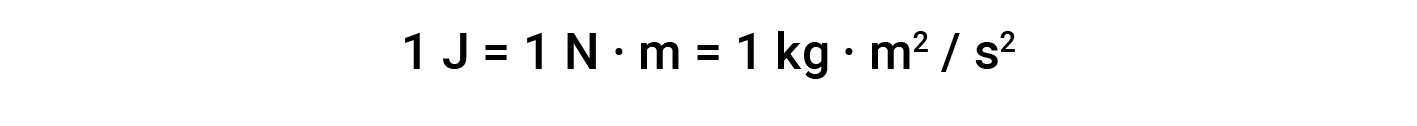
Suggested Reading
- Schmidt-Rohr, Klaus. "Expansion work without the external pressure and thermodynamics in terms of quasistatic irreversible processes." Journal of Chemical Education 91, no. 3 (2014): 402-409.
- Gislason, Eric A., and Norman C. Craig. "General definitions of work and heat in thermodynamic processes." Journal of Chemical Education 64, no. 8 (1987): 660.
- O'Loane, J. Kenneth. "Adiabatic changes: Reversible and irreversible changes involving only pressure-volume work." Journal of Chemical Education 30, no. 4 (1953): 190.
