7.12:
Принцип исключения Паули
7.12:
Принцип исключения Паули
Расположение электронов в орбиталях атома называется его электронной конфигурацией. Мы описываем конфигурацию электрона символом, содержащим три части информации:
- Номер главной квантовой оболочки, n,
- Буква, обозначающей орбитальный тип (подоболочка, l), и.
- Надстрочный номер, обозначающий количество электронов в данной подоболочке.
Например, обозначение 2р4 указывает на четыре электрона вр подоболочке (l = 1) с главным квантовым числом (n) 2. Обозначение 3d 8 указывает на восемь электронов в подоболочке d ( l = 2) основной оболочки, для которой n = 3.
В то время как три квантовых числа хорошо работают для описания электронных орбиталей, некоторые эксперименты показали, что их было недостаточно для объяснения всех наблюдаемых результатов. В 1920-х годах было продемонстрировано, что при рассмотрении спектров водородной линии с чрезвычайно высоким разрешением некоторые линии на самом деле не являются единичными пиками, а, скорее, парами близко расположенных линий. Это так называемая тонкая структура спектра, и это означает, что существуют дополнительные небольшие различия в энергиях электронов, даже если они расположены в одной и той же орбите. Эти наблюдения заставили Самуэля Гаудсмита и Джорджа Уленбека предложить электронам четвёртое квантовое число. Они назвали это спин-квантовым числом или мс.
В приложенном магнитном поле электрон имеет две возможные ориентации с разными энергиями, одна с развинчиваемым, выровненная с магнитным полем, а другая со спин-down, выровненная относительно него.
Четвертое квантовое число, число спиновых квантовых чисел (мс) описывает эти два различных спиновых состояния электрона. Квантовое число спина имеет два возможных значения: -1/2 (замедление вращения) и +половины (увеличение скорости вращения).
Электронный спин описывает «вращение» или «вращение» собственного электрона. Каждый электрон выступает в роли маленького магнита или маленького вращающегося объекта с угловым импульсом или в качестве петли с электрическим током, даже если такое вращение или ток невозможно наблюдать с точки зрения пространственных координат.
Величина общего спинового потока электронов может иметь только одно значение, а электрон может “вращаться” только в одном из двух квантованных состояний. Одно называется состоянием α, при этом z-компонент спина находится в положительном направлении оси z. Это соответствует квантовому числу спина мс = +1/2. Другое называется состоянием β, при этом z-компонент спина является отрицательным и MS = –1/2.
Любой электрон, независимо от того, в какой орбитали атома он находится, может иметь только одно из этих двух значений спинового квантового числа. Энергии электронов, имеющих разные спины, отличаются, если применяется внешнее магнитное поле.
Электрон в атоме полностью описан четырьмя квантовыми числами: n, l, ml, и MS. Первые три квантовых числа определяют орбиту и являются взаимозависимыми, в то время как четвертое квантовое число не зависит от других квантовых чисел, так как оно описывает свойственное электронам свойство, называемое спин. Австрийский физик Вольфганг Паули (Нобелевская премия по физике: 1945) сформулировал общий принцип, который дает последнюю информацию, которая нам нужна для понимания общего поведения электронов в атомах. Принцип исключения Паули можно сформулировать следующим образом: Ни один из двух электронов в одном атоме не может иметь точно такой же набор из всех четырех квантовых чисел. Это означает, что два электрона могут совместно использовать один и тот же орбитальный (один и тот же набор квантовых чисел n, l и ml) только в том случае, если их спиновые квантовые числа имеют разные значения. Так как число спинов-квантовых чисел (мс) может иметь только два значения +половины и -1/2, не более двух электронов могут занимать одну орбиту (и если два электрона расположены на одной орбите, то они должны иметь противоположные спины). Таким образом, любая атомная орбитальная точка может быть заполнена только нулевым, одним или двумя электронами.
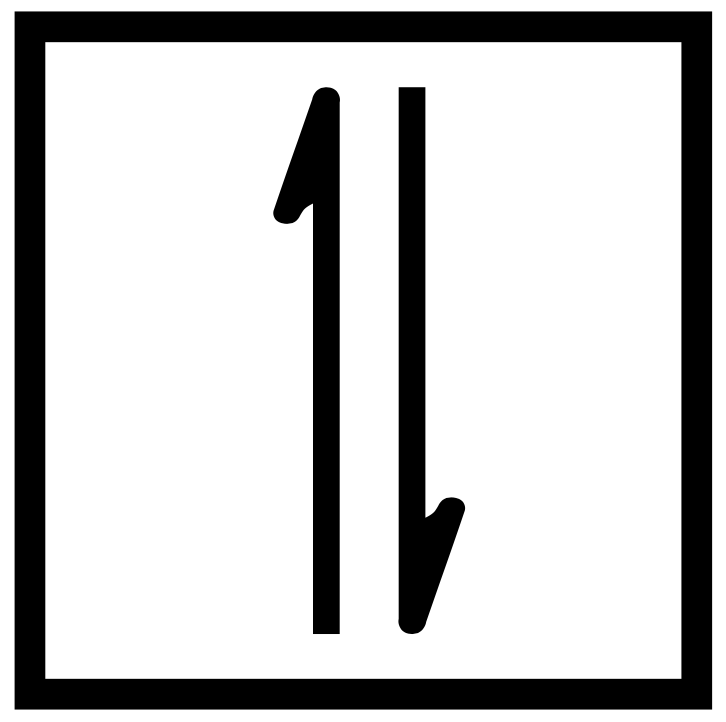
Стиль орбитальной диаграммы конфигурации электронов представляет каждый орбитальный контур в пределах оккупированной подоболочки как прямоугольник или линию, а каждый электрон как стрелка. Орбитальная диаграмма водорода, в которой электрон имеет конфигурацию 1s1, составляет:
Стрелка, направленная вверх, означает вращение на плюс-половину или вращение вверх, а стрелка вниз – на отрицательное вращение или вращение вниз. Следовательно, на орбитальной диаграмме водорода есть одна стрелка, направленная вверх.
Электронная конфигурация гелия 1 с 2 . Два электрона имеют три одинаковых квантовых числа, поскольку они принадлежат одной оболочке и подоболочке. Их спиновые квантовые числа различны в соответствии с принципом исключения Паули. Электроны с противоположными спинами называются парными, если они занимают одну и ту же орбиталь.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 6.3: Развитие квантовой теории.
