7.12:
Il principio di esclusione di Pauli
7.12:
Il principio di esclusione di Pauli
La disposizione degli elettroni negli orbitali di un atomo è chiamata configurazione elettronica. Descriviamo una configurazione elettronica con un simbolo che contiene tre informazioni:
- Il numero del guscio quantico principale, n,
- La lettera che designa il tipo orbitale (il subshell, l), e
- Numero apice che designa il numero di elettroni in quel particolare sottoguscio.
Ad esempio, la notazione 2p4 indica quattro elettroni in un subshell p (l = 1) con un numero quantico principale (n) di 2. La notazione 3d 8 indica otto elettroni nel subshell d ( l = 2) del guscio principale per il quale n = 3.
Mentre i tre numeri quantici funzionano bene per descrivere gli orbitali elettronici, alcuni esperimenti hanno dimostrato che non erano sufficienti a spiegare tutti i risultati osservati. È stato dimostrato negli anni ’20 che quando gli spettri della linea di idrogeno vengono esaminati ad altissima risoluzione, alcune linee non sono in realtà singoli picchi ma, piuttosto, coppie di linee strettamente distanziate. Questa è la cosiddetta struttura fine dello spettro, e implica che ci sono ulteriori piccole differenze nelle energie degli elettroni anche quando si trovano nello stesso orbitale. Queste osservazioni portarono Samuel Goudsmit e George Uhlenbeck a proporre che gli elettroni abbiano un quarto numero quantico. Lo chiamavano numero quantico di spin o ms.
In un campo magnetico applicato, un elettrone ha due possibili orientamenti con energie diverse, uno con spin up, allineato con il campo magnetico, e uno con spin down, allineato contro di esso.
Il quarto numero quantico, numero quantico di spin (ms) descrive questi due diversi stati di spin di un elettrone. Un numero quantico di spin ha due valori possibili, −1/2 (spin down) e +1/2 (spin-up).
Lo spin elettronico descrive una “rotazione” o “rotazione” intrinseca dell’elettrone. Ogni elettrone agisce come un piccolo magnete o un piccolo oggetto rotante con momento angolare, o come un anello con una corrente elettrica, anche se questa rotazione o corrente non può essere osservata in termini di coordinate spaziali.
La grandezza dello spin elettronico complessivo può avere un solo valore, e un elettrone può solo “girare” in uno dei due stati quantizzati. Uno è definito lo stato α, con il componente z dello spin nella direzione positiva dell’asse z. Questo corrisponde al numero quantico di spin ms = +1/2. L’altro è chiamato β, con la componente z dello spin negativa e ms = −1/2.
Ogni elettrone, indipendentemente dall’orbitale atomico in cui si trova, può avere solo uno di questi due valori del numero quantico di spin. Le energie degli elettroni con spin diversi sono diverse se viene applicato un campo magnetico esterno.
Un elettrone in un atomo è completamente descritto da quattro numeri quantici: n, l, mle ms. I primi tre numeri quantici definiscono l’orbitale, e sono interdipendenti, mentre il quarto numero quantico è indipendente da altri numeri quantici in quanto descrive una proprietà intrinseca degli elettroni chiamata spin. Un fisico austriaco Wolfgang Pauli (Premio Nobel per la fisica: 1945) formulò un principio generale che fornisce l’ultima informazione di cui abbiamo bisogno per comprendere il comportamento generale degli elettroni negli atomi. Il principio di esclusione di Pauli può essere formulato come segue: nessun elettrone nello stesso atomo può avere esattamente lo stesso insieme di tutti e quattro i numeri quantici. Ciò significa che due elettroni possono condividere lo stesso orbitale (lo stesso insieme dei numeri quantici n, le ml) solo se i loro numeri quantici di spin hanno valori diversi. Poiché il numero quantico di spin (ms) può avere solo due valori +1/2 e -1/2, non più di due elettroni possono occupare lo stesso orbitale (e se due elettroni si trovano nello stesso orbitale, devono avere spin opposti). Pertanto, ogni orbitale atomico può essere popolato solo da zero, uno o due elettroni.
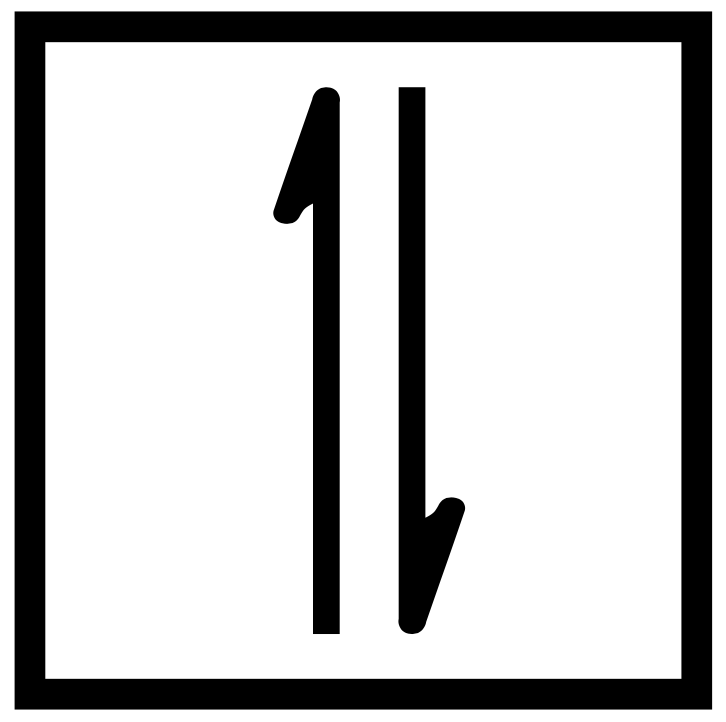
Lo stile del diagramma orbitale della configurazione elettronica rappresenta ogni orbitale all’interno di un sottoguscio occupato come scatola o linea e ogni elettrone come freccia. Il diagramma orbitale dell’idrogeno, che una configurazione elettronica di 1s1, è:

Una freccia verso l’alto indica un giro più mezzo, o spin-up, e una freccia verso il basso significa un minus-half spin, o spin-down. Il diagramma orbitale dell’idrogeno, quindi, ha una freccia verso l’alto.
La configurazione elettronica dell’elio è 1s2. I due elettroni hanno tre numeri quantici identici, in quanto appartengono allo stesso guscio e sottoguscio. I loro numeri quantici di spin sono diversi, in conformità con il principio di esclusione di Pauli. Gli elettroni con spin opposti sono chiamati accoppiati se occupano lo stesso orbitale.
Questo testo è adattato da Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
