13.6:
반응의 반감기
13.6:
반응의 반감기
반응의 반감기(t1/2)는소비되는 반응의 주어진 양의 절반에 필요한 시간입니다. 반감기에 성공하는 각 에서, 반응제의 나머지 농도의 절반이 소비된다. 예를 들어, 과산화수소의 분해 동안, 상반기 동안(0.00시간에서 6.00시간까지),H2 O2의농도는 1.000M에서 0.500M로 감소한다. 후반기(6.00시간에서 12.00시간)의 농도는 0.500M에서 0.250M로 감소하는 반면, 3번째 반감기에는 0.250M에서 0.125M로 떨어지며,H2O2의농도는 6.00시간 연속으로 감소한다.
1차 반응의 반감기는 반응의 농도와 무관하다. 그러나, 다른 순서와 반응의 반감기는 반응의 농도에 따라 달라 집니다.
1차 반응의 반감기
속도 상수에 대한 첫 번째 순서 반응의 반감기와 관련된 방정식은 통합 속도 법에서 파생 될 수 있습니다 :
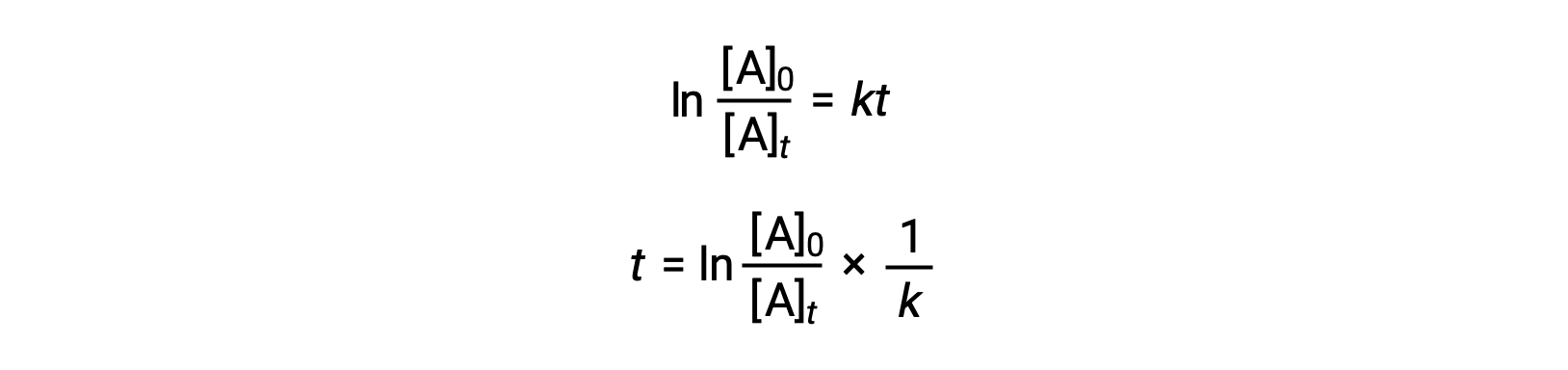
반감기의 정의에 따르면, 시간에 t1/2,반응성 A의 농도는 초기 농도의 절반이다. 따라서; t = t1/2 및 [A]t = 1/2 [A]0.
이러한 용어를 재조정된 통합 금리 법으로 대체하고 단순화하면 반감기에 대한 방정식이 생성됩니다.
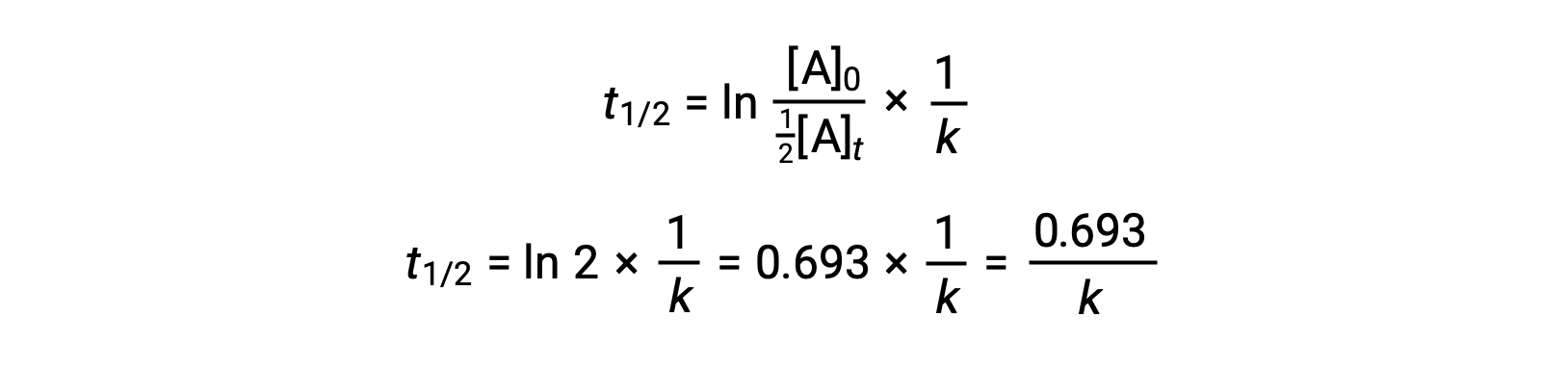
이 반감기 방정식은 반응의 반감기와 그 속도 상수, k 사이의 예상 역 관계를 설명합니다. 더 빠른 반응은 더 큰 비율 상수 및 그에 상응하는 짧은 반감기를 나타내며, 느린 반응은 더 작은 비율 상수와 더 긴 반감기를 나타낸다.
2차 반응의 반감기
1차 반응과 동일한 접근법에 따라, 2차 반응의 반감기와 관련된 방정식은 속도 상수 및 초기 농도에 대한 통합 속도 법에서 파생될 수 있습니다.
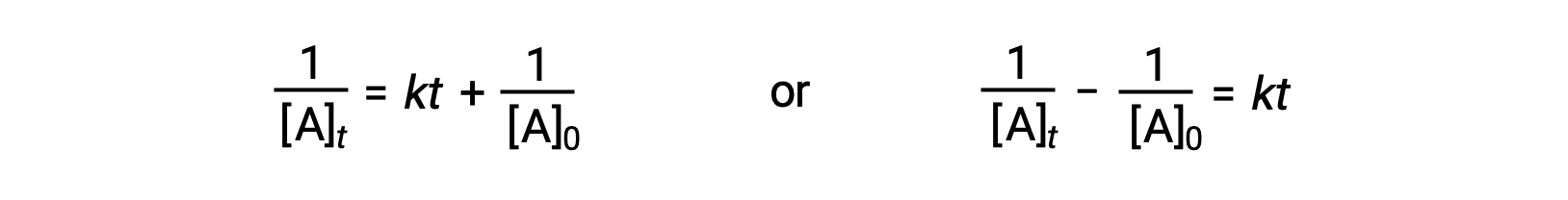
t = t1/2 및 [A]t = 1/2[A]0을대체할 때 통합 요금법이 단순화됩니다.
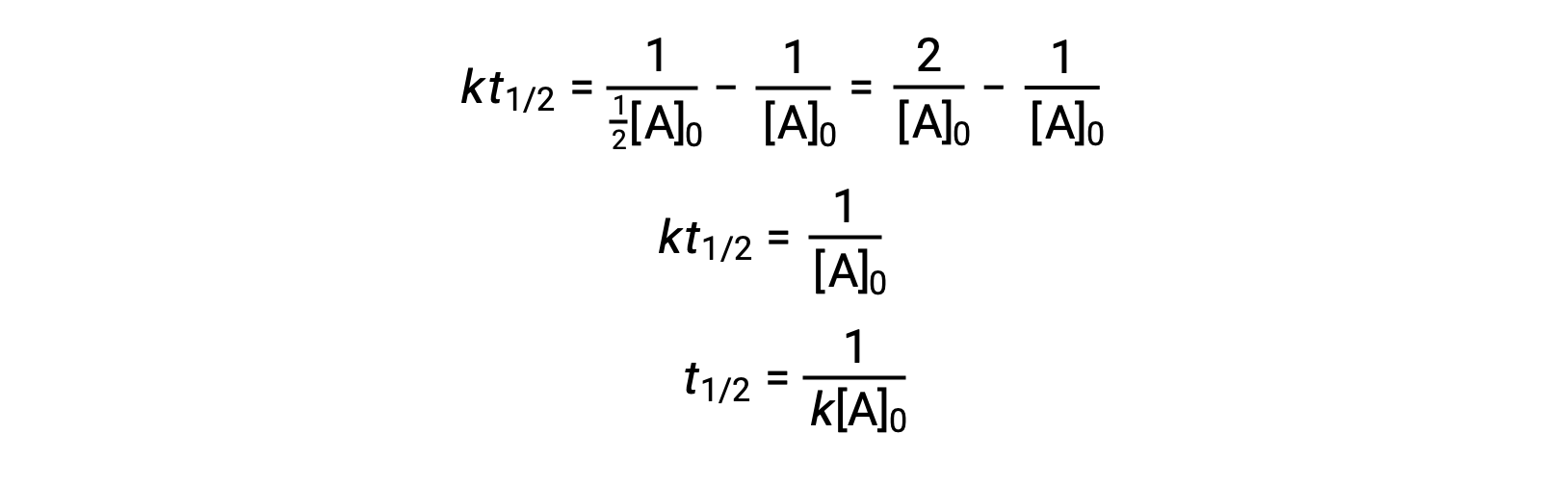
2차 반응의 경우, t1/2는 반응제의 농도에 반비례하며, 반응의 농도가 감소하기 때문에 반감기가 증가한다. 1차 반응과 달리, 초기 농도가 알려지지 않는 한 2차 반응의 일정비율을 반감기로부터 직접 계산할 수 없다.
제로 오더 반응의 반감기
제로 오더 반감기방정식은 통합요금법에서 도출될 수도 있다.
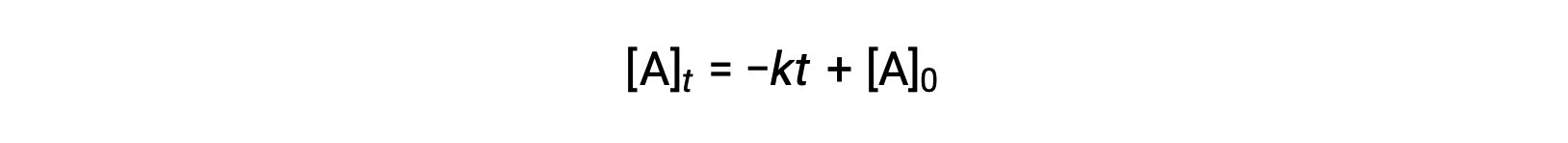
t = t1/2 및 [A]t = 1/2 [A]0,제로 오더 통합 금리 법 산출량 대체:
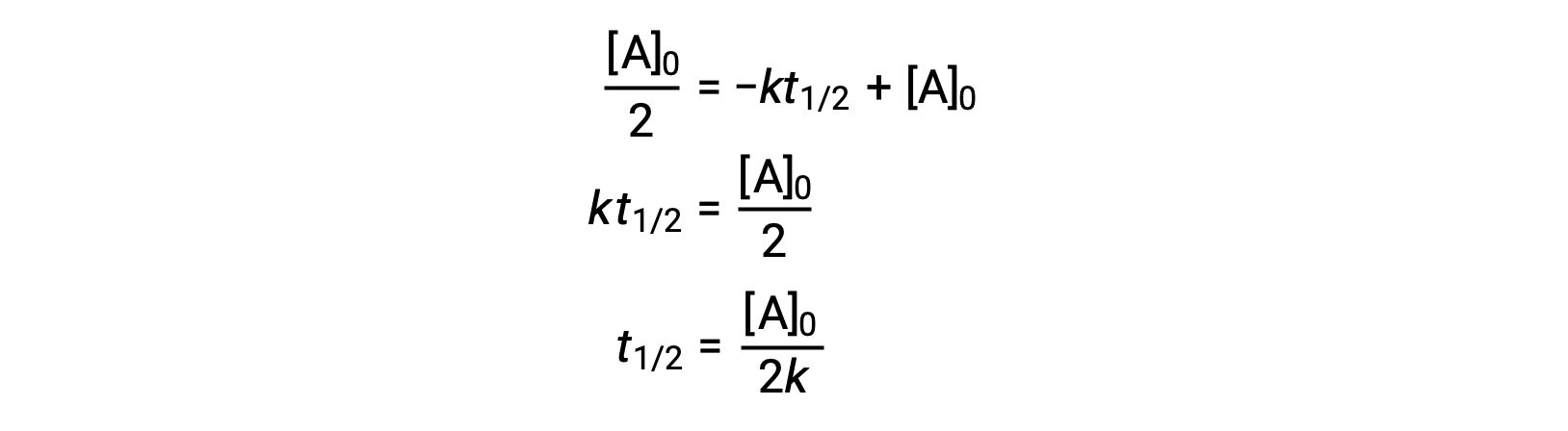
제로 오더 반응의 반감기는 역으로 속도 상수에 비례합니다. 그러나, 제로 오더 반응의 반감기는 초기 농도가 증가함에 따라 증가한다.
