13.6:
Meia-vida de uma Reação
13.6:
Meia-vida de uma Reação
A meia-vida de uma reação (t1/2) é o tempo necessário para que metade de uma determinada quantidade de reagente seja consumida. Em cada meia-vida seguinte, metade da concentração remanescente do reagente é consumida. Por exemplo, durante a decomposição do peróxido de hidrogénio, durante a primeira meia-vida (de 0,00 horas a 6,00 horas), a concentração de H2O2 diminui de 1,000 M para 0,500 M. Durante a segunda meia-vida (de 6,00 horas a 12,00 horas), a concentração diminui de 0,500 M para 0,250 M, enquanto que durante a terceira meia-vida, cai de 0,250 M para 0,125 M. Portanto, durante cada período sucessivo de 6,00 horas, a concentração de H2O2 diminui pela metade.
A meia-vida de uma reação de primeira ordem é independente da concentração do reagente. No entanto, a meia-vida de reações com outras ordens depende das concentrações dos reagentes.
Meia-vida de Reações de Primeira Ordem
Uma equação que relaciona a meia-vida de uma reação de primeira ordem com a sua constante de velocidade pode ser derivada da sua lei de velocidade integrada:
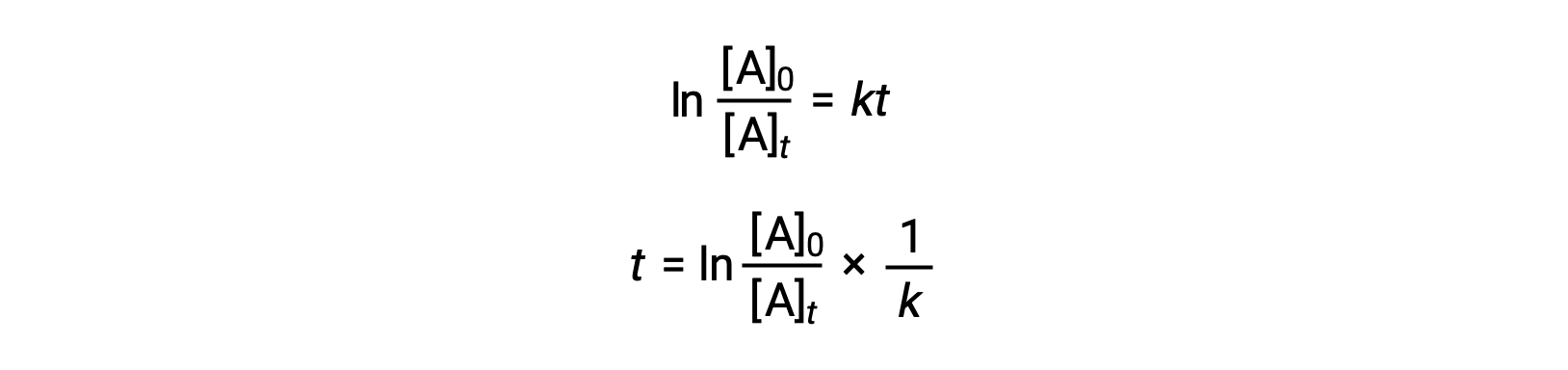
De acordo com a definição de meia-vida, no tempo t1/2, a concentração do reagente A é metade da sua concentração inicial. Por isso; t = t1/2 e [A]t = ½ [A]0.
Substituir e simplificar estes termos na lei de velocidade integrada reorganizada fornece a equação para a meia-vida:
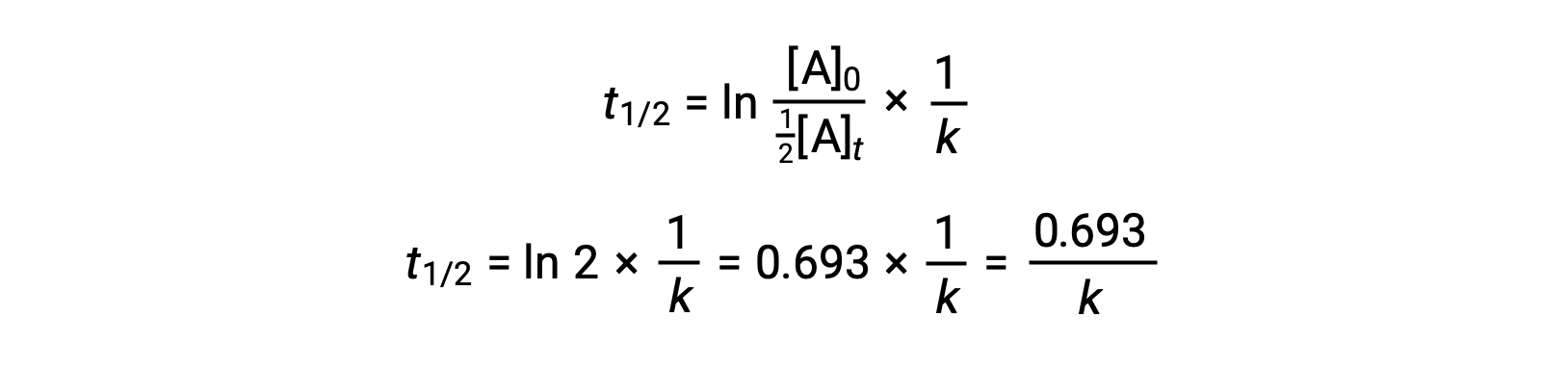
Esta equação de meia-vida descreve uma relação inversa esperada entre a meia-vida da reação e a sua constante de velocidade, k. As reações mais rápidas apresentam constantes de velocidade maiores e meias-vidas correspondentemente mais curtas, enquanto que as reações mais lentas apresentam constantes de velocidade menores e meias-vidas mais longas.
Meia-vida de Reações de Segunda Ordem
Seguindo a mesma abordagem das reações de primeira ordem, uma equação que relaciona a meia-vida de uma reação de segunda ordem com a sua constante de velocidade e concentração inicial pode ser derivada da sua lei de velocidade integrada:
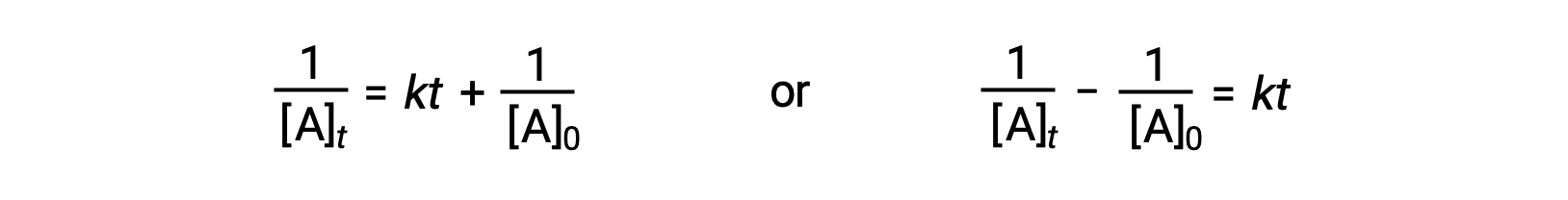
Ao substituir t = t1/2 e [A]t = ½[A]0, a lei de velocidade integrada é simplificada:
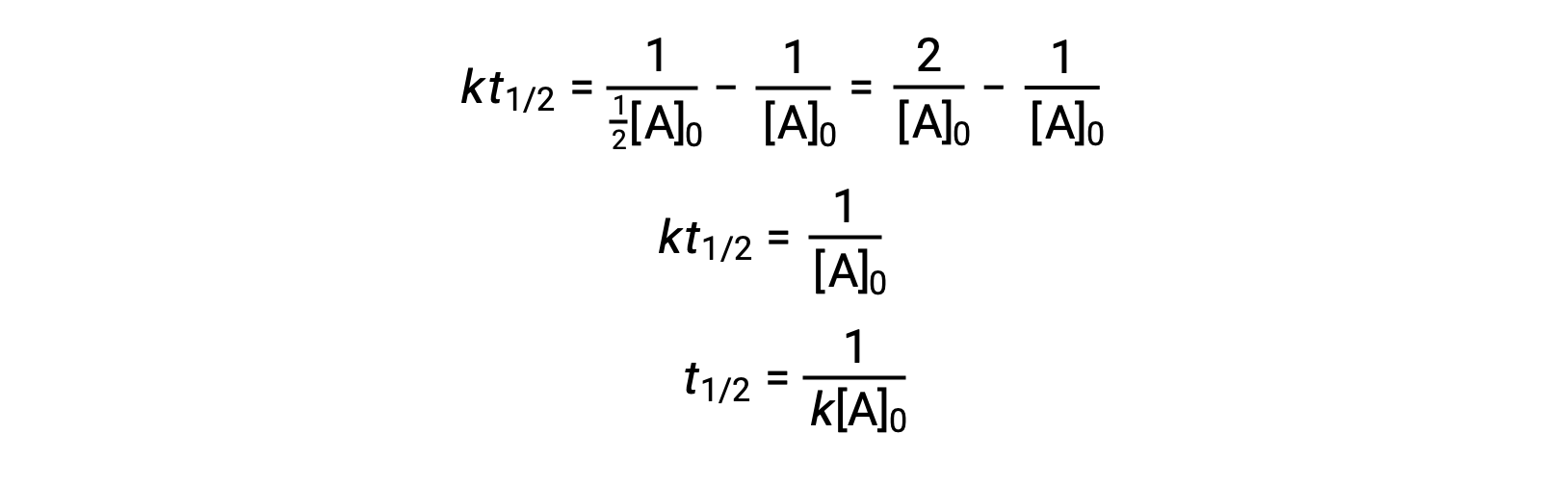
Para uma reação de segunda ordem, t1/2 é inversamente proporcional à concentração do reagente, e a meia-vida aumenta à medida que a reação avança porque a concentração do reagente diminui. Ao contrário das reações de primeira ordem, a constante de velocidade de uma reação de segunda ordem não pode ser calculada diretamente a partir da meia-vida, a menos que a concentração inicial seja conhecida.
Meia-vida de Reações de Ordem Zero
Uma equação para meia-vida de ordem zero também pode ser derivada da sua lei de velocidade integrada:
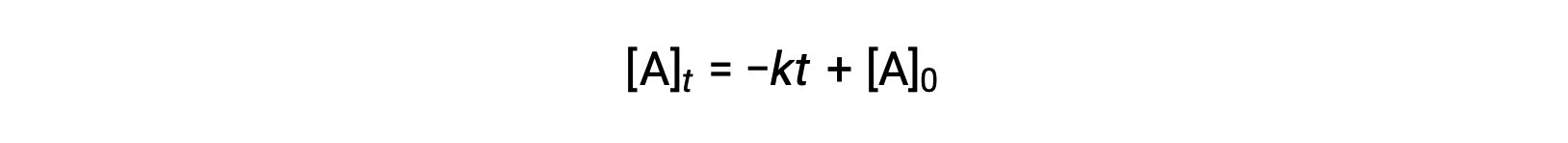
Substituindo t = t1/2 e [A]t = ½ [A]0, na lei de velocidade integrada de ordem zero obtemos:
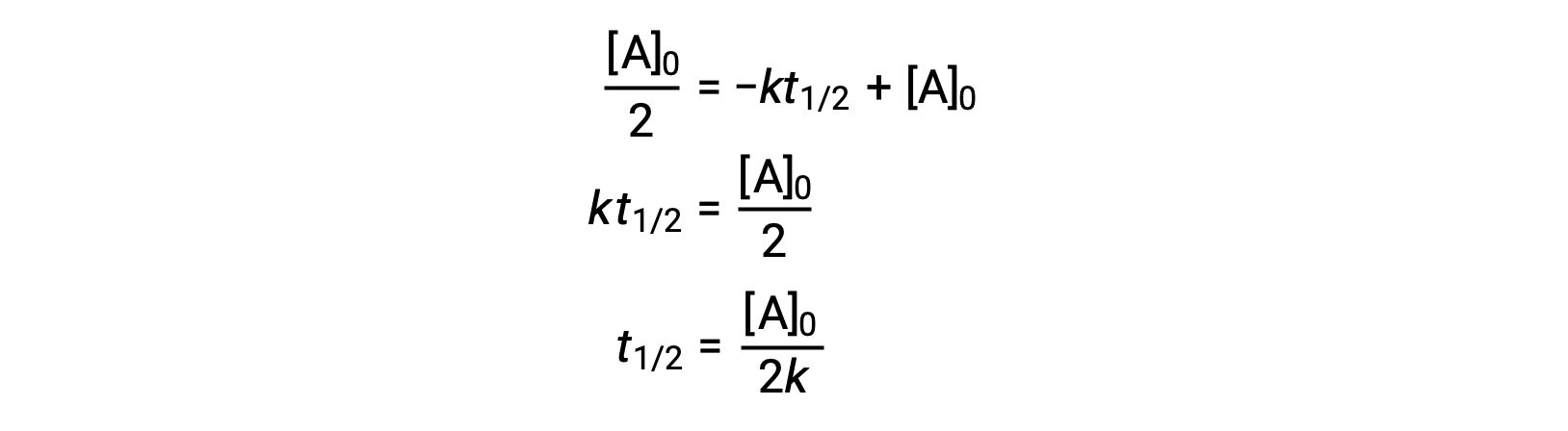
A meia-vida para uma reação de ordem zero é inversamente proporcional à sua constante de velocidade. No entanto, a meia-vida de uma reação de ordem zero aumenta à medida que a concentração inicial aumenta.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
