15.11:
Determinação do pH de Soluções Salinas
15.11:
Determinação do pH de Soluções Salinas
O pH de uma solução salina é determinado pelos seus aniões e catiões componentes. Os sais que contêm aniões de pH neutro e catiões que produzem iões hidrónio formam uma solução com um pH inferior a 7. Por exemplo, em solução de nitrato de amónio (NH4NO3), iões NO3− não reagem com água, enquanto que iões NH4+ produzem iões hidrónio, resultando em solução ácida. Em contraste, os sais que contêm catiões de pH neutro e aniões que produzem iões hidróxido formam uma solução com um pH superior a 7. Por exemplo, em solução de fluoreto de sódio (NaF), a Na+ tem pH neutro, mas F– produz iões hidróxido e forma a solução básica. Os contraiões de um ácido ou de uma base forte são neutros em termos de pH e os sais formados por esses contraiões formam uma solução neutra com um pH igual a 7. Por exemplo, no KBr, o catião K+ é inerte e não afeta o pH. O ião brometo é a base conjugada de um ácido forte e, por isso, tem força básica insignificante (sem ionização básica apreciável). A solução é neutra.
Alguns sais contêm tanto um catião ácido como um anião básico. A acidez ou a basicidade total de uma solução é determinada pela força relativa do catião e do anião, que pode ser comparada usando Ka e Kb. Por exemplo, em NH4F, o ião NH4+ é ácido e o ião F− é básico (base conjugada do ácido fraco HF). Comparando as duas constantes de ionização: Ka do NH4+ é 5,6 × 10−10 e Kb do F− é 1,6 × 10−11, pelo que a solução é ácida, uma vez que Ka > Kb.
Cálculo do pH de uma Solução Salina Ácida
A anilina é uma amina que é utilizada para fabricar corantes. É isolada como cloreto de anilínio, [C6H5NH3+]Cl, um sal preparado pela reação da base fraca anilina com ácido clorídrico. Qual é o pH de uma solução de cloreto de anilínio a 0,233 M?
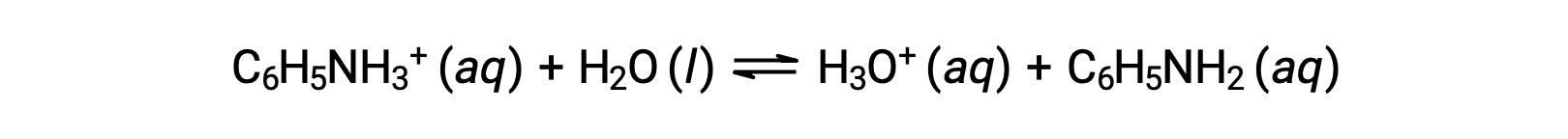
A Ka para o ião anilínio é derivado da Kb para a sua base conjugada, anilina:
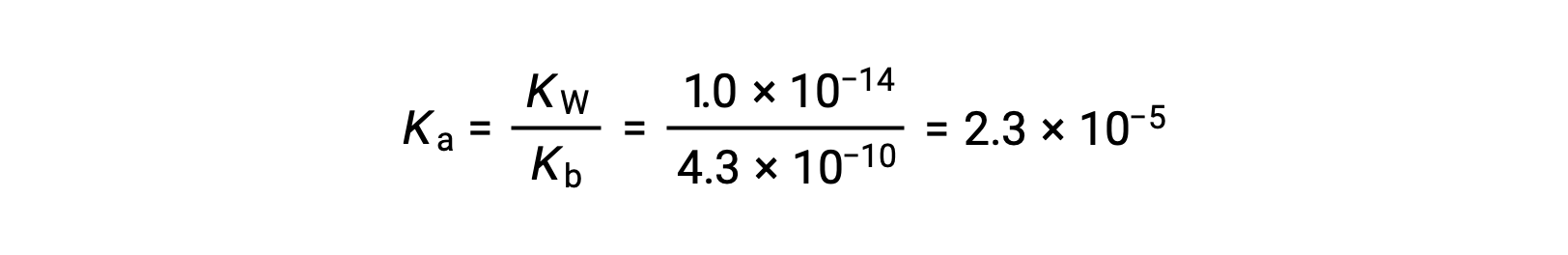
Utilizando as informações fornecidas, é preparada uma tabela ICE para este sistema:
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| Concentração Inicial (M) | 0,233 | ~0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 0,233 − x | x | x |
Substituindo estes termos de concentração de equilíbrio na expressão de Ka obtemos
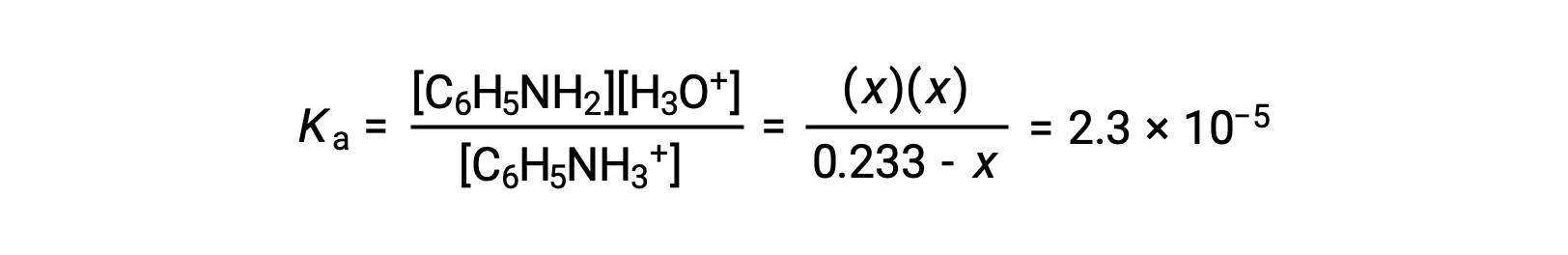
Assumindo que x << 0,233, a equação é simplificada e resolvida para x:
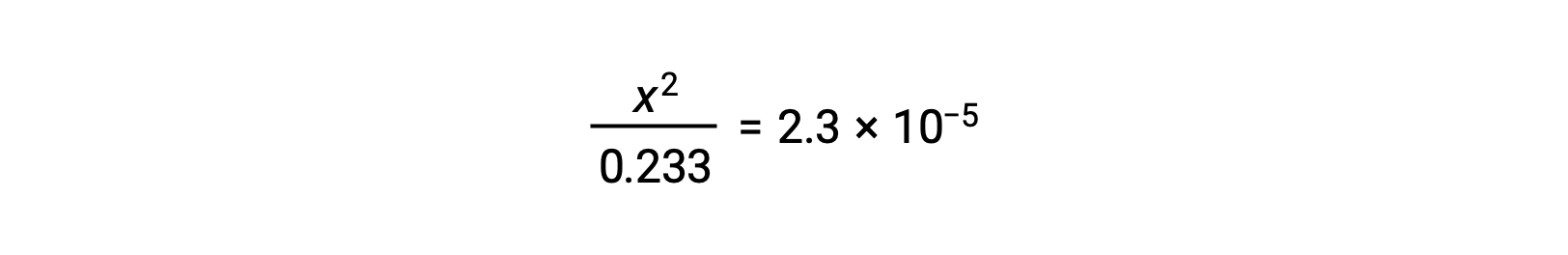

A tabela ICE define x como a molaridade de iões hidrónio e, assim, o pH é calculado como
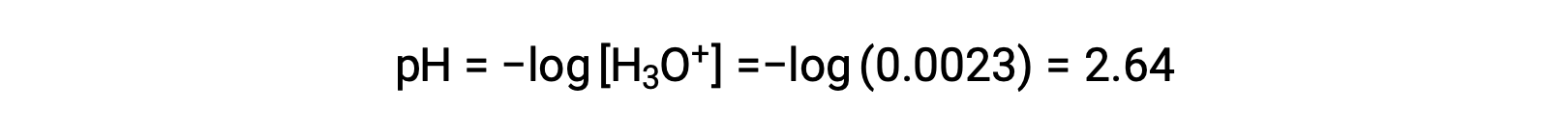
Hidrólise de [Al(H2O)6]3+
Cálculo do pH de uma solução de cloreto de alumínio a 0,10 M, que se dissolve completamente para dar iões de alumínio hidratado [[Al(H2O)6]3+ em solução.
A equação para a reação e Ka são:
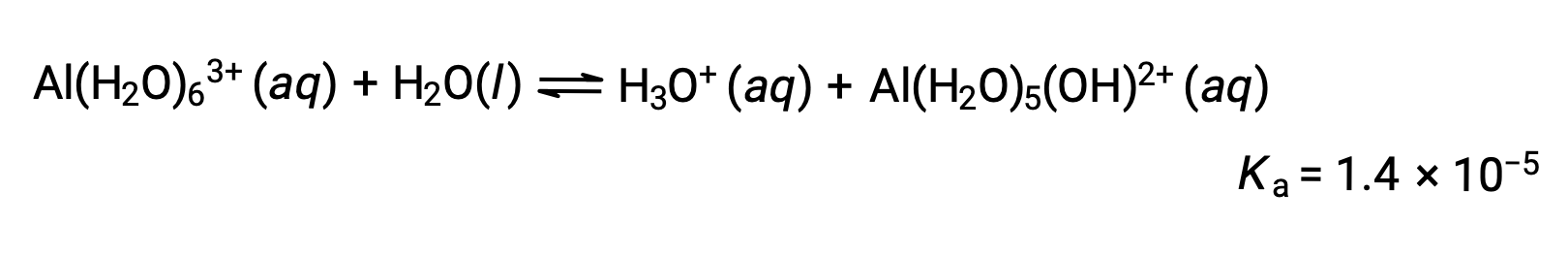
Uma tabela ICE com as informações fornecidas é
| Al(H2O)63+ (aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (aq) | |
| Concentração Inicial (M) | 0,10 | ~0 | 0 |
| Alteração (M) | −x | +x | +x |
| Concentração em Equilíbrio (M) | 0,10 − x | x | x |
Substituindo as expressões das concentrações de equilíbrio na equação para a constante de ionização obtemos:
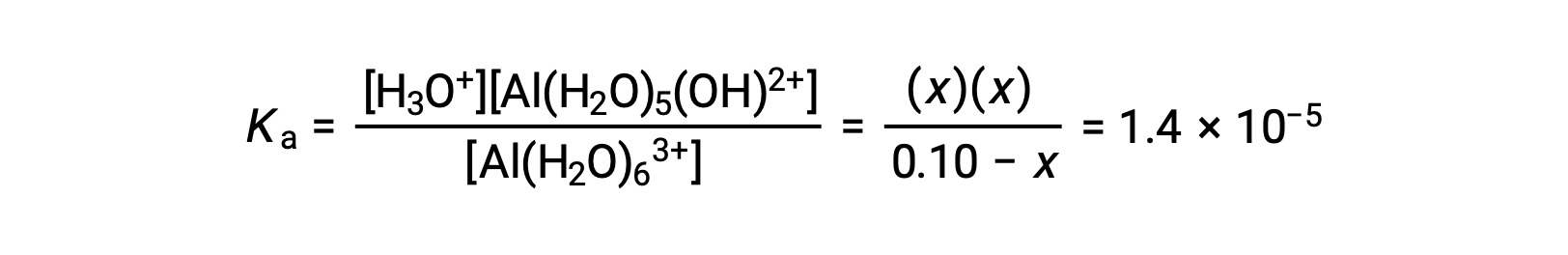
Assumindo que x << 0,10 e resolvendo a equação simplificada obtemos:
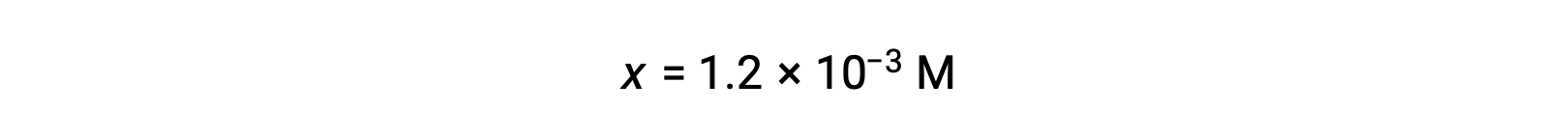
A tabela ICE definiu x como sendo igual à concentração de iões hidrónio, e então o pH é calculado como sendo 2,92, e a solução é ácida.
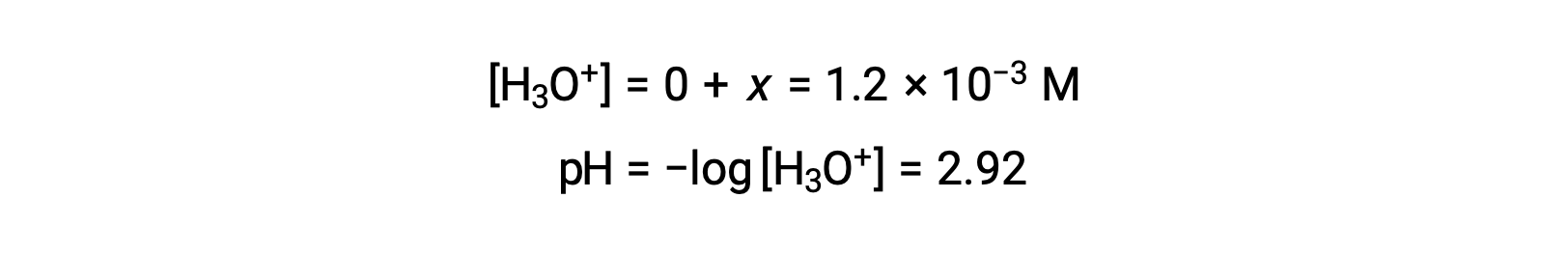
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.4: Hydrolysis of Salts.
