15.11:
确定盐溶液的 pH 值
15.11:
确定盐溶液的 pH 值
盐溶液的 pH 值由其成分阴离子和阳离子决定。 含有 pH 中性阴离子和水合氢离子离子产生阳离子的盐形成了 pH 值小于 7 的溶液。 例如,在硝酸铵 (NH4NO3) 溶液中, NO3− 离子不会与水发生反应,而 NH4+ 离子会产生水合氢离子,从而形成酸性溶液。 相比之下,含有 pH 中性阳离子的盐类和产生氢氧化物的阴离子形成溶液, pH 值大于 7。 例如,在氟化钠 (NAF) 溶液中,Na + 是 pH 中性的,但 F– 产生氢氧化物离子并形成基本的溶液。 强酸或碱的反离子是 pH 值中性的,由这些反离子形成的盐类形成 pH 值等于 7 的中性溶液。 例如,在 KBr 中, K+ 阳离子是惰性的,不会影响 pH 值。 溴化离子是强酸的共轭碱,因此其碱强度可以忽略不计 (无明显的碱电离)。 溶液是中立的。
一些盐既包含酸性阳离子,也包含基本阴离子。 溶液的总体酸度或碱度由阳离子和阴离子的相对强度决定,可使用 Ka 和 K 进行比较B。 例如,在 NH4F 中, NH4+ 离子具有酸性, F− 离子为碱性 (弱酸 HF 的共轭碱)。 比较两个电离常数:NH4+ 的 Ka 为 5.6 × 10−10 , F− 的 KB为 1.6 × 10−11 ,因此溶液为酸性,因为Ka > Kb。
计算酸化盐溶液的 pH 值
苯胺是一种用于制造染料的胺。 该盐被隔离为氯化苯胺 [C6H5NH3+]Cl ,这是一种由弱碱氨基和盐酸反应制备的盐。 0.233 M 氯化苯胺溶液的 pH 值是多少?
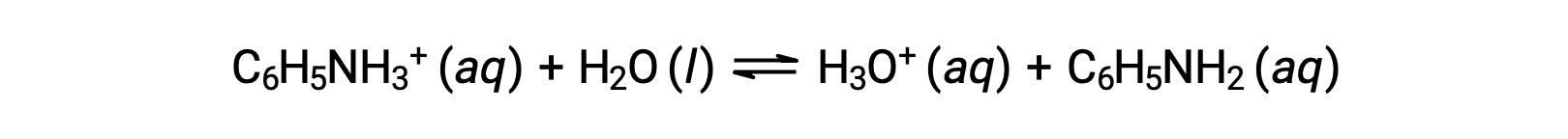
苯胺离子的K a 源自其共轭碱的Kb ,苯胺:
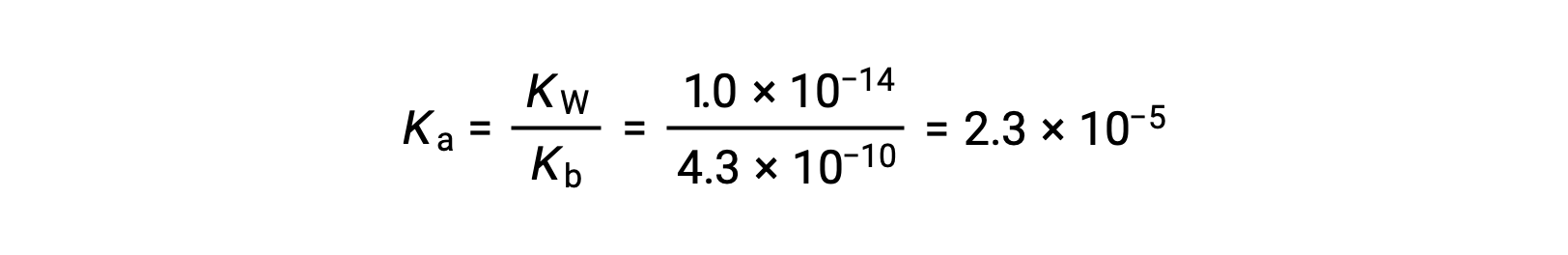
使用提供的信息,准备了用于此系统的 ICE表格 :
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| 初始浓度 (M) | 0.233 | ~0 | 0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.233 − x | x | x |
将这些平衡浓度项替换为 Ka 表达式得出
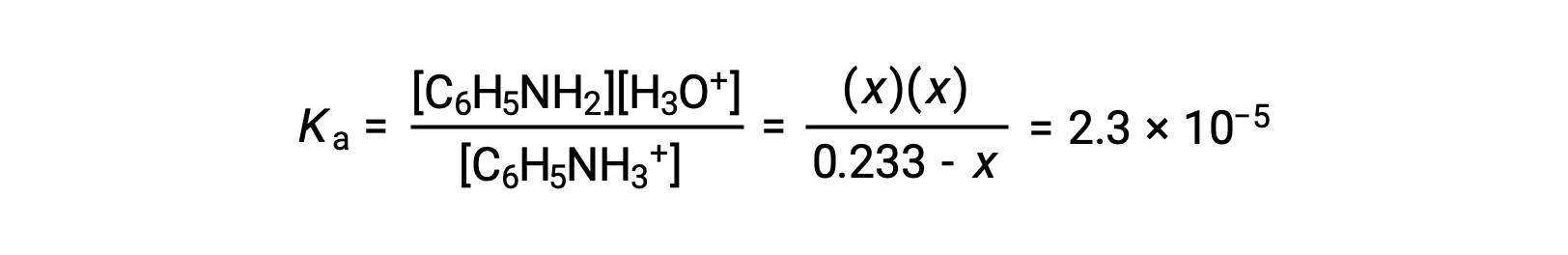
假设 x <<0.233 ,则简化了方程并解x:
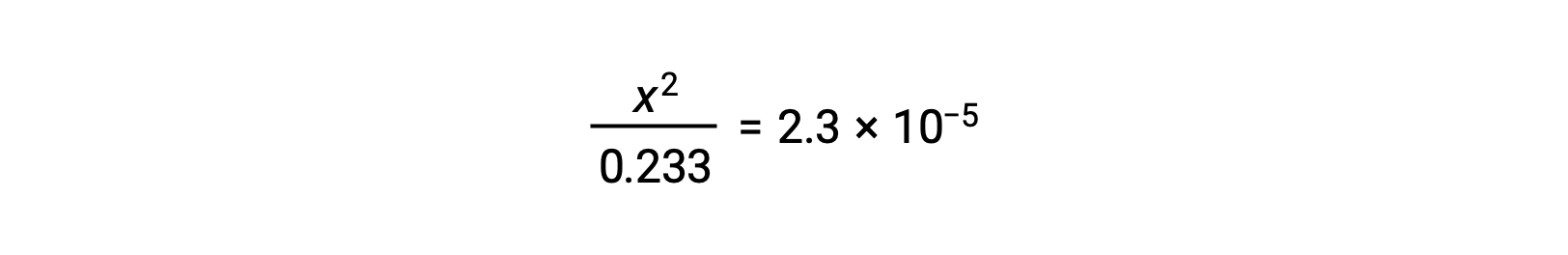

ICE表格 将 x 定义为水合氢离子体积摩尔浓度,因此 pH 计算为
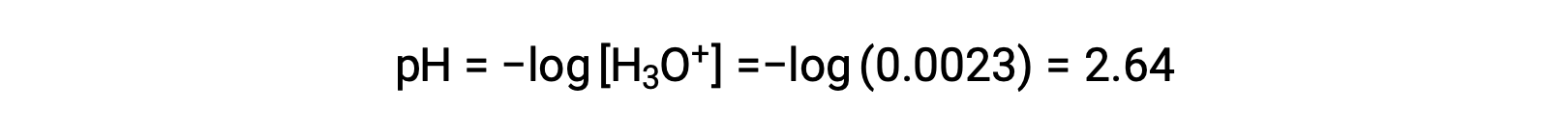
[Al(H2O)6]3+水解
计算一个 0.10 M 溶液的氯化铝的 pH 值,该铝完全溶解以在溶液中为水化铝离子 [Al(H2O)6]3+。
反应的方程和Ka 是:
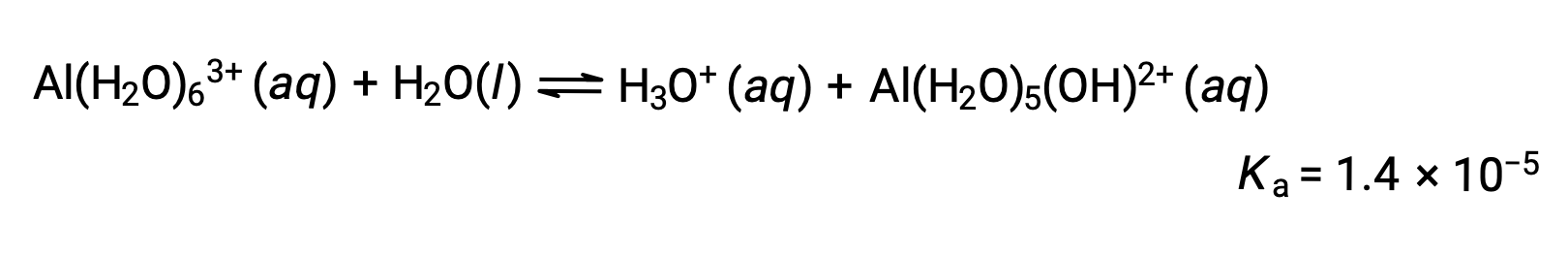
包含所提供信息的 ICE表格 是
| Al(H2O)63+ (aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (aq) | |
| 初始浓度 (M) | 0.10 | ~0 | 0 |
| 变化 (M) | −x | +x | +x |
| 平衡浓度 (M) | 0.10 − x | x | x |
将平衡浓度的表达式代入方程中电离常数的表达式得出:
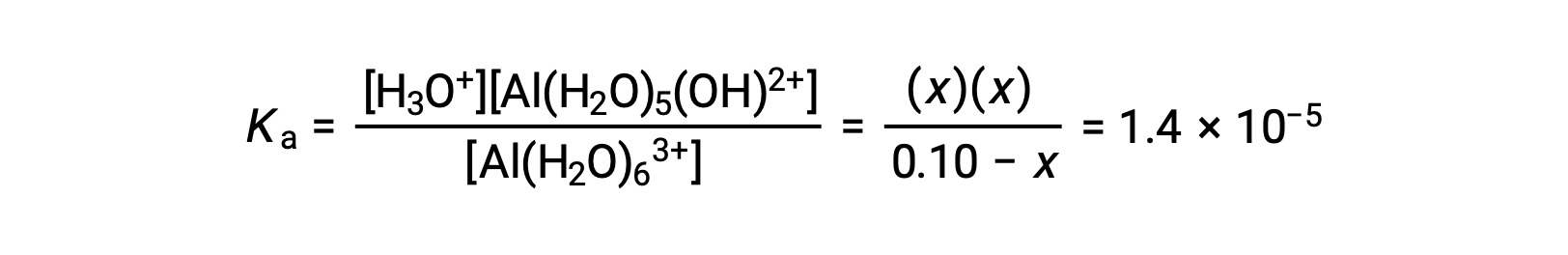
假设x << 0.10 并解简化的方程得出:
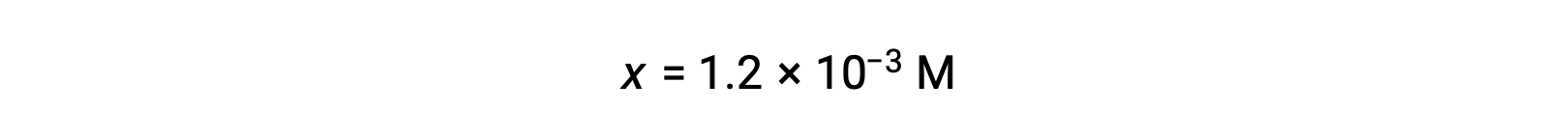
ICE表格将 x 定义为等于水合氢离子浓度,因此 pH 值计算为 2.92 ,溶液为酸性。
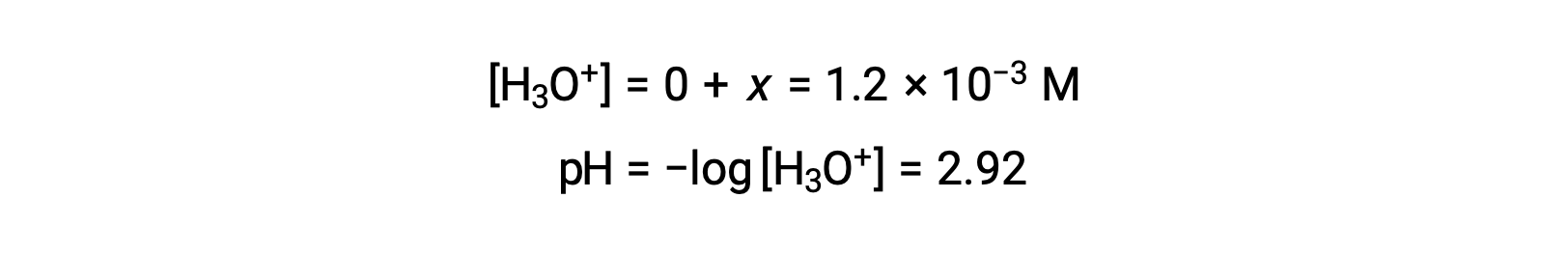
本文改编自 Openstax, 化学 2e, 第14.4节:盐的水解。
