15.11:
Determinando el pH de las Soluciones Salinas
15.11:
Determinando el pH de las Soluciones Salinas
El pH de una solución salina es determinado por sus aniones y cationes componentes. Las sales que contienen aniones pH-neutros y los cationes productores de iones hidronio forman una solución con un pH inferior a 7. Por ejemplo, en la solución de nitrato de amonio (NH4NO3), los iones NO3− no reaccionan con el agua, mientras que los iones NH4+ producen los iones hidronio que resultan en la solución ácida. Por el contrario, las sales que contienen cationes pH-neutros y los aniones productores de iones hidróxido forman una solución con un pH superior a 7. Por ejemplo, en la solución de fluoruro de sodio (NaF), el Na+ es pH-neutro, pero el F– produce los iones hidróxido y forma la solución básica. Los contraiones de un ácido o base fuerte son pH-neutros y las sales formadas por tales contraiones forman una solución neutra con un pH igual a 7. Por ejemplo, en KBr, el catión K+ es inerte y no afectará al pH. El ion bromuro es la base conjugada de un ácido fuerte, y por lo tanto es de una fuerza de base insignificante (no hay una ionización de base apreciable). La solución es neutra.
Algunas sales contienen tanto un catión ácido como un anión básico. La acidez o alcalinidad general de una solución está determinada por la fuerza relativa del catión y el anión, que se puede comparar con Ka y Kb. Por ejemplo, en el NH4F, el ion NH4+ es ácido y el ion F− es básico (base conjugada del ácido débil HF). Comparando las dos constantes de ionización: la Ka de NH4+ es 5,6 × 10−10 y la Kb del F− es 1,6 × 10−11, por lo que la solución es ácida, ya que Ka > Kb.
Calcular el pH de una solución de sal ácida
La anilina es una amina que se utiliza para fabricar colorantes. Se aísla como cloruro de anilinio, [C6H5NH3+], una sal preparada a partir de la reacción entre la base débil anilina y el ácido clorhídrico. ¿Cuál es el pH de una solución 0,233 M de cloruro de anilinio?
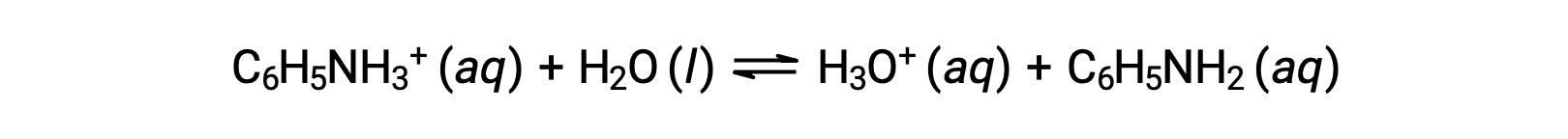
La Ka para el ion anilinio se deriva de la Kb para su base conjugada, anilina:
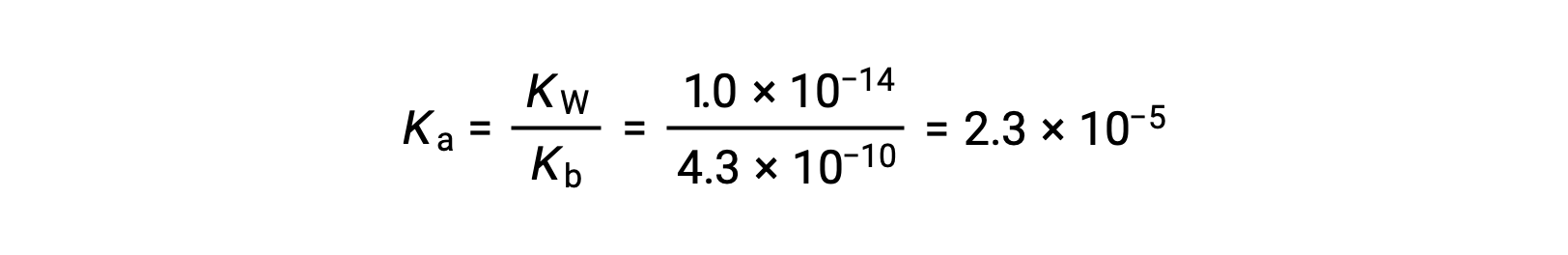
Con la información proporcionada, se prepara una tabla ICE para este sistema:
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (ac) | |
| Concentración inicial (M) | 0,233 | ~0 | 0 |
| Cambio (M) | −x | +x | +x |
| Concentración de equilibrio (M) | 0,233 −x | x | x |
Al sustituir estos términos de concentración de equilibrio en la expresión Ka queda
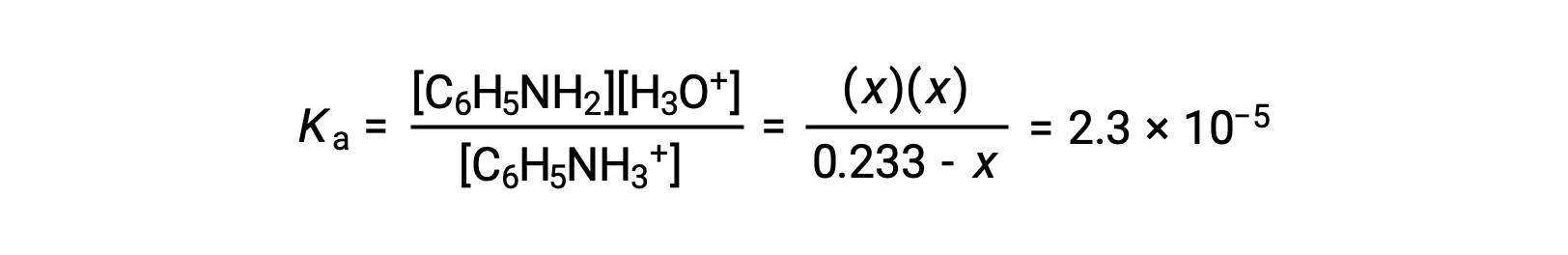
Suponiendo que x << 0,233, la ecuación se simplifica y se resuelve para x:
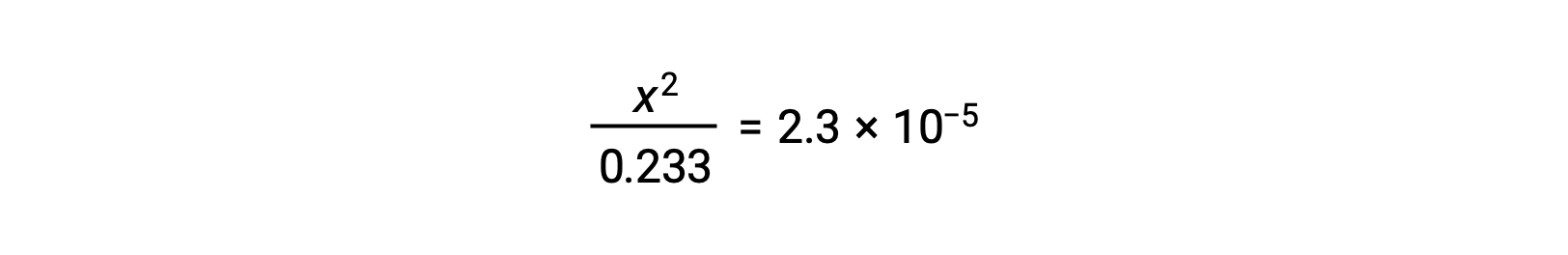

La tabla ICE define x como la molaridad del ion hidronio, y por lo tanto el pH se calcula como
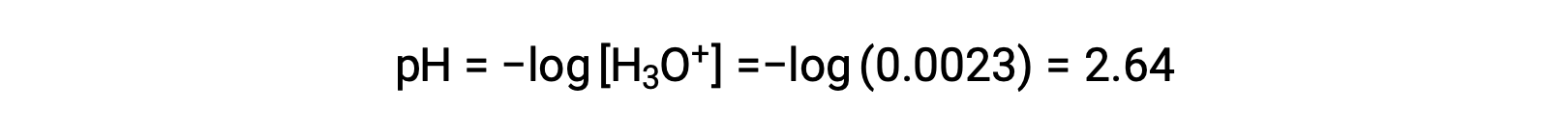
Hidrólisis de [Al(H2O)6]3+
Calcular el pH de una solución de cloruro de aluminio de 0,10 M, que se disuelve completamente para dar el ion de aluminio hidratado [Al(H2O)6]3+ en solución.
La ecuación para la reacción y la Ka son:
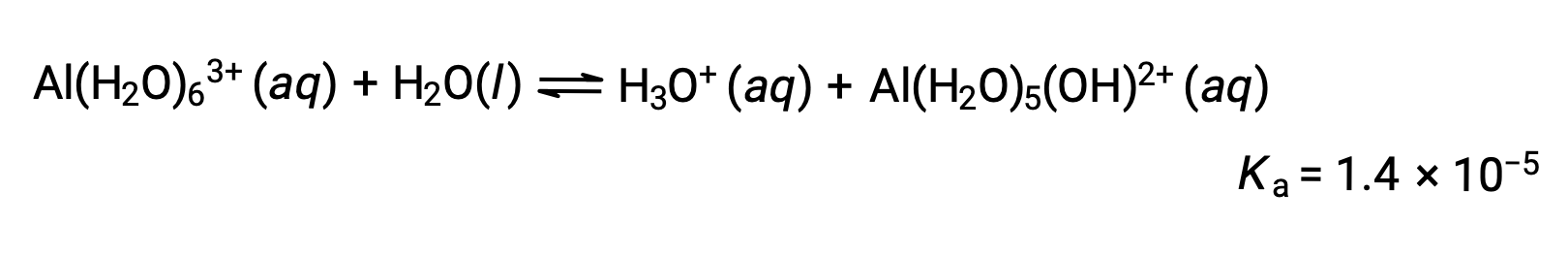
Una tabla ICE con la información proporcionada es
| Al(H2O)63+(ac) | H3O+(ac) | Al(H2O)5(OH)2+ (ac) | |
| Concentración inicial (M) | 0,10 | ~0 | 0 |
| Cambio (M) | −x | +x | +x |
| Concentración de equilibrio (M) | 0,10 − x | x | x |
Si se sustituyen las expresiones de las concentraciones de equilibrio en la ecuación para la constante de ionización, se obtiene:
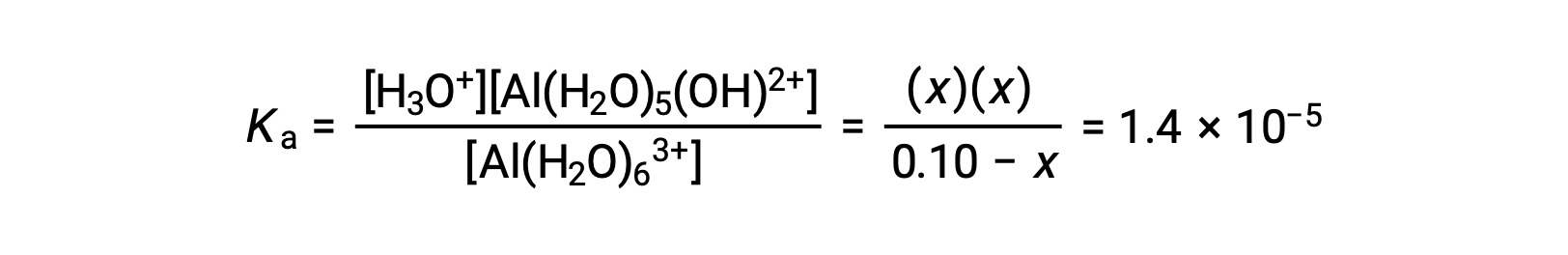
Si se asume que x << 0,10 y se resuelve la ecuación simplificada, se obtiene:
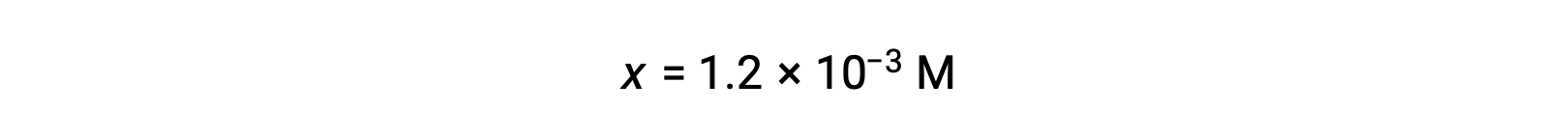
La tabla ICE define x como igual a la concentración de iones hidronio, y por lo que se calcula que el pH es 2,92, y la solución es ácida.
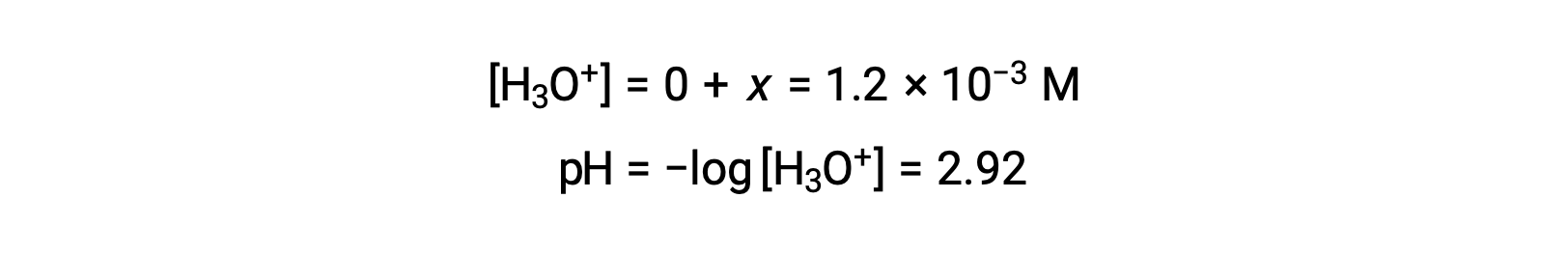
Este texto es adaptado de Openstax, Química 2e, Sección 14.4: Hidrólisis de las Sales.
