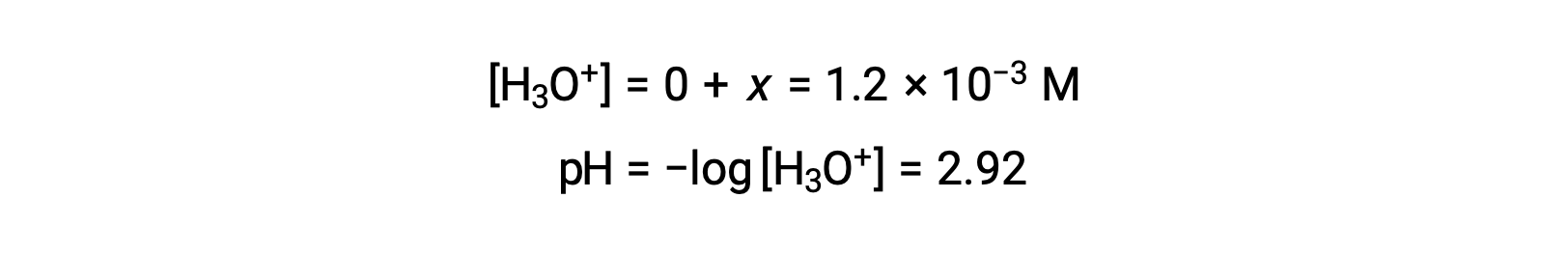15.11:
염용액의 pH 계산
15.11:
염용액의 pH 계산
염액의 pH는 성분 인 음이온 및 양이온에 의해 결정됩니다. pH 중립 음이온과 하이드로늄 이온 생성 양이온을 포함하는 염은 7 미만의 pH를 가진 용액을 형성한다. 예를 들어, 질산암모늄(NH4NO3)용액에서 NO3-이온은 물과 반응하지 않는 반면NH4+ 이온은 산성 용액의 결과로 하이드로늄 이온을 생성한다. 대조적으로, pH 중성 양이온 및 수산화 이온 생성 이온 생성 이온 생성 이온을 포함하는 염은 7보다 큰 pH를 가진 용액을 형성한다. 예를 들어, 나트륨 불소(NaF) 용액에서 Na+는 pH 중립이지만F는 수산화 이온을 생성하고 기본 용액을 형성합니다. 강한 산 또는 염기의 반소는 pH 중립및 이러한 반소에 의해 형성된 염은 7와 동등한 pH를 가진 중성 용액을 형성한다. 예를 들어 KBr에서는 K+ 양이온이 불활성이며 pH에 영향을 주지 않습니다. 브로마이드 이온은 강한 산의 컨쥬게이트 베이스이므로 무시할 수 있는 기저강도(점성기 이온화 없음)입니다. 솔루션은 중립적입니다.
일부 염은 산성 양이온과 기본 윤기 모두를 포함합니다. 용액의 전체 산도 또는 기본성은Ka 및 Kb를사용하여 비교할 수 있는 양이온 및 애니메이션의 상대강도에 의해 결정된다. 예를 들어, NH4F에서, NH4+ 이온은 산성 및 F– 이온은 기본 (약한 산성 HF의 컨쥬게이트 베이스)이다. 두 이온화 상수를 비교 : NH4+의 K는 5.6 × 10-10 및 F의 Kb – 1.6 × 10-11입니다,그래서 솔루션은 Ka > Kb 이후산성입니다.
산성 염액의 pH 계산
애니라인은 염료를 제조하는 데 사용되는 아민입니다. 염화항염으로 분리되고, 【C6H5NH3+Cl】, 약한 염기 의 반응에 의해 제조된 염분 및 염산. 염화 염화물 아닐리늄의 0.233 M 용액의 pH는 무엇입니까?
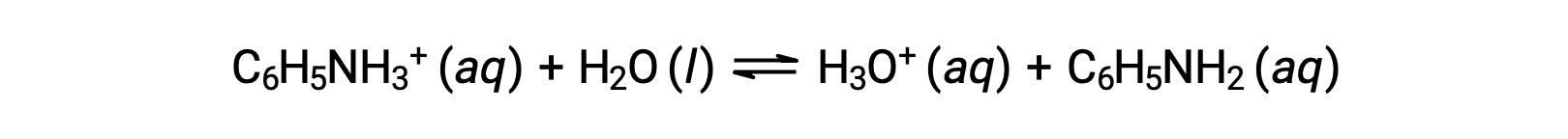
아닐리늄 이온용 KA는 K b로부터 컨쥬게이트 베이스, 애니라인으로부터 유래된다.
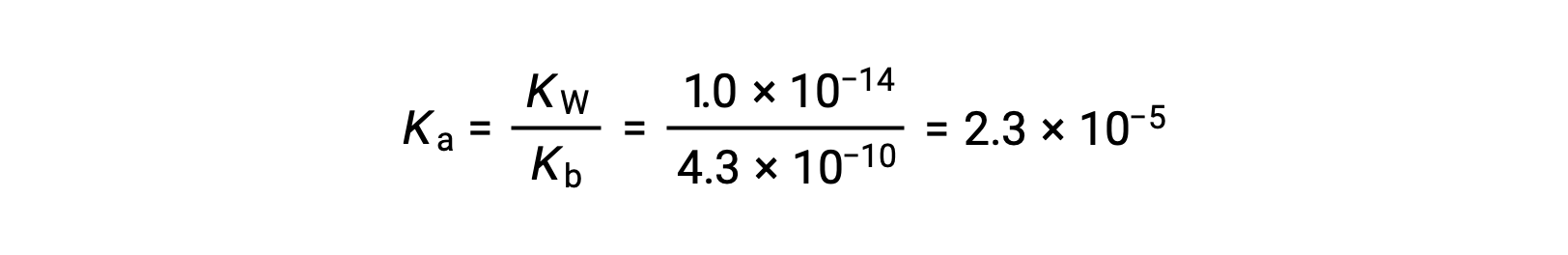
제공된 정보를 사용하여 이 시스템의 ICE 테이블이 준비됩니다.
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| 초기 농도(M) | 0.233 | ~0 | 0 |
| 변경(M) | –x | +x | +x |
| 평형 농도 (M) | 0.233 – x | Ⅹ | Ⅹ |
이러한 평형 농도 용어를 K로대체하면표현이
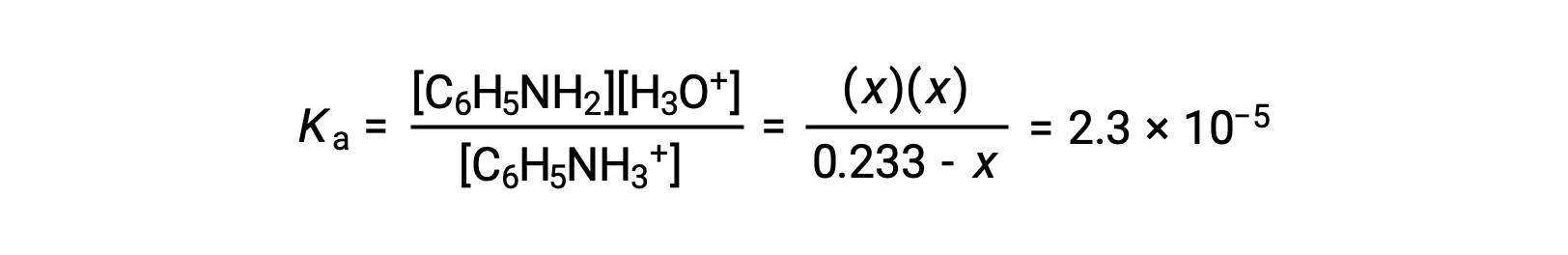
x< 0.233을 가정하면 방정식이 단순화되고 x로 해결됩니다.
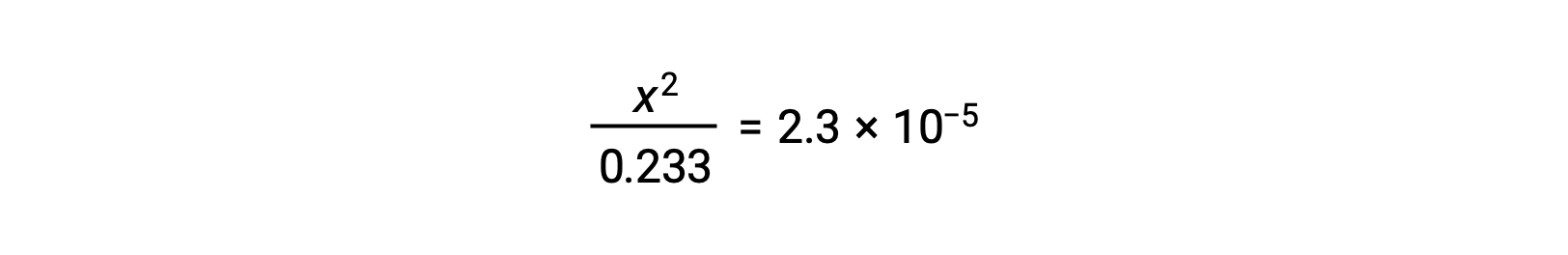

ICE 테이블은 x를 하이드로늄 이온 어모로 정의하므로 pH는
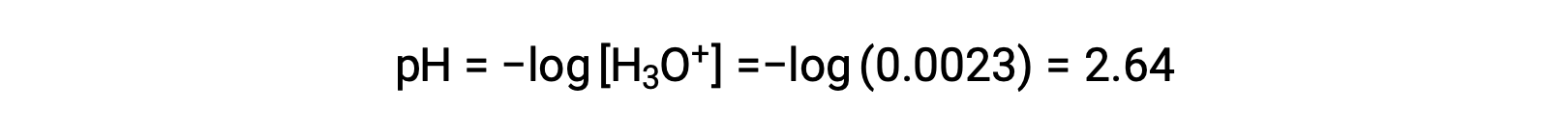
[알(H2O)6]3+
알루미늄 염화물의 0.10 M 용액의 pH를 계산하여 용액에 수화 알루미늄 이온을 제공하기 위해 완전히 용해됩니다 [Al(H2O)6]3+ 용액.
반응 및 K a에 대한 방정식은 다음과 같습니다.
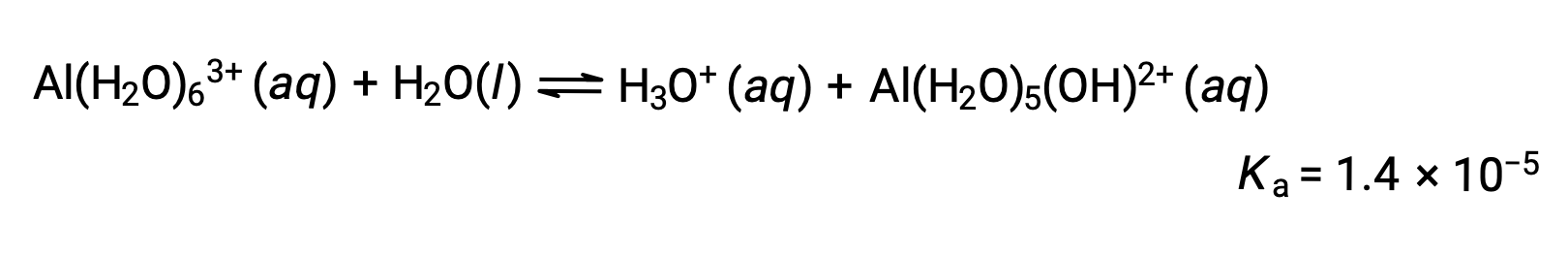
제공된 정보가 있는 ICE 테이블은
| 알(H2O)63+ (aq) | H3O+ (aq) | 알(H2O)5(OH)2+ (aq) | |
| 초기 농도(M) | 0.10 | ~0 | 0 |
| 변경(M) | -x | +x | +x |
| 평형 농도 (M) | 0.10 – x | Ⅹ | Ⅹ |
이온화 상수 수율을 위한 방정식에 평형 농도에 대한 표현을 대체합니다.
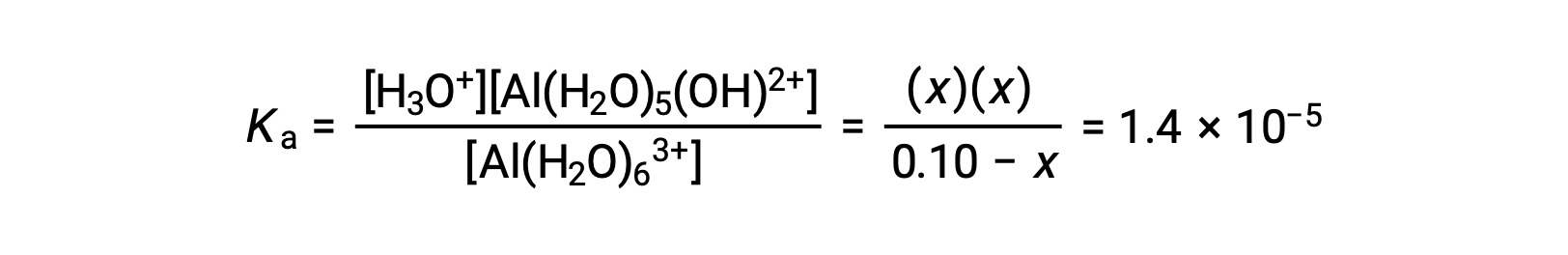
x<< 0.10을 가정하고 단순화된 방정식을 해결하면 다음이 됩니다.
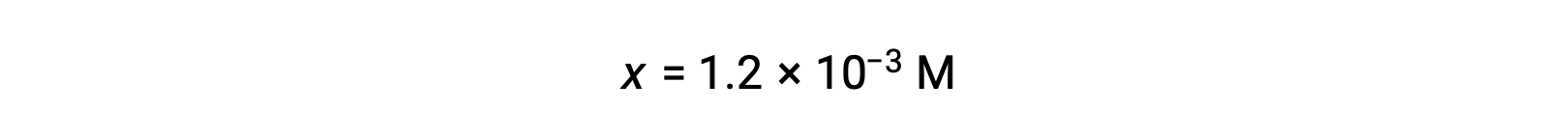
ICE 테이블은 x를 하이드로늄 이온 농도와 동일하게 정의하고, 따라서 pH는 2.92로 계산되고, 용액은 산성이다.