15.11:
Определение pH солевых растворов
15.11:
Определение pH солевых растворов
PH соли раствор определяется его компонентными анионами и катионами. Соли, содержащие нейтральные по pH анионы и ионообразующие гидроний катионы, образуют раствор с pH менее 7. Например, в нитрате аммония (NH4NО3) раствор ионы NО3– не реагируют на воду, тогда как ионы NH4+ производят ионы гидрония, образующие кислотный раствор. В отличие от этого, соли, содержащие pH-нейтральные катионы, и анионы, производящие гидроксид, образуют раствор с pH больше 7. Например, в растворе фторида натрия (NaF) раствор Na+ нейтрален по pH, но F– производит ионы гидроксида и образует основной раствор. Контраоны сильной кислоты или основание являются pH-нейтральными, а соли, образованные такими контраонами, образуют нейтральный раствор с pH равным 7. Например, в KBR катион K+ инертен и не влияет на pH. Ион бромистого вещества является конъюгатом основание сильной кислоты, и поэтому он имеет силу пренебрежимый основание (никакой заметной ионизации основание). раствор находится в нейтральном положении.
Некоторые соли содержат как кислый катион, так и основной анион. Общая кислотность или основность раствор определяется относительной силой катиона и аниона, которую можно сравнить с помощью Ка и Кбайт. Например, в NH4F ион NH4+ является кислотным, а ион F- является основным (конъюгатный основание слабой кислоты HF). Сравнение двух констант ионизации: Ka of NH4+ составляет 5.6 × 10-10, а Kb of F– 1.6 × 10-11, поэтому раствор является кислотным, так как Ka > Kb.
Расчет pH кислой соли раствор
Анилин — это амин, который используется для изготовления красителей. Он изолирован как хлорид анилиния, [C6H5NH3+]CL, соль, приготовленная в результате реакции слабого анилина основание и соляной кислоты. Что такое pH 0.233 M раствор хлорида анилиния?
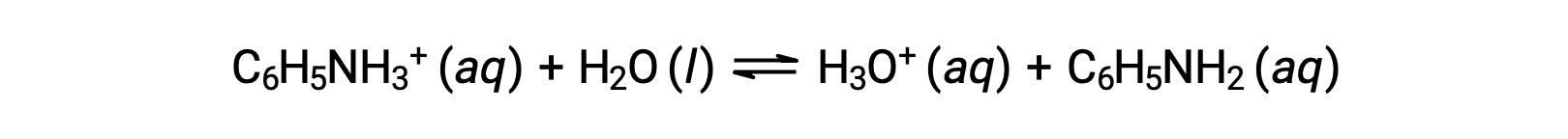
Ка для иона анилиния выводится из Кбайт для его конъюгата основание, анилина:
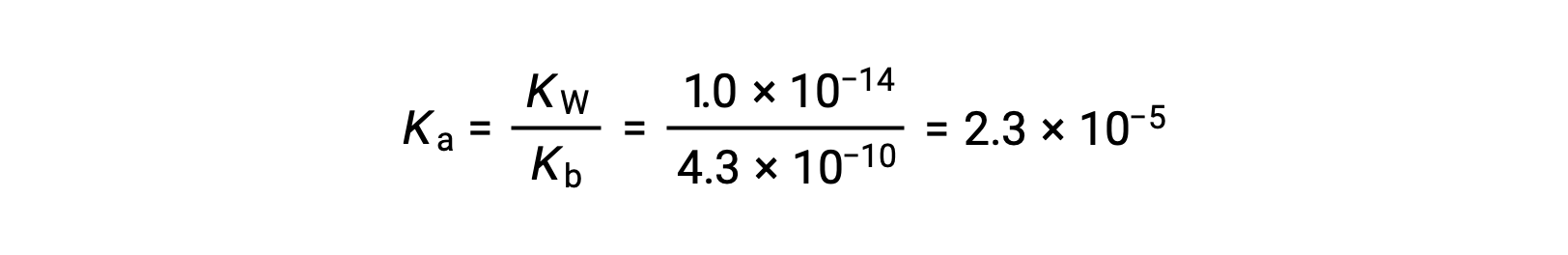
С помощью предоставленной информации подготовлена таблица ICE для данной системы:
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| Начальная концентрация (M) | 0.233 | ~0 | 0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.233 – x. | x | x |
Подстановка этих равновесных терминов концентрации в выражение Ка дает
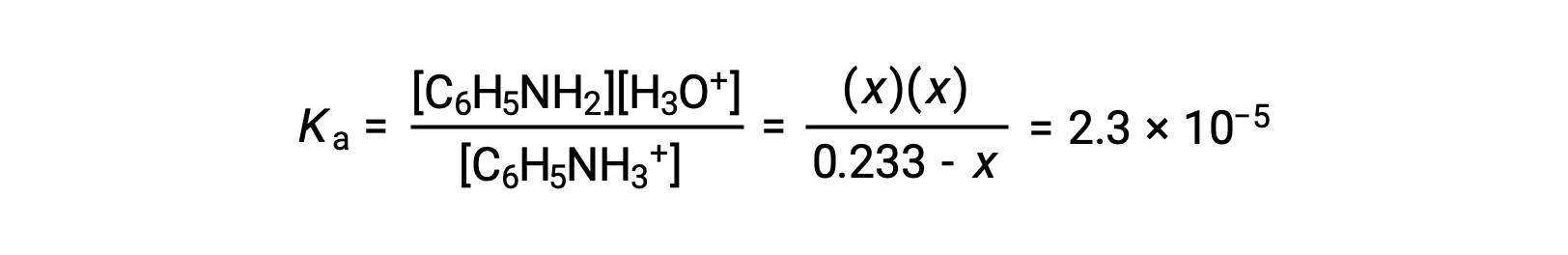
Предположим, что x << 0.233, уравнение упрощено и решено для x:
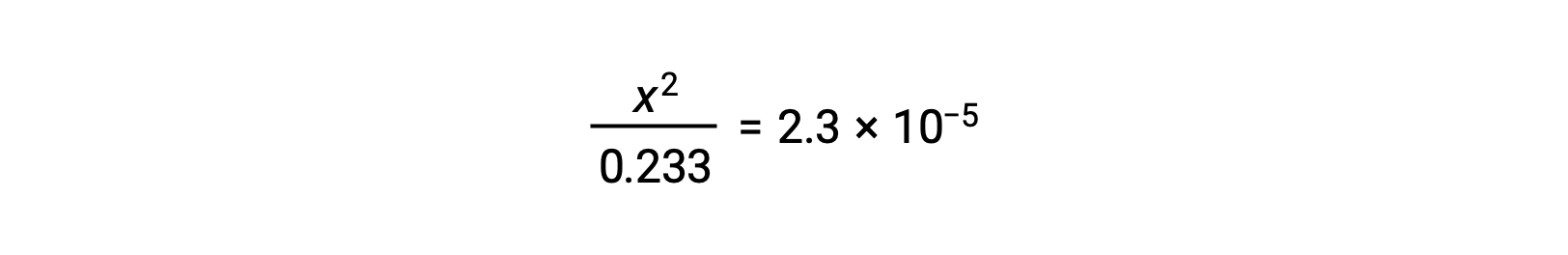

В таблице ЛЬДА x определяется как молярность ионов гидрония, поэтому pH вычисляется как
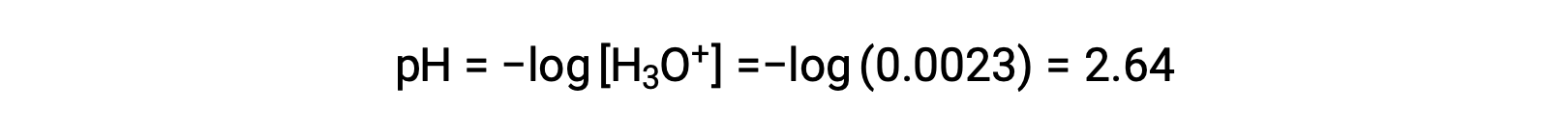
Гидролиз [Al(H2O)6]3+
Рассчитайте pH 0.10 M раствор хлорида алюминия, который полностью растворяется, чтобы дать гидрированный алюминиевый ион [Al(H2O)6]3+ в раствор.
Уравнение для реакции и Ка:
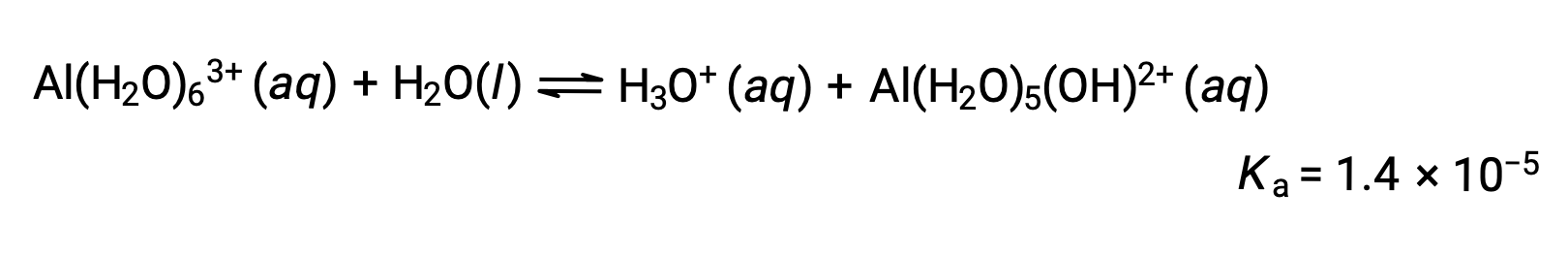
Таблица ICE с предоставленной информацией составляет
| Al(H2O)63+ (Aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (Aq) | |
| Начальная концентрация (M) | 0.10 | ~0 | 0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.10 – x. | x | x |
Подстановка выражения для равновесных концентраций в уравнение для константы ионизации дает:
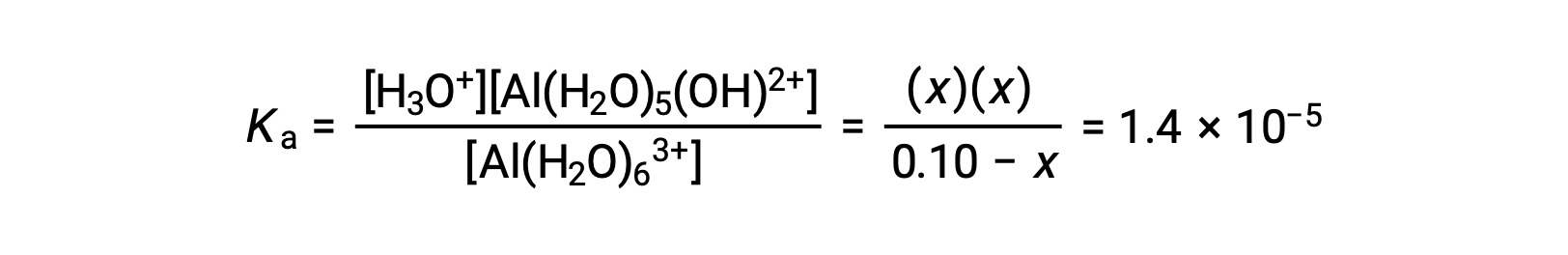
Предполагая x << 0.10 и решая упрощенное уравнение, можно:
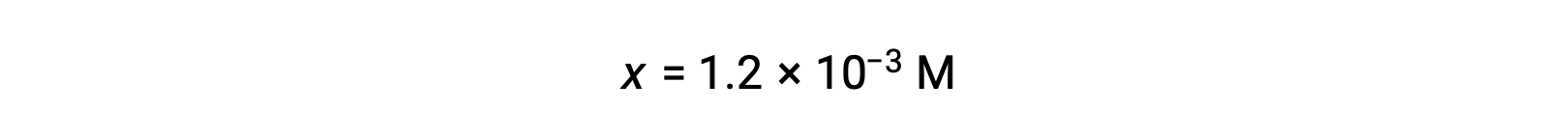
Таблица ЛЬДА, определенная x как равная концентрации ионов гидрония, и таким образом, значение pH рассчитывается как 2.92, а раствор является кислотным.
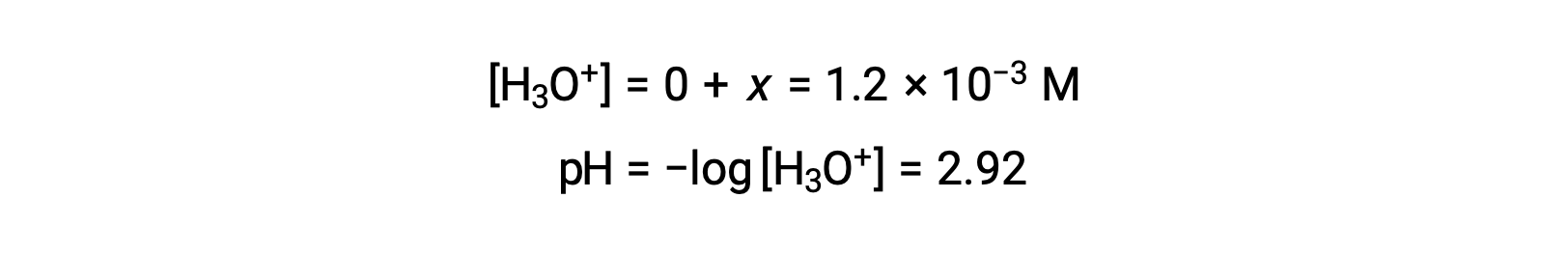
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 14.4: Гидролиз солей.
