16.5:
Eficácia dos Tampões
16.5:
Eficácia dos Tampões
As soluções tampão não têm uma capacidade ilimitada para manter o pH relativamente constante. Em vez disso, a capacidade de uma solução tampão para resistir às alterações do pH depende da presença de quantidades apreciáveis do seu par conjugado de ácido-base fraco. Quando é adicionado um ácido ou base suficientemente forte para reduzir substancialmente a concentração de qualquer um dos membros do par do tampão, a ação de tamponamento dentro da solução é comprometida.
A capacidade do tampão é a quantidade de ácido ou base que pode ser adicionada a um determinado volume de uma solução tampão antes de o pH mudar significativamente, normalmente por uma unidade. A capacidade do tampão depende das quantidades de ácido fraco e da sua base conjugada que se encontram em uma mistura tampão. Por exemplo, 1 L de uma solução com 1,0 M de ácido acético e 1,0 M de acetato de sódio tem maior capacidade de tampão do que 1 L de uma solução que com 0,10 M de ácido acético e 0,10 M de acetato de sódio, apesar de ambas as soluções terem o mesmo pH. A primeira solução tem mais capacidade de tampão porque contém mais ácido acético e ião acetato.
Selecção de Misturas Tampão Adequadas
Existem duas regras úteis para a selecção de misturas tampão:
- Uma boa mistura tampão deve ter cerca de concentrações iguais de ambos os seus componentes. Uma solução tampão geralmente perde a sua utilidade quando um componente do par do tampãp é menos cerca de 10% do outro.
- Ácidos fracos e os seus sais são melhores como tampões para pHs inferiores a 7; bases fracas e os seus sais são melhores como tampões para pHs superiores a 7.
O sangue é um exemplo importante de uma solução tampão, sendo o ácido e o ião principais responsáveis pela ação de tamponamento o ácido carbónico, H2CO3, e o ião bicarbonato, HCO3−. Quando um ião hidrónio é introduzido na corrente sanguínea, é removido primariamente pela reação:

Um ião hidróxido adicionado é removido pela reação:
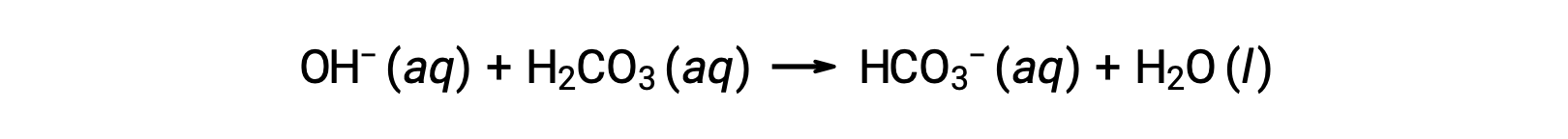
O ácido ou a base forte adicionado é, portanto, efetivamente convertido para o ácido ou base muito mais fraco do par do tampão (H3O+ é convertido em H2CO3 e OH− é convertido em HCO3−). Assim, o pH do sangue humano permanece muito próximo do valor determinado pelos pares do tampão pKa, neste caso, 7,35. As variações normais do pH do sangue são geralmente menos de 0,1, e alterações do pH de 0,4 ou mais são provavelmente fatais.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.6: Buffers.
