16.5: 缓冲液效力
缓冲溶液没有无限容量来保持 pH 相对恒定。 相反,缓冲溶液抵御 pH 值变化的能力取决于其共轭弱 酸-碱 对是否存在明显数量。 如果添加了足够多的强酸或碱以大幅降低缓冲液对中任意一个成员的浓度,则溶液中的缓冲操作将受到影响。
缓冲液容量是酸或碱的数量,可以在 pH 值显著变化 (通常为一个单位) 之前添加到体积的给定缓冲溶液中。 缓冲液容量取决于弱酸混合物中的共轭碱及其缓冲液的数量。 例如, 1 L 的乙酸溶液为 1.0 M ,乙酸钠为 1.0 M ,缓冲液容量大于 1 L 的溶液 (乙酸为 0.10 M ,乙酸钠为 0.10 M) ,即使两个溶液的 pH 值相同。 第一个溶液的缓冲液容量更大,因为它含有更多的乙酸和醋酸离子。
选择合适的缓冲液混合物
选择缓冲液混合物有两个有用的经验法则:
- 良好的缓冲液混合物的两个成分的浓度应该相等。 当缓冲液对的一个组件是小于,而另一个组件的大约 10% 时,缓冲溶液通常就失去了它的作用。
- pH值小于7的弱酸及其盐类是更好的缓冲剂; pH值大于7的弱酸及其盐类是更好的缓冲剂;
血液是缓冲溶液的一个重要示例,主要酸和离子负责缓冲作用,即碳水化合物酸, H2CO3 和碳酸氢化物离子 HCO3−。 当向血流引入水合氢离子时,主要通过以下反应将其删除:

通过以下反应去除添加的氢氧化物离子:
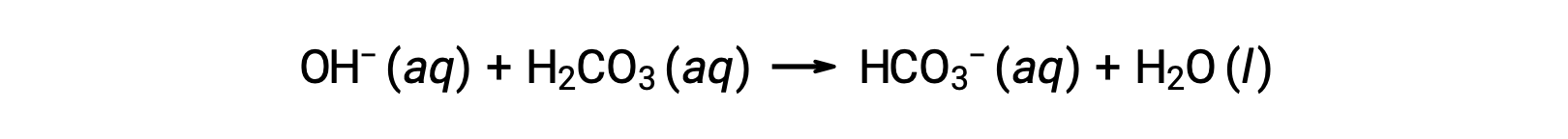
因此,添加的强酸或碱被有效地转换为缓冲液对中的弱得多的酸或碱 (H3O+ 被转换为 H2CO3, OH− 被转换为 HCO3−)。 因此,人类血液的 pH 值仍然非常接近缓冲液 pKa 对确定的值,本例为 7.35。 血液 pH 值的正常变化通常为小于 0.1 , pH 值变化 0.4 或更高可能会致命。
本文改编自 Openstax, 化学 2e, 第14.6节:缓冲液。


