16.5:
Эффективность буфера
16.5:
Эффективность буфера
Буферные растворы не имеют неограниченной емкости для поддержания уровня pH относительно постоянным . Вместо этого способность буферного раствор противостоять изменениям pH зависит от наличия заметных количеств его сопряженной слабой кислотно-основная пары. При добавлении достаточного количества сильной кислоты или основание для существенного снижения концентрации любого из членов буферной пары буферная операция в буферной системе раствор будет нарушена.
Буферная емкость – это количество кислоты или основание, которое можно добавить в заданный объем буферного раствор до значительного изменения pH, обычно за одну единицу. Буферная емкость зависит от количества слабой кислоты и ее конъюгатной основание, которые находятся в буферной смеси. Например, 1 л раствор, который составляет 1.0 м в уксусной кислоте и 1.0 м в ацетате натрия, имеет большую буферную емкость, чем 1 л раствор, что составляет 0.10 м в уксусной кислоте и 0.10 м в ацетате натрия, хотя оба раствора имеют одинаковый pH. Первый раствор обладает большей буферной емкостью, поскольку содержит больше уксусной кислоты и ацетатного иона.
Выбор подходящих буферных смесей
Существует два полезных правила выбора буферных смесей:
- Хорошая буферная смесь должна иметь примерно одинаковую концентрацию обоих компонентов. Буфер раствор обычно утратил свою полезность, когда один компонент пары буфера составляет менее 10% от другого.
- Слабые кислоты и их соли лучше буферов для ПГс меньше 7; слабые основания и их соли лучше буферов для ПГс больше 7.
Кровь является важным примером буферизованного раствор, основной кислотой и ионом, ответственным за буферизацию, является углекислая кислота, H2CO3 и бикарбонат ион, HCO3–. При поступлении в кровоток ионов гидрония он удаляется в первую очередь в результате реакции:

Добавленный гидроксид ион удаляется в результате реакции:
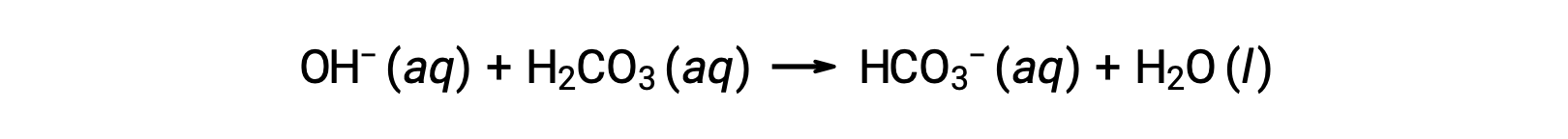
Таким образом, добавленная сильная кислота или основание эффективно преобразуется в гораздо более слабую кислоту или основание буферной пары (H3O+ преобразуется в H2CO3 и OH– преобразуется в HCO3–). Таким образом, pH человеческой крови остается очень близким к значению, определяемой буферными парами pKa, в данном случае, 7.35. Нормальные изменения pH крови обычно меньше 0.1, и изменения pH 0.4 или больше, вероятно, будут фатальными.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.6: Буферы.
