16.5:
Efficacité d'un tampon
16.5:
Efficacité d'un tampon
Les solutions tampons n’ont pas le pouvoir illimité de maintenir un pH relativement constant. Au lieu de cela, la capacité d’une solution tampon à résister aux changements de pH dépend de la présence de quantités notables de son couple conjugué acide-base faible. Lorsqu’une quantité suffisante d’acide fort ou de base forte est ajoutée pour réduire considérablement la concentration de l’un ou l’autre des membres du couple tampon, l’action du tampon dans la solution est compromise.
Le pouvoir tampon est la quantité d’acide ou de base qui peut être ajoutée à un volume donné d’une solution tampon avant que le pH ne change de façon significative, généralement d’une unité. Le pouvoir tampon dépend des quantités d’acide faible et de sa base conjuguée qui se trouvent dans un mélange tampon. Par exemple, 1 L d’une solution qui est de 1,0 M d’acide acétique et de 1,0 M d’acétate de sodium a une capacité tampon supérieure à 1 L d’une solution qui est de 0,10 M d’acide acétique et de 0,10 M d’acétate de sodium même si les deux solutions ont le même pH. La première solution a un pouvoir tampon plus important car elle contient plus d’acide acétique et d’ions acétate.
Sélection de mélanges tampons appropriés
Il existe deux règles de base utiles pour sélectionner les mélanges tampons :
- Un bon mélange tampon devrait avoir des concentrations à peu près égales de ses deux constituants. Une solution tampon a généralement perdu son utilité lorsqu’un constituant du couple tampon est inférieur à environ 10 % de l’autre.
- Les acides faibles et leurs sels sont mieux comme tampons pour les pH inférieurs à 7 ; les bases faibles et leurs sels sont mieux comme tampons pour les pH supérieurs à 7.
Le sang est un exemple important de solution tamponnée, l’acide et l’ion qui sont les principaux responsables de l’action tampon étant l’acide carbonique, H2CO3, et l’ion bicarbonate, HCO3−. Lorsqu’un ion hydronium est introduit dans la circulation sanguine, il est éliminé principalement par la réaction :

Un ion hydroxyde ajouté est éliminé par la réaction :
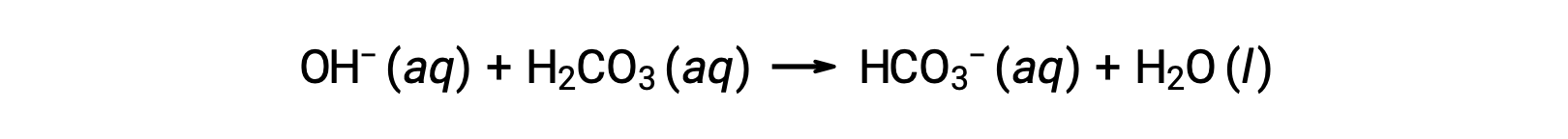
L’acide fort ou la base forte ajoutée est ainsi converti en acide ou en base beaucoup plus faible que le couple tampon (H3O+ est converti en H2CO3 et OH− est converti en HCO3−). Le pH du sang humain reste donc très proche de la valeur déterminée par les pKa des couples tampons, dans ce cas, 7,35. Les variations normales du pH sanguin sont généralement inférieures à 0,1 et les variations du pH de 0,4 ou plus sont susceptibles d’être fatales.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.6 : Tampons.
