16.5:
Efectividad de un Amortiguador
16.5:
Efectividad de un Amortiguador
Las soluciones tampón no tienen una capacidad ilimitada para mantener el pH relativamente constante. En su lugar, la capacidad de una solución tampón para resistir cambios en el pH depende de la presencia de cantidades apreciables de su par conjugado ácido-base débil. Cuando se añade suficiente ácido o base fuerte para reducir sustancialmente la concentración de cualquiera de los miembros del par de amotiguadores, la acción amortiguadora dentro de la solución se ve comprometida.
La capacidad amortiguadora es la cantidad de ácido o base que se puede añadir a un volumen determinado de una solución tampón antes de que el pH cambie significativamente, normalmente por una unidad. La capacidad amortiguadora depende de las cantidades de ácido débil y de su base conjugada que se encuentren en una mezcla tampón. Por ejemplo, 1 L de una solución que es 1,0 M en ácido acético y 1,0 M en acetato de sodio tiene una mayor capacidad amortiguadora que 1 L de una solución que es 0,10 M en ácido acético y 0,10 M en acetato de sodio, aunque ambas soluciones tienen el mismo pH. La primera solución tiene más capacidad amortiguadora porque contiene más ácido acético e iones de acetato.
Selección de mezclas de amortiguadores adecuadas
Existen dos reglas generales útiles para seleccionar mezclas de amortiguadores:
- Una buena mezcla de amortiguadores debe tener concentraciones iguales de ambos componentes. Una solución tampón generalmente ha perdido su utilidad cuando un componente del par de tampones es inferior al 10% del otro.
- Los ácidos débiles y sus sales son mejores como tampones en pHs menores de 7; las bases débiles y sus sales son mejores como tampones en pHs mayores de 7.
La sangre es un ejemplo importante de una solución tamponada, siendo el ácido principal y el ion responsables de la acción de tamponamiento el ácido carbónico, H2CO3, y el ion bicarbonato, HCO3−. Cuando se introduce un ión hidronio en el torrente sanguíneo, es eliminado principalmente a traves de la reacción:

La reacción elimina un ion hidróxido añadido:
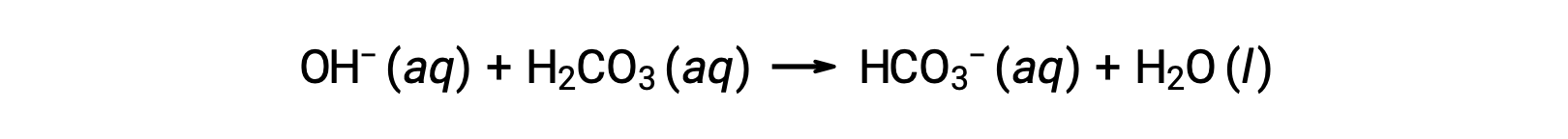
El ácido o la base fuerte añadido se convierten así efectivamente al ácido o base mucho más débil del par de tampones (H3O+ se convierte a H2CO3 y OH− se convierte a HCO3−). Por lo tanto, el pH de la sangre humana permanece muy cerca del valor determinado por el pKa de los pares de tampones, en este caso, 7,35. Las variaciones normales en el pH de la sangre suelen ser inferiores a 0,1, y los cambios de pH de 0,4 o mayores tienen alta probabilidad de ser fatales.
Este texto es adaptado de Openstax, Química 2e, Sección 14.6: Amortiguadores.
