17.7:
温度对自由能的影响
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Effects of Temperature on Free Energy
对于恒温恒压下的自发反应,吉布斯自由能的变化量ΔG 必须小于零。ΔG 的符号取决于 焓、熵和温度的符号和相对值。当反应向环境释放热量时,焓有利于反应的自发过程,而当系统中无序程度较高时,熵有利于反应的自发过程。如果ΔH 为负,ΔS 为正,就像氢氧化钠和盐酸的反应一样,ΔG 在所有温度下都是负的。因此,放热反应-系统熵 增加-总是自发进行的。如果ΔH 和ΔS 均为负,那么,ΔG 将取决于温度。请考虑一下水冻结成冰,这是一个放热反应,系统的熵 减少。当温度低于水的冰点时,水会自发冻结,释放热量,变得更加有序。因此,只有在低温下,焓变和熵变均为负 的反应才是自发进行的。如果 ΔH 和ΔS 均为正值,那么,ΔG 也取决于温度。一个常见例子是化学制冷袋,固态硝酸铵溶解在 水中,吸收周围的热量。由于系统无序程度的增加,这种吸热反应在室温下 自发进行。因此,只有在较高温度下,焓变和熵变均为正 的反应才是自发进行的。如果降低温度,使 TΔS 小于ΔH,则ΔG 为正,反应就会变成非自发过程。当ΔH 为正,ΔS 为负时,ΔG 始终为正,反应 在所有温度下都是非自发过程。
17.7:
温度对自由能的影响
过程的自发性取决于系统的温度。 例如,相变将根据所涉物质的温度自动朝一个或另一个方向前进。 同样,一些化学反应也可能表现出温度相关的自发性。 为了说明这一概念,我们考虑了将自由能更改与过程的焓和熵更改相关的方程:
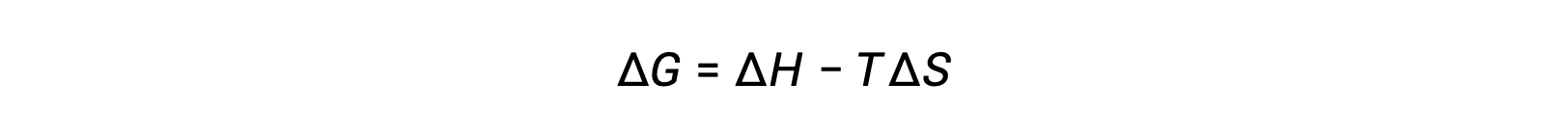
过程的自发性 (如其自由能变化的算术符号所反映) 随后由焓和熵变化的迹象以及在某些情况下绝对温度决定。 由于 T 是绝对 (开氏) 温度,因此它只能有正值。 因此,对于焓和熵变化的迹象,存在四种可能性:
- ΔH 和 ΔS 都是正数。 此条件描述了涉及系统熵增加的吸热过程。 在这种情况下,如果 TΔS 术语的大小为大于 ΔH ,则 n ü ΔG 为负。 如果 TΔS 术语是小于 ΔH ,则自由能的变化将是正数。 这样的过程在高温下是自发的,在低温下是非自发的。
- ΔH Ω 和 ΔS Ω 均为负。 此条件描述了放热过程,它涉及到系统熵的减少。 在这种情况下,如果 TΔS 术语的大小为小于 ΔH ,则 n ü ΔG 为负。 如果 TΔS 术语的大小为大于 ΔH ,则自由能的变化将是正数。 这样的过程在低温下是自发的,在高温下是非自发的。
- ΔH 为正, ΔS 为负。 此条件描述了吸热过程,它涉及到系统熵的减少。 在这种情况下,无论温度如何, ΔG 都将为正值。 这样的过程在所有温度下都是非自发的。
- ΔH 为负, ΔS 为正。 此条件描述了涉及系统熵增加的放热过程。 在这种情况下,无论温度如何, ΔG 都将为负。 这样的过程在所有温度下都是自发的。
