17.7:
Efectos de la Temperatura sobre la Energía Libre
17.7:
Efectos de la Temperatura sobre la Energía Libre
La espontaneidad de un proceso depende de la temperatura del sistema. Las transiciones de fase, por ejemplo, procederán espontáneamente en una dirección u otra dependiendo de la temperatura de la sustancia en cuestión. Asimismo, algunas reacciones químicas también pueden exhibir espontaneidad dependiente de la temperatura. Para ilustrar este concepto, se considera la ecuación que relaciona el cambio de energía libre con los cambios de entalpía y entropía para el proceso:
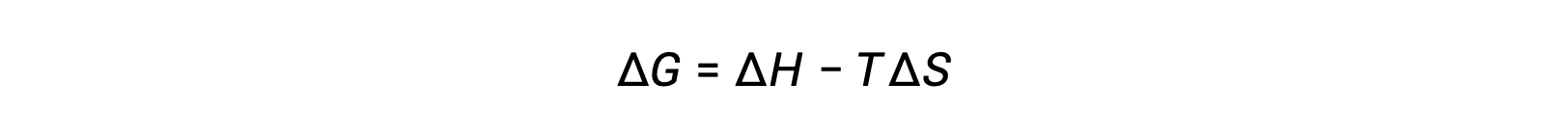
La espontaneidad de un proceso, como se refleja en el signo aritmético de su cambio de energía libre, es entonces determinada por los signos de los cambios de entalpía y entropía y, en algunos casos, la temperatura absoluta. Puesto que T es la temperatura absoluta (kelvin), sólo puede tener valores positivos. Por lo tanto, existen cuatro posibilidades con respecto a los signos de los cambios de entalpía y entropía:
- Tanto ΔH como ΔS son positivos. Esta condición describe un proceso endotérmico que implica un aumento en la entropía del sistema. En este caso, ΔG será negativo si la magnitud del término TΔS es mayor que ΔH. Si el término TΔS es menor que ΔH, el cambio de energía libre será positivo. Este proceso es espontáneo a altas temperaturas y no espontáneo a bajas temperaturas.
- Tanto ΔH como ΔS son negativos.Esta condición describe un proceso exotérmico que implica una disminución en la entropía del sistema. En este caso, ΔG será negativo si la magnitud del término TΔS es inferior a ΔH. Si la magnitud del término TΔS es mayor que ΔH, el cambio de energía libre será positivo. Este proceso es espontáneo a bajas temperaturas y no espontáneo a altas temperaturas.
- ΔH es positivo y ΔS es negativo. Esta condición describe un proceso endotérmico que implica una disminución en la entropía del sistema. En este caso, ΔG será positivo independientemente de la temperatura. Tal proceso es no espontáneo a todas las temperaturas.
- ΔH es negativo y ΔS es positivo. Esta condición describe un proceso exotérmico que implica un aumento en la entropía del sistema. En este caso, ΔG será negativo independientemente de la temperatura. Tal proceso es espontáneo a todas las temperaturas.
Este texto es adaptado de Openstax, Química 2e, Sección 16,4: Energía Libre.
