17.7:
Влияние температуры на свободную энергию
17.7:
Влияние температуры на свободную энергию
Спонтанность процесса зависит от температуры системы. Фазовые переходы, например, будут действовать спонтанно в одном или другом направлении в зависимости от температуры данного вещества. Кроме того, некоторые химические реакции могут также проявлять зависящую от температуры спонтанность. Для иллюстрации этой концепции рассматривается уравнение, связывание свободного изменения энергии с изменениями энтальпии и энтропии процесса:
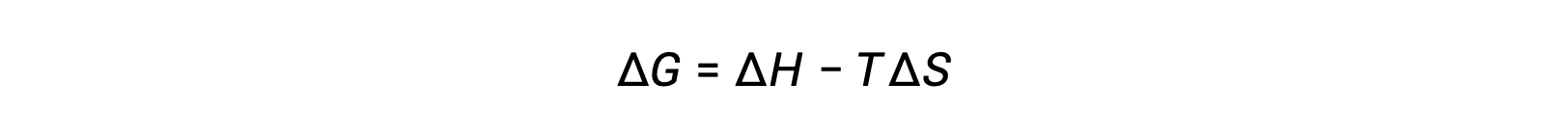
Спонтанность процесса, отраженная в арифметическом знаке его свободного изменения энергии, затем определяется признаками изменений энтальпии и энтропии и, в некоторых случаях, абсолютной температуры. Поскольку T является абсолютной (кельвин) температурой, она может иметь только положительные значения. Таким образом, существуют четыре возможности в отношении признаков энтальпии и изменений энтропии:
- И ΔH, и ΔS являются положительными. Это условие описывает эндотермический процесс, который включает увеличение энтропии системы. В этом случае ΔG будет отрицательным, если величина термина TΔS больше ΔH. Если значение TΔS меньше ΔH, то изменение свободной энергии будет положительным. Такой процесс является спонтанным при высоких температурах и не спонтанным при низких температурах.
- И ΔH, и ΔS отрицательны. Это условие описывает экзотермический процесс, который включает в себя снижение энтропии системы. В этом случае ΔG будет отрицательным, если величина термина TΔS меньше ΔH. Если величина термина TΔS больше ΔH, то изменение свободной энергии будет положительным. Такой процесс является спонтанным при низких температурах и не спонтанным при высоких температурах.
- ΔH положительный, а ΔS отрицательный. Это условие описывает эндотермический процесс, который включает в себя снижение энтропии системы. В этом случае ΔG будет положительным независимо от температуры. Такой процесс не является спонтанным при любой температуре.
- ΔH отрицательный, а ΔS положительный. Это условие описывает экзотермический процесс, который включает увеличение энтропии системы. В этом случае ΔG будет отрицательным независимо от температуры. Такой процесс является спонтанным при любой температуре.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 16.4: Free Energy.
