17.7:
온도가 자유에너지에 미치는 영향
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Effects of Temperature on Free Energy
반응이 일정한 온도와 압력에서 자발적이려면 깁스 자유 에너지의 변화 델타G는 0보다 작아야 합니다. ΔG의 부호는 엔탈피와 엔트로피 및 온도의 부호와 상대 값에 따라 달라집니다. 엔탈피는 반응이 주변으로 열을 방출할 때 자발성을 가지며 엔트로피는 계가 더 무질서할 때 자발성을 가집니다.수산화나트륨과 염산의 반응에서 볼 수 있는것처럼 델타H가 음수이고 델타S가 양수이면 델타G는 모든 온도에서 음수입니다. 따라서 계의 엔트로피가 증가하는 발열 반응은 항상 자발적입니다. 델타H 및 델타S가 모두 음수인 경우 델타G는 온도에 따라 달라집니다.물의 얼음으로 되는 과정을 생각해보세요. 계의 엔트로피가 감소하는 발열 반응입니다. 물은 빙점 이하의 온도에서는 자발적으로 얼면서 열을 방출하고 더 질서있게 배열됩니다.따라서 음의 엔탈피와 엔트로피 변화에 대한 반응은 낮은 온도에서만 자발적입니다. 델타H와 델타S가 모두 양수인 경우 델타G는 온도에 따라서도 달라집니다. 일반적인 예는 고체 질산암모늄이 물에 용해되면서 주변에서 열을 흡수하는 화학 얼음 찜질팩을 들 수 있습니다.이 흡열 반응은 계의 무질서의 증가로 인해 실온에서 자발적으로 진행됩니다. 따라서 양의 엔탈피와 엔트로피 변화에 대한 반응은 높은 온도에서만 자발적으로 발생합니다. T델타S가 델타H보다 작아지도록 온도를 낮춘 경우 ΩG는 양수이며 반응은 자발적일 것입니다.델타H가 양수이고 델타S가 음수일 때 델타G는 항상 양수이며 반응은 모든 온도에서 자발적이지 않습니다.
17.7:
온도가 자유에너지에 미치는 영향
공정의 자발성은 시스템의 온도에 따라 달라집니다. 예를 들어, 위상 전이는 문제의 물질의 온도에 따라 한 방향으로 또는 다른 방향으로 자발적으로 진행됩니다. 마찬가지로, 일부 화학 반응은 또한 온도 의존자성을 나타낼 수 있습니다. 이 개념을 설명하기 위해 프로세스의 엔탈피 및 엔트로피 변경에 대한 자유 에너지 변화와 관련된 방정식이 고려됩니다.
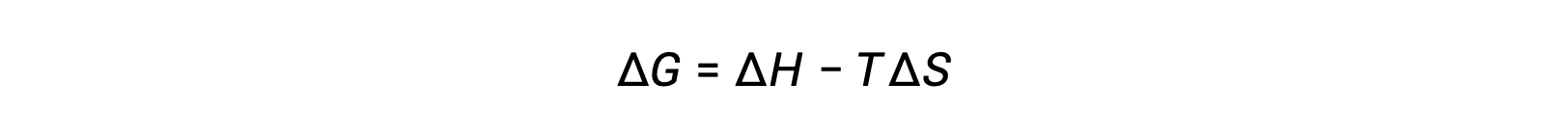
자유 에너지 변화의 산술 표시에 반영된 프로세스의 자발성은, 그 때 엔탈피및 엔트로피 변경의 표시및, 어떤 경우에는 절대 온도에 의해 결정됩니다. T는 절대(켈빈) 온도이므로 양수 값만 가질 수 있습니다. 따라서 엔탈피 및 엔트로피 변화의 징후와 관련하여 네 가지 가능성이 존재합니다.
- ΔH와 ΔS 모두 양수입니다. 이 조건은 시스템 엔트로피의 증가를 포함하는 빈체 프로세스를 기술합니다. 이 경우, ΔG는 TΔS 용어의 크기가 ΔH보다크면 음수가 됩니다. TΔS 용어가 ΔH보다적으면 자유 에너지 변화가 긍정적일 것입니다. 이러한 과정은 고온에서 자발적이며 저온에서 비자발적입니다.
- ΔH와 ΔS 는 모두 음수입니다. 이 조건은 시스템 엔트로피의 감소를 포함하는 exothermic 프로세스를 기술합니다. 이 경우, ΔG는 TΔS 용어의 크기가 ΔH보다적으면 음수가 됩니다. TΔS 용어의 크기가 ΔH보다크면 자유 에너지 변화가 긍정적일 것입니다. 이러한 과정은 낮은 온도에서 자발적이며 고온에서 비자발적입니다.
- ΔH는 양수이며 ΔS는 음수입니다. 이 조건은 시스템 엔트로피의 감소를 포함하는 엔더피프로세스를 기술합니다. 이 경우 ΔG는 온도에 관계없이 양수입니다. 이러한 과정은 모든 온도에서 비자발적입니다.
- ΔH는 음수이고 ΔS는 양수입니다. 이 조건은 시스템 엔트로피의 증가를 포함하는 exothermic 프로세스를 기술합니다. 이 경우 ΔG는 온도에 관계없이 음수가 됩니다. 이러한 과정은 모든 온도에서 자발적입니다.
