18.9:
腐蚀
18.9:
腐蚀
自然电化学过程导致金属降解称为腐蚀。 铁锈形成,银渍蚀以及铜上出现的蓝绿色专利就是腐蚀的例子。 腐蚀涉及金属氧化。 有时它是保护性的,例如铜或铝的氧化,其中金属氧化物或其衍生物的保护层形成在表面,从而保护底层金属不会进一步氧化。 在其他情况下,腐蚀会损坏金属,例如生锈铁。
不良氧化还原反应:铁锈
由于铁暴露在氧气和水中,生锈。 铁锈形成包括在铁表面形成原电池(伽凡尼电池),从而产生铁 (II)。 在铁表面上形成的厌氧 (铁氧化) 和阴极 (氧减少) 区域发生的相关氧化还原反应包括:
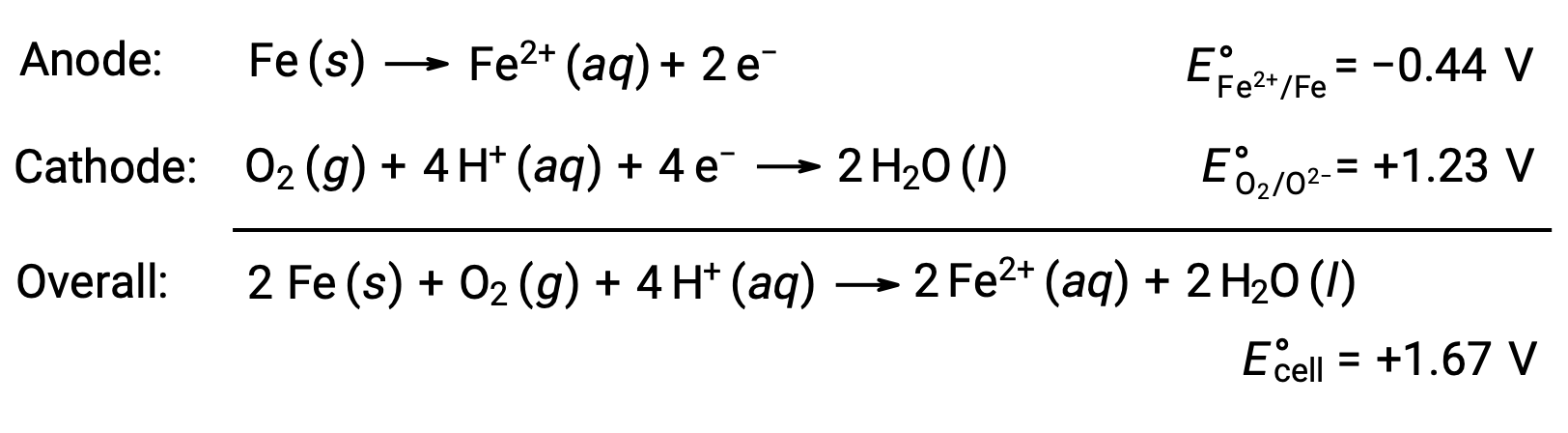
铁 (II) 进一步与潮湿空气发生反应,形成一种铁 (III) 氧化水合物,通常称为锈。
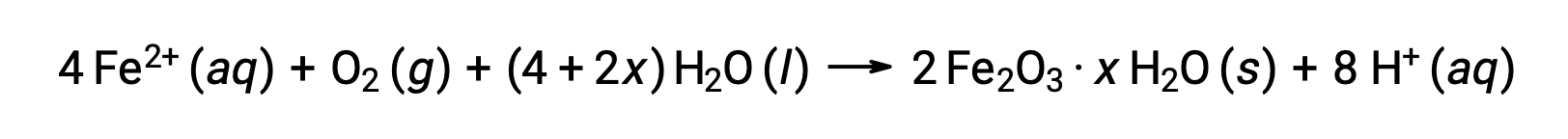
水合物的化学物质化学计量因铁 (II) 暴露的水的数量而异,化合物公式中使用 x 表示。 潮湿,酸和电解质的存在会增加生锈形成的率值。 与铜上的铁杆不同,铁锈的形成不会形成保护层,因此随着铁锈的脱落,新鲜铁暴露在大气中,铁的腐蚀将继续存在。
防腐蚀
可以使用各种方法来防止腐蚀。 一种方法是保持金属表面的油漆,以避免与水和氧气接触。 金属合金,如将铁与少量铬混合在不锈钢中,是防止腐蚀的另一种有效方法。 铬在表面附近聚集,并被氧化,从而有效地保护铁不受腐蚀。
铁和其他金属也可以通过电镀来防止腐蚀,在过程中,要保护的金属涂有一层更容易氧化的金属,通常是锌。 当锌层完好无损时,它可以防止空气接触底层铁,从而防止腐蚀。 如果锌层被腐蚀或机械磨损破坏,则仍可通过阴极保护过程来保护熨斗免受腐蚀,下一段对此进行了描述。
阴极保护利用将要保护的金属转换为电化学反应中的阴极的原理。 通过将受保护金属连接到更有效或更容易氧化的金属 (如锌或镁) (称为牺牲阳极) 来实现这一点。 阳极腐蚀并被用于保护作为阴极的金属。 阴极保护最常用于家用电器,如热水器和地下储水箱。 重要的是,阴极保护可用于除铁以外的金属。
本文改编自 OpenStax, 化学 2e, 第 17.6 章:腐蚀。
