18.9:
Korozyon
18.9:
Korozyon
Doğal elektrokimyasal işlemlere bağlı metallerin bozulması korozyon olarak bilinir. Demir üzerinde pas oluşumu, gümüşün kararması ve bakır üzerinde gelişen mavi-yeşil patina korozyon örnekleridir. Korozyon, metallerin oksidasyonunu içerir. Bazen bakır veya alüminyumun oksidasyonu gibi koruyucudur, burada yüzeyde koruyucu bir metal oksit tabakası veya türevleri oluşur ve altta yatan metali daha fazla oksidasyondan korur. Diğer durumlarda, korozyon, demirin paslanması gibi metale zarar verir.
İstenmeyen Redoks Reaksiyonu: Demirin Paslanması
Paslanma, demirin oksijene ve suya maruz kalması nedeniyle oluşur. Pas oluşumu, demir yüzeyinde bir galvanik hücrenin oluşturulmasını içerir ve bu da demir(II) oluşumuna neden olur. Demir yüzeyinde oluşan anodik (demirin oksidasyonu) ve katodik (oksijenin azaltılması) bölgelerde meydana gelen ilgili redoks reaksiyonları şunları içerir:
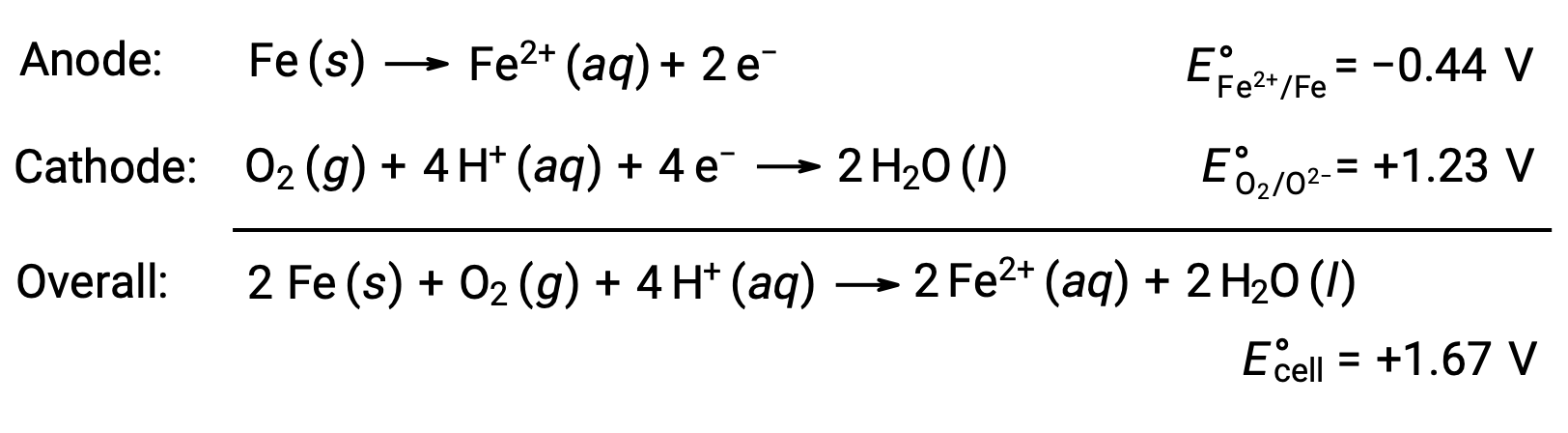
Demir(II) ayrıca nemli hava ile reaksiyona girerek, yaygın olarak pas olarak bilinen bir demir (III) oksit hidrat oluşturur.
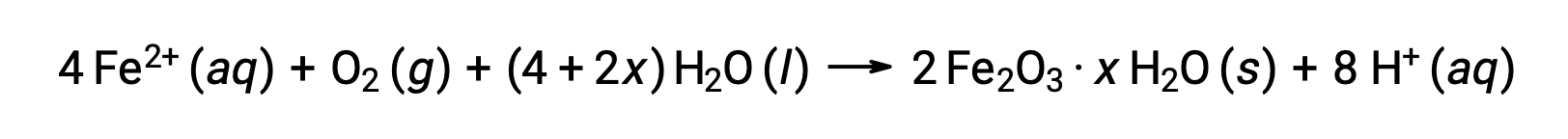
Hidratın stokiyometrisi, bileşik formülde x kullanımı ile belirtildiği gibi, demirin(II) maruz kaldığı su miktarına göre değişir. Nem, asitlerin ve elektrolitlerin varlığı pas oluşum hızını arttırır. Bakır üzerindeki patinadan farklı olarak, pas oluşumu koruyucu bir tabaka oluşturmaz ve bu nedenle pas pul pul dökülürken demirin korozyonu devam eder ve taze demiri atmosfere maruz bırakır.
Korozyonun Önlenmesi
Korozyonu önlemek için çeşitli yöntemler kullanılabilir. Bir yol, su ve oksijen ile temastan kaçınmak için metal yüzeyi boyalı tutmaktır. Metallerin alaşımlanması, demirin paslanmaz çelikte az miktarda krom ile karıştırılması gibi, korozyonu önlemek için etkili bir yöntemdir. Krom yüzeye yakın toplanır ve oksidasyona uğrar, böylece demiri korozyondan etkili bir şekilde korur.
Demir ve diğer metaller de, korunacak metalin daha kolay oksitlenmiş bir metal, genellikle çinko tabakası ile kaplandığı bir işlem olan galvanizleme ile korozyondan korunabilir. Çinko tabakası sağlam olduğunda, havanın alttaki demirle temas etmesini önler ve böylece korozyonu önler. Çinko tabakası korozyon veya mekanik aşınma ile bozulursa, demir yine de bir sonraki paragrafta açıklanan bir katodik koruma işlemiyle korozyondan korunabilir.
Katodik koruma, elektrokimyasal reaksiyonda korunacak metali bir katoda dönüştürme prensibini kullanır. Bu, korunan metali, kurban anot olarak bilinen çinko veya magnezyum gibi daha aktif veya kolayca oksitlenmiş bir metale bağlayarak elde edilir. Anot korozyona uğrar ve katot olarak hizmet eden metali korumak için kullanılır. Katodik koruma en çok su ısıtıcıları ve yeraltı su depolama tankları gibi ev aletlerinde kullanılır. Önemli olarak, katodik koruma sadece demir dışındaki metaller için kullanılabilir.
Bu metin bu kaynaktan uyarlanmıştır: OpenStax, Chemistry 2e, Chapter 17.6: Corrosion.
