18.9:
التآكل
18.9:
التآكل
يُعرف تحلل المعادن بسبب العمليات الكهروكيميائية الطبيعية بالتآكل. يعتبر تكوين الصدأ على الحديد، وتشويه الفضة، والزنجار الأزرق والأخضر الذي يتطور على النحاس أمثلة على التآكل. يشمل التآكل أكسدة المعادن. أحياناً إنه وقائي، مثل أكسدة النحاس أو الألومنيوم، حيث تتشكل طبقة واقية من أكسيد المعدن أو مشتقاته على السطح، مما يحمي المعدن الأساسي من المزيد من الأكسدة. وفي حالات أخرى، يؤدي التآكل إلى إتلاف المعدن، مثل صدأ الحديد.
تفاعل الأكسدة والاختزال غير المرغوب فيه: صدأ الحديد
يحدث الصدأ بسبب تعرض الحديد للأكسجين والماء. ينطوي تكوين الصدأ على تكوين خلية جلفانية على سطح الحديد، مما ينتج عنه توليد الحديد (II). تتضمن تفاعلات الأكسدة والاختزال ذات الصلة التي تحدث في مناطق أنودية (أكسدة الحديد) والكاثودية (اختزال الأكسجين) المتكونة على سطح الحديد ما يلي:
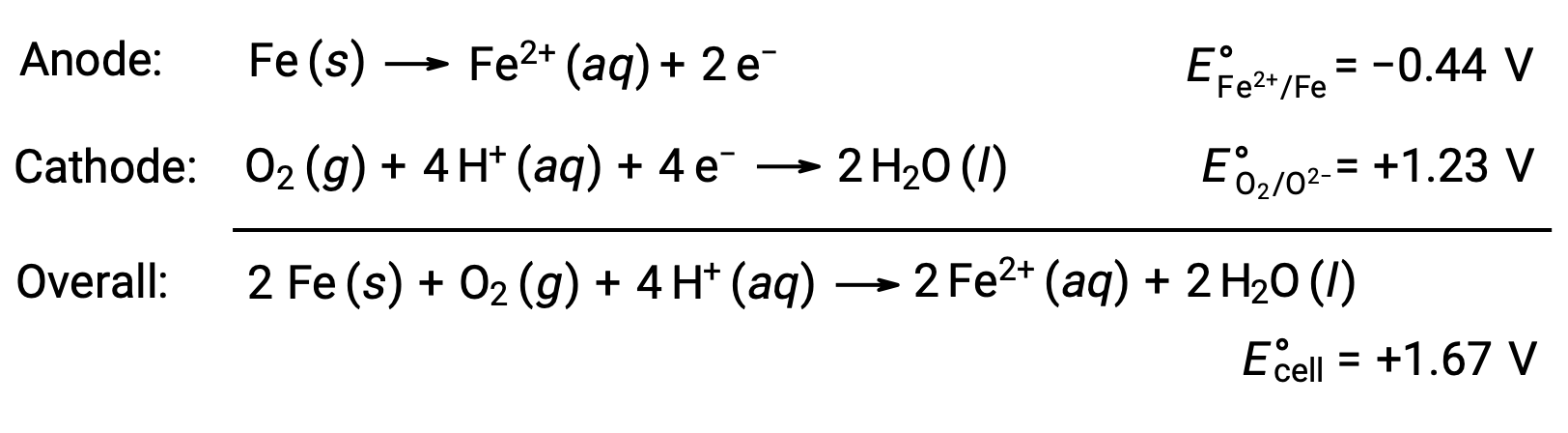
يتفاعل الحديد (II) بشكل أكبر مع الهواء الرطب، مكونًا هيدرات أكسيد الحديد (III) ، المعروف باسم الصدأ.
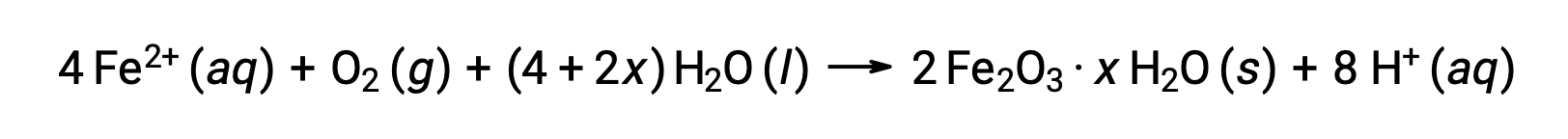
يختلف القياس المتكافئ للهيدرات' باختلاف كمية الماء التي يتعرض لها الحديد (II)، كما يتضح من استخدام x في الصيغة المركبة. الرطوبة ووجود الأحماض والإلكتروليتات تزيد من معدل تكون الصدأ. على عكس الزنجار على النحاس، لا يؤدي تكوين الصدأ إلى تكوين طبقة واقية، وبالتالي يستمر تآكل الحديد حيث يتقشر الصدأ وتتعرض طبقات الحديد الحديث لتأثير لجو.
منع التآكل
يمكن استخدام طرق مختلفة لمنع التآكل. تتمثل إحدى الطرق في الحفاظ على السطح المعدني مطلياً لتجنب ملامسة الماء والأكسجين. يعتبر خلط المعادن، مثل خلط الحديد بكميات صغيرة من الكروم في الفولاذ المقاوم للصدأ، طريقة فعالة أخرى لمنع التآكل. يتجمع الكروم بالقرب من السطح ويتأكسد، وبالتالي يحمي الحديد بشكل فعال من التآكل.
يمكن أيضاً حماية الحديد والمعادن الأخرى من التآكل عن طريق الجلفنة، وهي عملية يتم فيها طلاء المعدن المراد حمايته بطبقة من معدن أكثر سهولة في التأكسد، وعادة ما يكون الزنك. عندما تكون طبقة الزنك سليمة، فإنها تمنع الهواء من الاتصال بالحديد الأساسي وبالتالي تمنع التآكل. إذا تم اختراق طبقة الزنك عن طريق التآكل أو التآكل الميكانيكي، فقد يظل الحديد محمياً من التآكل بواسطة عملية الحماية الكاثودية، الموضحة في الفقرة التالية.
تستخدم الحماية الكاثودية مبدأ تحويل المعدن المراد حمايته إلى كاثود في تفاعل كهروكيميائي. يتم تحقيق ذلك من خلال توصيل المعدن المحمي بمعدن أكثر نشاطاً أو أكسدة بسهولة مثل الزنك أو المغنيسيوم، والمعروف باسم الأنود المضحّى به. يتآكل الأنود ويستهلك لحماية المعدن الذي يعمل ككاثود. تستخدم الحماية الكاثودية بشكل شائع في الأجهزة المنزلية مثل سخانات المياه وخزانات المياه الجوفية. الأهم من ذلك، يمكن استخدام الحماية الكاثودية مع معادن غير الحديد فقط.
هذا النص مقتبس من OpenStax, Chemistry 2e, Chapter 17.6: Corrosion.
