18.9:
Corrosione
18.9:
Corrosione
La degradazione dei metalli dovuta a processi elettrochimici naturali è nota come corrosione. La formazione di ruggine sul ferro, l’appannamento dell’argento e la patina blu-verde che si sviluppa sul rame sono esempi di corrosione. La corrosione comporta l’ossidazione dei metalli. A volte è protettivo, come l’ossidazione di rame o alluminio, in cui uno strato protettivo di ossido di metallo o i suoi derivati si formano sulla superficie, proteggendo il metallo sottostante da un’ulteriore ossidazione. In altri casi, la corrosione è dannosa per il metallo, come la ruggine del ferro.
Reazione redox indesiderabile: la ruggine del ferro
La ruggine si verifica a causa dell’esposizione del ferro all’ossigeno e all’acqua. La formazione di ruggine comporta la creazione di una cella galvanica sulla superficie del ferro, che si traduce nella generazione di ferro(II). Le reazioni redox rilevanti che si verificano nelle regioni anodiche (ossidazione del ferro) e catodice (riduzione dell’ossigeno) formate sulla superficie del ferro includono:
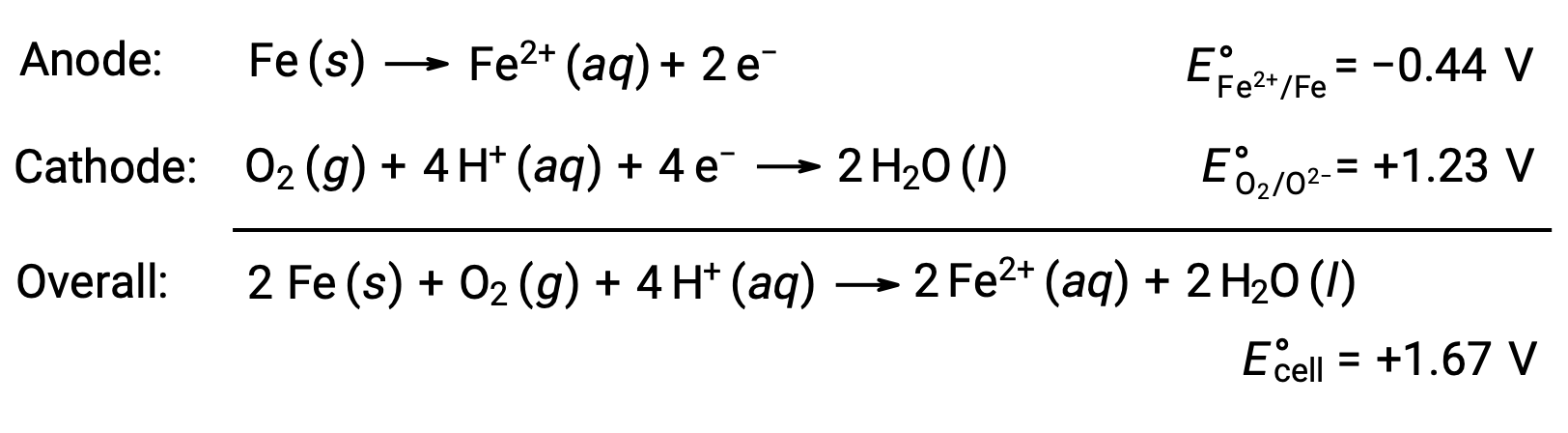
Il ferro(II) reagisce ulteriormente con l’aria umida, formando un idrato di ossido di ferro(III), comunemente noto come ruggine.
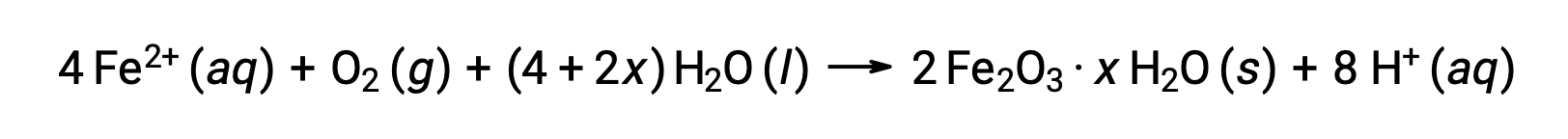
La stechiometria dell’idrato varia con la quantità di acqua a cui è esposto il ferro(II), come indicato dall’uso di x nella formula composta. L’umidità, la presenza di acidi ed elettroliti aumenta il tasso di formazione della ruggine. A differenza della patina sul rame, la formazione di ruggine non crea uno strato protettivo, e quindi la corrosione del ferro continua mentre la ruggine si stacca ed espone ferro fresco all’atmosfera.
Prevenzione della corrosione
Vari metodi possono essere utilizzati per prevenire la corrosione. Un modo è quello di mantenere la superficie metallica verniciata per evitare il contatto con acqua e ossigeno. La legatura dei metalli, come la miscelazione del ferro con piccole quantità di cromo in acciaio inossidabile, è un altro metodo efficace per prevenire la corrosione. Il cromo si raccoglie vicino alla superficie e subisce l’ossidazione, proteggendo così efficacemente il ferro dalla corrosione.
Il ferro e altri metalli possono anche essere protetti dalla corrosione mediante zincatura, un processo in cui il metallo da proteggere è rivestito con uno strato di un metallo più facilmente ossidato, di solito zinco. Quando lo strato di zinco è intatto, impedisce all’aria di contattare il ferro sottostante e quindi previene la corrosione. Se lo strato di zinco viene violato dalla corrosione o dall’abrasione meccanica, il ferro può comunque essere protetto dalla corrosione da un processo di protezione catodica, descritto nel paragrafo successivo.
La protezione catodica utilizza il principio di convertire il metallo da proteggere in un catodo in una reazione elettrochimica. Ciò si ottiene collegando il metallo protetto a un metallo più attivo o facilmente ossidato come lo zinco o il magnesio, noto come anodo sacrificale. L’anodo si corrode e si abitua a proteggere il metallo che funge da catodo. La protezione catodica è più comunemente usata negli elettrodomestici come scaldac acque e serbatoi sotterranei di stoccaggio dell’acqua. È importante sottolineare che la protezione catodica può essere utilizzata per metalli diversi dal solo ferro.
Questo testo è adattato da OpenStax, Chimica 2e, Capitolo 17.6: Corrosione.
