18.9:
La Corrosión
18.9:
La Corrosión
La degradación de metales debida a procesos electroquímicos naturales se conoce como corrosión. La formación de óxido en el hierro, el deslustre de la plata y la pátina verdeazúl que se desarrolla en el cobre son ejemplos de corrosión. La corrosión implica la oxidación de los metales. A veces es protectora, como la oxidación del cobre o el aluminio, en donde una capa protectora de óxido metálico o sus derivados se forma en la superficie, protegiendo el metal subyacente de la oxidación posterior. En otros casos, la corrosión daña el metal, como en la oxidación del hierro.
Reacción redox indeseable: La oxidación del hierro
La oxidación se produce debido a la exposición del hierro al oxígeno y al agua. La formación de óxido implica la creación de una celda galvánica en la superficie del hierro, lo que resulta en la generación de hierro (II). Las reacciones redox relevantes que ocurren en las regiones anódicas (oxidación del hierro) y catódicas (reducción del oxígeno) formadas en la superficie del hierro incluyen:
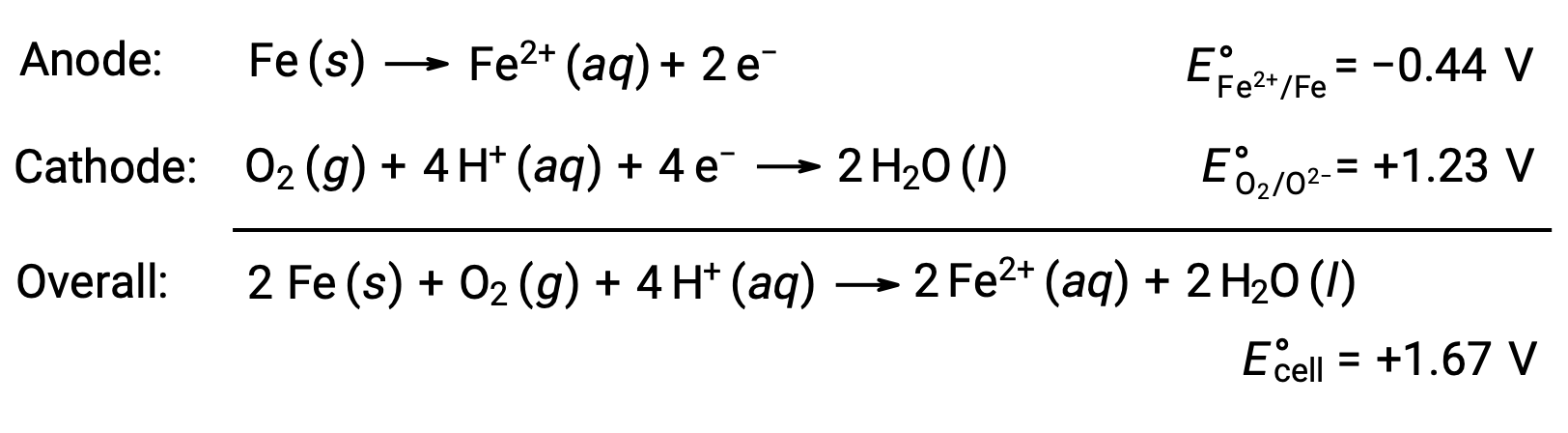
El hierro (II) reacciona más adelante con el aire húmedo, formando un hidrato de óxido de hierro (III), comúnmente conocido como óxido.
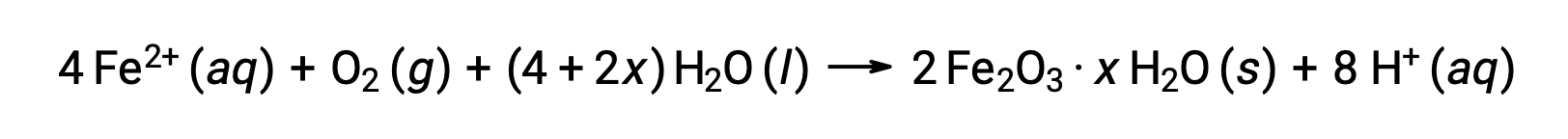
La estequiometría del hidrato varía con la cantidad de agua a la cual el hierro (II) está expuesto, como lo indica el uso de x en la fórmula compuesta. La humedad, la presencia de ácidos y electrolitos aumenta la tasa de formación de óxido. A diferencia de la pátina sobre el cobre, la formación de óxido no crea una capa protectora, por lo que la corrosión del hierro continúa a medida que el óxido se deshace y expone el hierro fresco a la atmósfera.
Prevención de la corrosión
Se pueden utilizar varios métodos para prevenir la corrosión. Una forma es mantener la superficie metálica pintada para evitar el contacto con el agua y el oxígeno. La aleación de metales, como la mezcla de hierro con pequeñas cantidades de cromo en acero inoxidable, es otro método eficaz para prevenir la corrosión. El cromo se acumula cerca de la superficie y es sometido a oxidación, por lo que protege eficazmente el hierro de la corrosión.
El hierro y otros metales también pueden ser protegidos de la corrosión por galvanización, un proceso en el cual el metal a ser protegido está cubierto con una capa de un metal más fácilmente oxidado, generalmente zinc. Cuando la capa de zinc está intacta, evita que el aire entre en contacto con el hierro subyacente y, por tanto, evita la corrosión. Si la capa de zinc se rompe por corrosión o abrasión mecánica, el hierro puede estar protegido de la corrosión por un proceso de protección catódica, que se describe en el siguiente párrafo.
La protección catódica utiliza el principio de convertir el metal que se va a proteger en un cátodo en una reacción electroquímica. Esto se consigue conectando el metal protegido a un metal más activo o fácilmente oxidado, como zinc o magnesio, conocido como ánodo de sacrificio. El ánodo se corroe y se utiliza para proteger el metal que sirve como cátodo. La protección catódica se utiliza más comúnmente en aparatos domésticos como calentadores de agua y tanques subterráneos de almacenamiento de agua. Es importante destacar que la protección catódica se puede utilizar para metales distintos del hierro.
Este texto está adaptado de OpenStax, Química 2e, Capítulo 17.6: Corrosión.
