18.9:
Corrosão
18.9:
Corrosão
A degradação de metais devido a processos eletroquímicos naturais é conhecida como corrosão. A formação de ferrugem no ferro, as manchas em prata, e a pátina azul-verde que se desenvolve sobre cobre são exemplos de corrosão. A corrosão envolve a oxidação de metais. Às vezes é protetora, como a oxidação do cobre ou alumínio, em que uma camada protetora de óxido de metal ou seus derivados se forma à superfície, protegendo o metal subjacente de oxidação adicional. Em outros casos, a corrosão é prejudicial ao metal, como a ferrugem do ferro.
Reação Redox Indesejável: A Ferrugem do Ferro
A ferrugem ocorre devido à exposição do ferro ao oxigénio e à água. A formação de ferrugem envolve a criação de uma célula galvânica na superfície do ferro, o que resulta na geração de ferro(II). As reações redox relevantes que ocorrem nas regiões anódicas (oxidação do ferro) e catódicas (redução do oxigénio) formadas na superfície do ferro incluem:
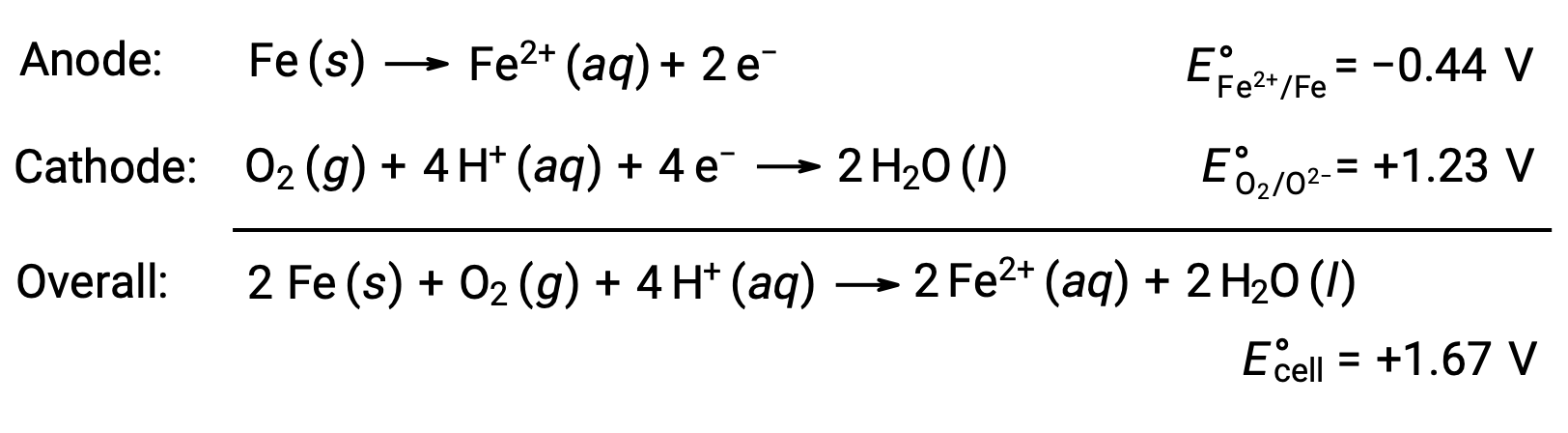
O ferro(II) reage ainda mais com ar húmido, formando um óxido de ferro(III) hidratado, conhecido normalmente como ferrugem.
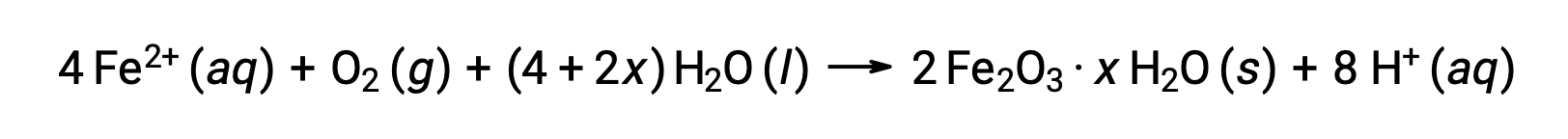
A estequiometria do hidrato varia com a quantidade de água a que o ferro(II) é exposto, conforme indicado pelo uso de x na fórmula do composto. A humidade, a presença de ácidos e eletrólitos aumenta a velocidade de formação de ferrugem. Ao contrário da pátina sobre cobre, a formação de ferrugem não cria uma camada protetora, e assim a corrosão do ferro continua à medida a ferrugem descai e expõe ferro fresco à atmosfera.
Prevenção da Corrosão
Podem ser utilizados vários métodos para evitar a corrosão. Uma maneira é manter a superfície metálica pintada para evitar o contacto com água e oxigénio. A liga de metais, como a mistura de ferro com pequenas quantidades de crómio em aço inoxidável, é outro método eficaz para evitar a corrosão. O crómio acumula-se perto da superfície e sofre oxidação, protegendo eficazmente o ferro da corrosão.
O ferro e outros metais também podem ser protegidos contra a corrosão por galvanização, processo no qual o metal a proteger é revestido com uma camada de um metal mais facilmente oxidado, geralmente zinco. Quando a camada de zinco está intacta, impede que o ar entre em contacto com o ferro subjacente e, assim, evita a corrosão. Se a camada de zinco for rompida por corrosão ou abrasão mecânica, o ferro ainda poderá ser protegido contra a corrosão por um processo de proteção catódica, descrito no parágrafo seguinte.
A proteção catódica utiliza o princípio da conversão do metal a ser protegido em um cátodo em uma reação eletroquímica. Isto é conseguido através da ligação do metal protegido a um metal mais ativo ou facilmente oxidado, como o zinco ou magnésio, conhecido como ânodo sacrificial. O ânodo corrói e é utilizado para proteger o metal que serve como cátodo. A proteção catódica é mais comumente usada em eletrodomésticos, como aquecedores de água e tanques subterrâneos de armazenamento de água. A ter em conta, a proteção catódica pode ser usada para outros metais que não apenas ferro.
Este texto é adaptado de OpenStax, Chemistry 2e, Chapter 17.6: Corrosion.
