9.4:
核結合エネルギー
9.4:
核結合エネルギー
計算で得られた質量と実験で得られた質量の差は、原子の質量欠損として知られています。ヘリウム4の場合、4.0331 amu – 4.0026 amu = 0.0305 amuの質量欠損があります。陽子、中性子、電子から原子が形成される際の質量の減少は、その質量をエネルギーに変換し、原子が形成される際に発生するエネルギーによるものです。核結合エネルギーとは、原子の核子が結合するときに発生するエネルギーで、原子核を陽子と中性子に分解するときに必要なエネルギーでもあります。核反応に伴うエネルギー変化は、化学反応に比べて圧倒的に大きいです。
質量とエネルギーの変換は、アルバート・アインシュタインが述べた質量–エネルギーの等価式で最も明確に表されます。E = mc2 ここで、Eはエネルギー、mは変換される物質の質量、cは真空中の光の速度です。この質量–エネルギー等価式を用いて、原子核の質量欠損から核結合エネルギーを算出することができます。核結合エネルギーの単位としては、電子ボルト(eV)などが一般的に用いられています。1 eVは、1ボルトの電位差で電子の電荷を移動させるのに必要なエネルギー量である1.602 × 10–19 Jに相当します。
質量欠損から結合エネルギーを計算するには、まず、質量欠損をg/molで表します。これは、原子質量(amu)とモル質量(g/mol)がamu単位とモル単位の定義に基づいて数的等価性を持っていることを用いればよいです。したがって、He-4の質量欠損は0.0305g/molとなります。1 J = 1 kg m2/s2であることから、質量–エネルギー方程式の他の項の単位に合わせて、質量をキログラムで表さなければなりません。グラムをキログラムに換算すると、質量欠損は3.05 × 10–5 kg/molとなります。この量を質量–エネルギーの等価式に代入すると、次のようになります。:
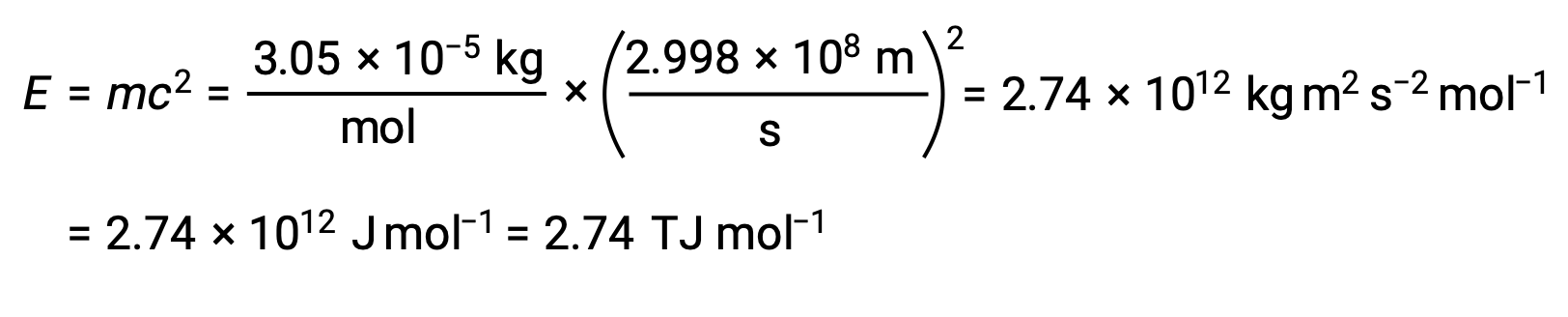
1つの原子核の結合エネルギーは、モル結合エネルギーからアボガドロ数を用いて計算できます。
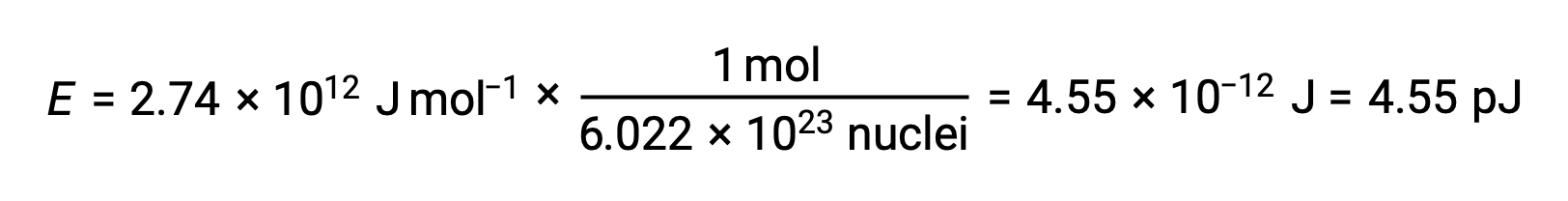
1eV = 1.602 × 10–19 Jであることを用い、結合エネルギーを計算すると、次のようになります。
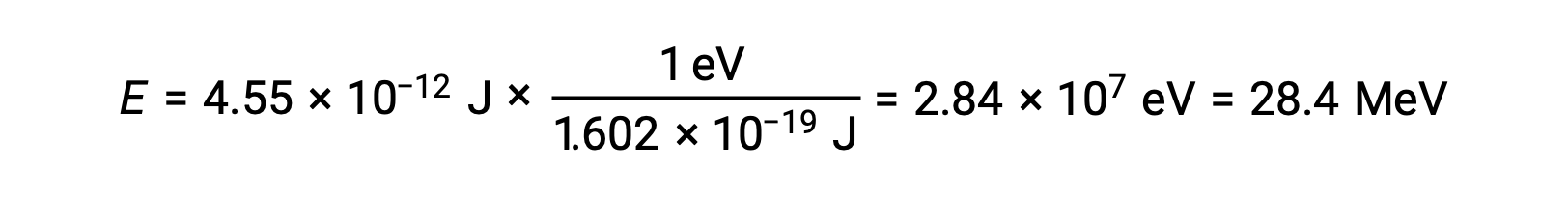
原子核の相対的な安定性は、核子あたりの結合エネルギー(原子核の結合エネルギーの合計を核子の数で割ったもの)と相関しています。例えば、ヘリウム-4の原子核の結合エネルギーは28.4 MeVです。したがって、ヘリウム-4核の核子1個あたりの結合エネルギーは次の通りです。
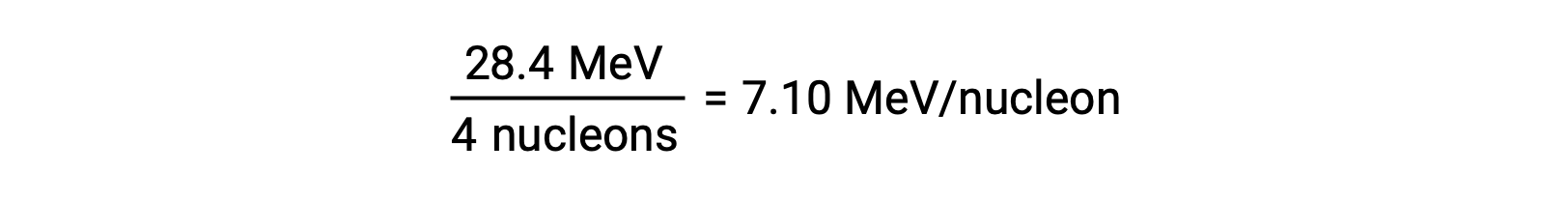
核子あたりの結合エネルギーは、質量数が約56の核種で最大となります。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 21.1: Nuclear Structure and Stability.
