10.8:
نظرية المجال البلوري - مجمّعات ثماني السطوح
10.8:
نظرية المجال البلوري - مجمّعات ثماني السطوح
نظرية المجال البلوري
لشرح السلوك الملحوظ للمجمعات المعدنية الانتقالية (مثل الألوان) ، يحتوي النموذج الذي يتضمن تفاعلات كهروستاتيكية بين الإلكترونات من الروابط والإلكترونات في مدارات d غير المهجنة لذرة المعدن المركزية تم تطويره. هذا النموذج الكهروستاتيكي هو نظرية المجال البلوري (CFT). فهو يساعد على فهم وتفسير والتنبؤ بالألوان والسلوك المغناطيسي وبعض تراكيب مركبات التنسيق للمعادن الانتقالية.
يركز CFT على الإلكترونات غير المترابطة على أيون المعدن المركزي في مجمعات التنسيق وليس على الروابط المعدنية الرابطة. مثل نظرية رابطة التكافؤ ، يحكي CFT جزءًا فقط من قصة سلوك المجمعات. يتجاهل CFT في شكله النقي أي رابطة تساهمية بين الروابط وأيونات المعادن. يتم التعامل مع كل من الربيطة والمعدن على أنها شحنة نقطية متناهية الصغر.
جميع الإلكترونات سالبة ، لذا فإن الإلكترونات المتبرع بها من الروابط ستصد إلكترونات المعدن المركزي. ضع في اعتبارك سلوك الإلكترونات في مدارات d غير المهجنة في معقد ثماني السطوح. تتكون المدارات d الخمسة من مناطق على شكل فص ويتم ترتيبها في الفضاء ، كما هو موضح في الشكل 1. في مجمع ثماني السطوح ، تنسق الروابط الستة على طول المحاور.
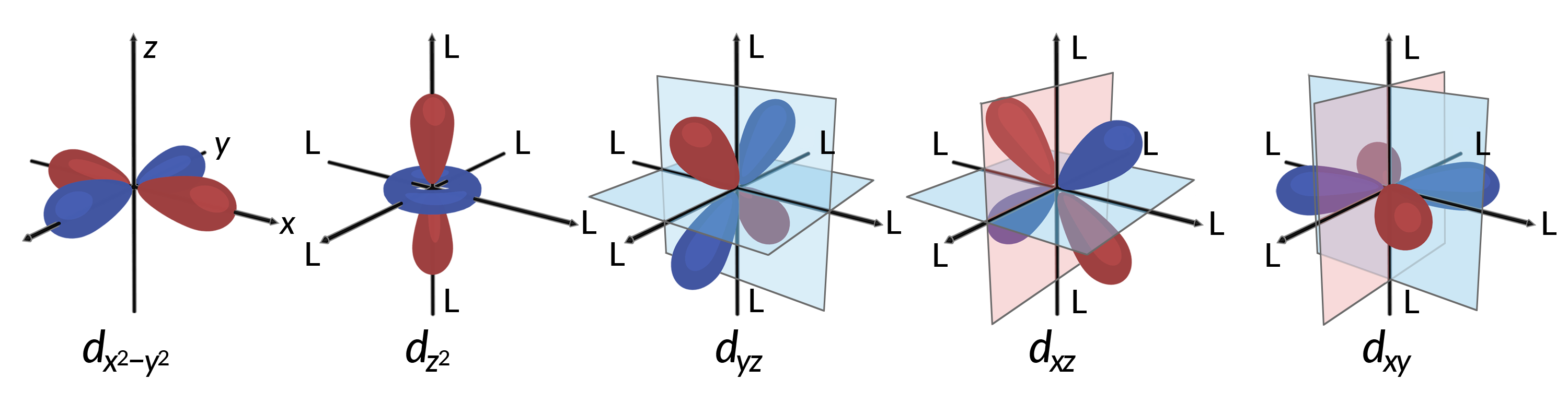
الشكل 1. الخصائص الاتجاهية لمدارات d الخمسة موضحة هنا. تشير الأجزاء المظللة إلى مرحلة المدارات. تنسق الروابط (L) على طول المحاور في مجمعات ثماني السطوح. للتوضيح ، تم حذف الروابط من dx 2−؛ y2 مداري بحيث يمكن عرض تسميات المحور.
في أيون معدني غير معقد في الطور الغازي ، يتم توزيع الإلكترونات بين مدارات d الخمسة وفقًا لقاعدة Hund لأن المدارات لها نفس الطاقة. في المجمعات المعدنية الانتقالية ، تتأثر طاقات المدارات d لذرات المعادن الانتقالية بنوع الروابط والهندسة الجزيئية. إذا كانت جزيئات الترابط مرتبة بشكل موحد حول أيون المعدن ، يتم إنشاء حقل بلوري كروي. يرفع هذا المجال البلوري الكروي طاقات المدارات d من أيون المعدن بمقدار متساو (الشكل 2). عندما تنسق الروابط مع أيون معدني في هندسة ثماني السطوح ، فإن طاقات المدارات d لم تعد كما هي.

الشكل 2. تتزعزع مدارات d الخاصة بأيون الفلز في مجال بلوري كروي (أعلى في الطاقة) مقارنةً بـ d مدارات أيون المعدن الحر غير المعقد. في المجمعات ثماني السطوح ، تتزعزع مدارات eg بدرجة أكبر (أعلى في الطاقة) مقارنةً بـ t2g المدارات لأن الروابط الترابطية تتفاعل بقوة أكبر مع المدارات d التي يتم توجيهها إليها مباشرة.
في المجمعات ثمانية السطوح، الفصوص الموجودة في اثنين من مدارات d الخمسة، d x 2&# 8722؛ y 2 و d z 2 المدارات، أشر نحو الروابط (الشكل 1). يُطلق على هذين المداريين اسم المدارات eg (يشير الرمز إلى تناظر المدارات). المدارات الثلاثة الأخرى ، d xy و dxz و d yz مدارات ، لها فصوص تشير بين الروابط وتسمى المدارات t 2 g (مرة أخرى ، الرمز يشير إلى تناظر المدارات). عندما تقترب ستة روابط من أيون المعدن على طول محاور المجسم الثماني ، فإن شحناتها النقطية تصد الإلكترونات في مدارات d من أيون المعدن. ومع ذلك ، فإن التنافر بين الإلكترونات في المدارات eg (d x 2 – y 2 المدارات) والروابط أكبر من التنافر بين الإلكترونات في t 2 g المدارات (dxy ، d xz ، و dyz مدارات) والروابط. هذا لأن فصوص المدارات eg تشير مباشرة إلى الروابط ، في حين أن فصوص t 2 g النقطة المدارية بينهما. وبالتالي ، فإن الإلكترونات الموجودة في المدارات eg لأيون الفلز في معقد ثماني السطوح لها طاقات جهد أعلى من تلك الموجودة في الإلكترونات في t2g مدارات. يمكن تمثيل الفرق في الطاقة كما هو موضح في الشكل 2.
الفرق في الطاقة بين eg و t2 g تسمى المدارات بتقسيم المجال البلوري ويرمز لها بـ Δ؛أوكت</sub ، حيث يرمز أوكت إلى ثماني السطوح. يعتمد حجم  ؛Δ؛ أوكت على العديد من العوامل، بما في ذلك طبيعة الروابط الستة الموجودة حول أيون المعدن المركزي، والشحنة على المعدن، وما إذا كان المعدن يستخدم 3d ،4d ، أو 5d مدارات. تنتج الروابط المختلفة وصلات حقل بلورية مختلفة. يتم التعبير عن الانقسام المتزايد للحقل البلوري الناتج عن الروابط في السلسلة الطيفية ، ونقدم نسخة مختصرة منها هنا:
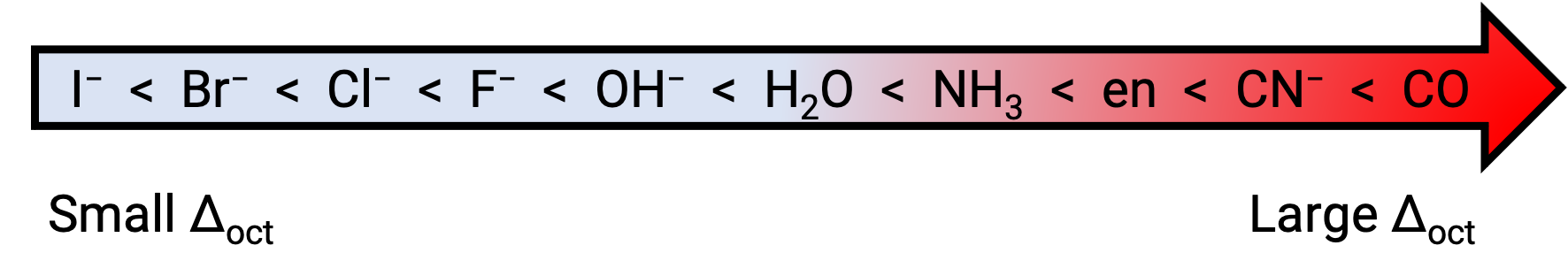
هذا النص مقتبس من Openstax, Chemistry 2e, Section:19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
