10.8:
結晶場理論 - 八面体型錯体
10.8:
結晶場理論 - 八面体型錯体
結晶場理論
遷移金属錯体におけるの外観などの特徴を説明するために、配位子からの電子と中心金属原子の非混成d軌道の電子との間の静電的相互作用を含むモデルが考えられました。この静電モデルは、結晶場理論(Crystal Field Theory:CFT)と呼ばれています。これは、配位化合物の色、磁気的挙動、およびいくつかの構造を理解し、解釈し、予測するのに役立ちます。
CFTは、金属と配位子の結合ではなく、配位錯体における中心金属イオン上の非結合電子に着目しています。原子価結合理論と同様に、CFTは錯体の挙動の一部しか説明しません。CFTでは、配位子と金属イオンの間の共有結合を一切無視しています。配位子も金属も、限りなく小さな点電荷として扱われます。
すべての電子は負電荷をもつため、配位子から供与された電子は中心金属の電子と反発します。八面体型錯体における非混成d軌道の電子の挙動を考えたいです。5つのd軌道はローブ状の形状を持ち、Figure 1に示すように空間に配置されています。八面体型錯体では、6つの配位子が軸に沿って配位します。
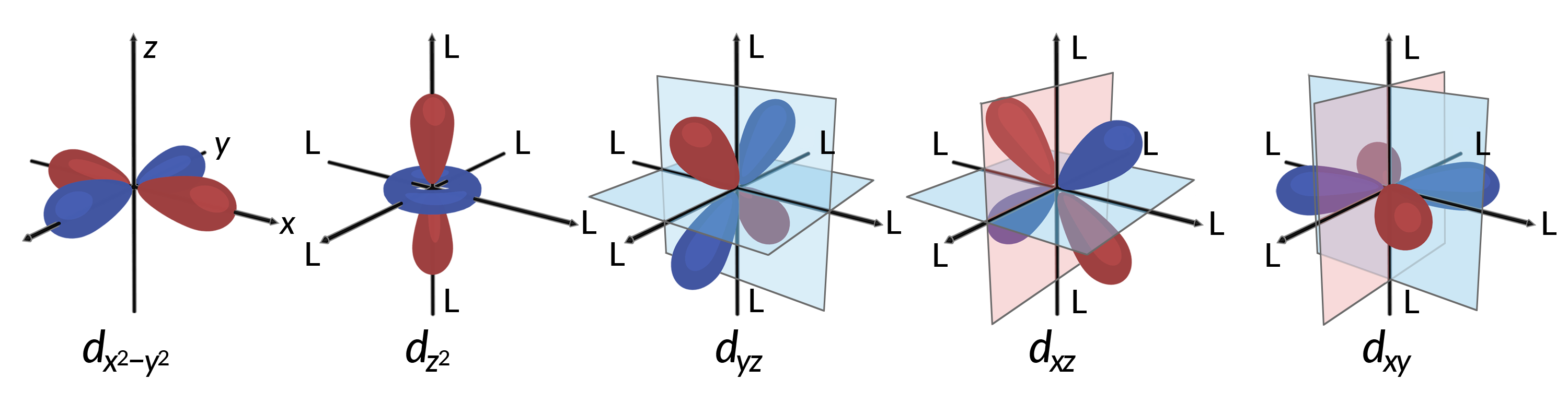
Figure 1.ここでは、5つのd軌道の方向を示しています。斜線部分は軌道の位相を示します。配位子(L)は、八面体型錯体の軸に沿って配位します。わかりやすくするために、dx2−y2の軌道では、軸ラベルを表示できるように配位子を省略しています。
気相中の非錯体金属イオンでは、5つのd軌道がすべて同じエネルギーを持つため、電子はフント則に従って5つのd軌道に分配されます。遷移金属錯体の場合、遷移金属原子のd軌道のエネルギーは、配位子の種類と分子の形状に影響されます。配位子の分子が金属イオンの周りに一様に配置されていると、球状の結晶場ができます。この球状の結晶場は、金属イオンのd軌道のエネルギーを同じ量だけ上昇させます(Figure 2)。配位子が八面体構造の金属イオンに配位すると、d軌道のエネルギーはもはや同じではありません。
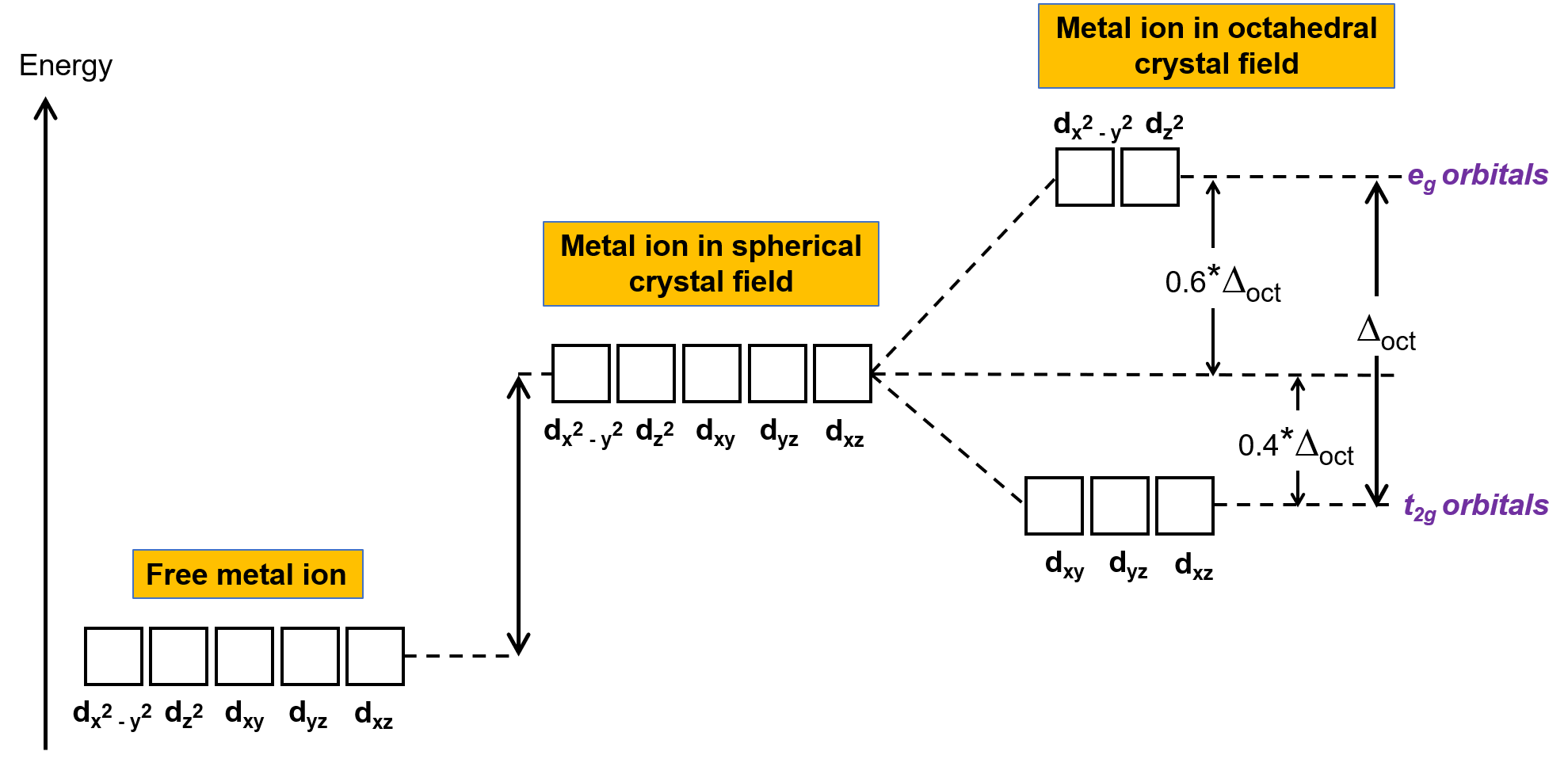
Figure 2.球状結晶場における金属イオンのd軌道は、非錯体の自由金属イオンのd軌道に比べて不安定化している(エネルギーが高い)。八面体型錯体では、配位子が直接向いているd軌道とより強く相互作用するため、eg軌道はt2g軌道に比べてさらに不安定化(高エネルギー化)します。
八面体型錯体では、5つのd軌道のうち、dx2−y2とdz2の2つの軌道のローブが配位子の方向を向いている(Figure 1)。この2つの軌道はeg軌道と呼ばれる(記号は軌道の対称性を意味している)。残りの3つの軌道、dxy、dxz、dyzは、配位子の間を向いたローブを持ち、t2g軌道と呼ばれる(ここでも記号は軌道の対称性を意味している)。6つの配位子が八面体の軸に沿って金属イオンに近づくと、その点電荷が金属イオンのd軌道の電子と反発します。しかし eg軌道(dx2–y2軌道)は配位子と電子間反発するのに対し、t2g軌道(dxy, dxz、dyzの各軌道)は配位子との”間”と電子間反発します。これは、eg軌道のローブが直接配位子を向いているのに対し、t2g軌道のローブは配位子の”間”を向いているからです。したがって、八面体型錯体の金属イオンのeg軌道の電子は、t2g軌道の電子よりも高いポテンシャルエネルギーを持っています。このエネルギーの差は、Figure 2のように表すことができます。
egとt2g軌道の間のエネルギー差は結晶場分裂と呼ばれ、 Δoctで表象されます。ここで、octは八面体を表します。Δoctの大きさは、中心の金属イオンを取り囲む6つの配位子の性質、金属の電荷、金属の最外殻d軌道が3d、4d、または5dであるかどうかなど、多くの要因に依存します。配位子の種類によって、結晶場の分裂は異なります。配位子によって生じる結晶場分割の増加は分光系列で表現され、それらを短くまとめたものをここに示します。
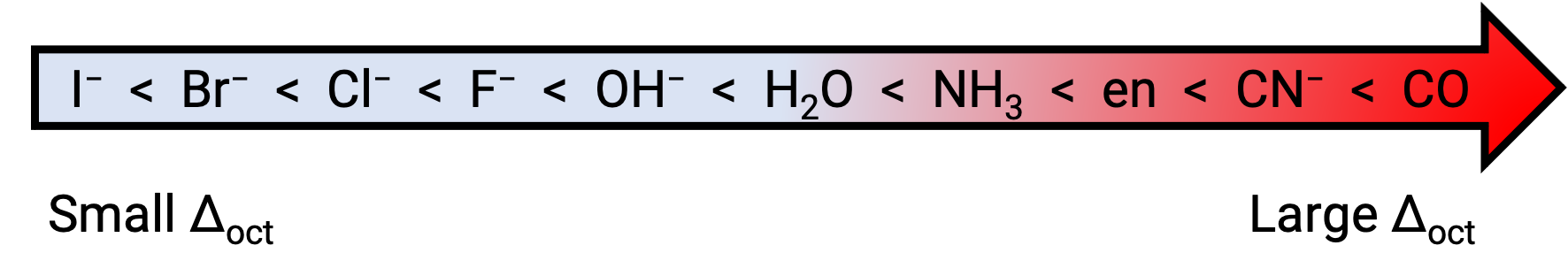
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section:19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
