10.8:
결정장 이론 - 팔면체 착물
10.8:
결정장 이론 - 팔면체 착물
크리스탈 필드 이론
전이 금속 복합체(예: 색상)의 관찰된 거동을 설명하기 위해, 중앙 금속 원자의 비혼화 D 궤도에서 리간드와 전자사이의 정전기 상호작용을 포함하는 모델이 개발되었다. 이 정전기 모델은 결정 필드 이론 (CFT)입니다. 그것은 전이 금속의 조정 화합물의 색상, 자기 행동 및 일부 구조를 이해하고 해석하고 예측하는 데 도움이됩니다.
CFT는 금속 리간드 결합이 아닌 조정 복합체에서 중앙 금속 이온에 대한 비결합 전자에 중점을 둡니다. 원자 채권 이론과 마찬가지로 CFT는 단지의 행동에 대한 이야기의 일부만 알려줍니다. 순수한 형태로 CFT는 리간드와 금속 이온 사이의 공유 결합을 무시합니다. 리간드와 금속 은 모두 무한히 작은 포인트 충전으로 처리됩니다.
모든 전자는 음수이므로 리간드에서 기증된 전자는 중앙 금속의 전자를 격퇴합니다. 옥타헤드랄 복합체에서 비혼화 D 궤도에서 전자의 동작을 고려한다. 5d 궤도는 로브 모양의 영역으로 구성되며 그림 1에 도시된 것처럼 공간에 배치됩니다. 옥타헤드랄 복합체에서 6개의 리간드가 축을 따라 조정합니다.
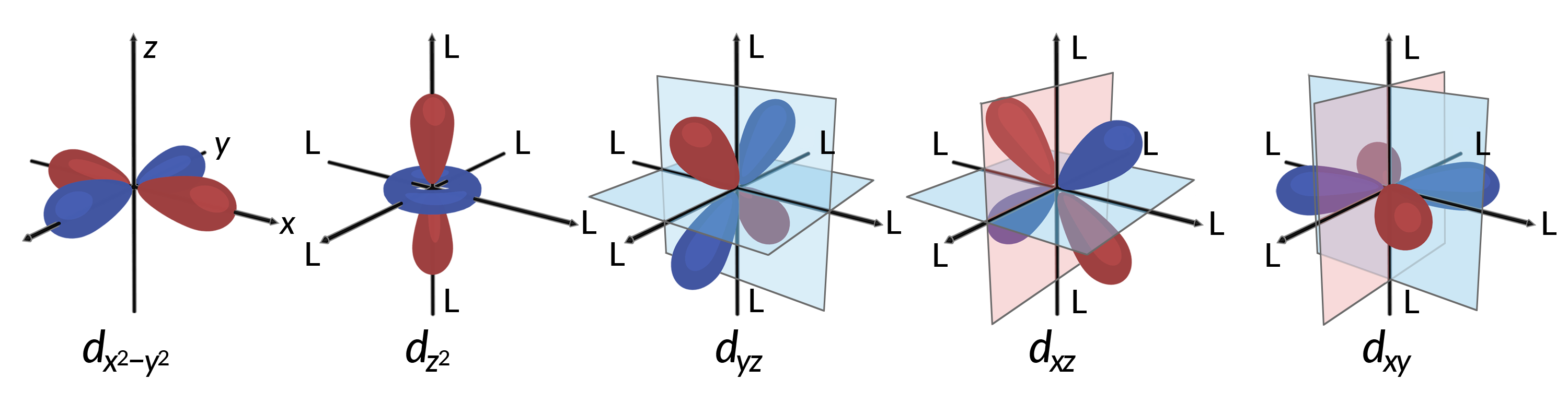
그림 1. 5d 궤도의 방향 특성은 여기에 표시됩니다. 그늘진 부분은 궤도의 위상을 나타낸다. 리간드(L)는 옥타히드랄 복합체의 축을 따라 조정합니다. 명확성을 위해, 리간드는 축 레이블이 표시 될 수 있도록 dx2–y2 궤도에서 생략되었습니다.
가스 상에서 복잡하지 않은 금속 이온에서 전자는 궤도가 모두 동일한 에너지를 가지고 있기 때문에 Hund의 규칙에 따라 5 개의 궤도 사이에 분포됩니다. 전이 금속 복합체에서, 전이 금속 원자의 d 궤도의 에너지는 리간드의 종류와 분자 형상에 의해 영향을 받습니다. 리간드 분자가 금속 이온 주위에 균일하게 배열되는 경우 구형 결정 필드가 생성됩니다. 이 구형 결정 필드는 금속 이온의 d 궤도의 에너지를 동일한 양으로 올립니다(도 2). 리간드가 옥타히드랄 형상에서 금속 이온과 조화를 이면 d 궤도의 에너지가 더 이상 동일하지 않습니다.
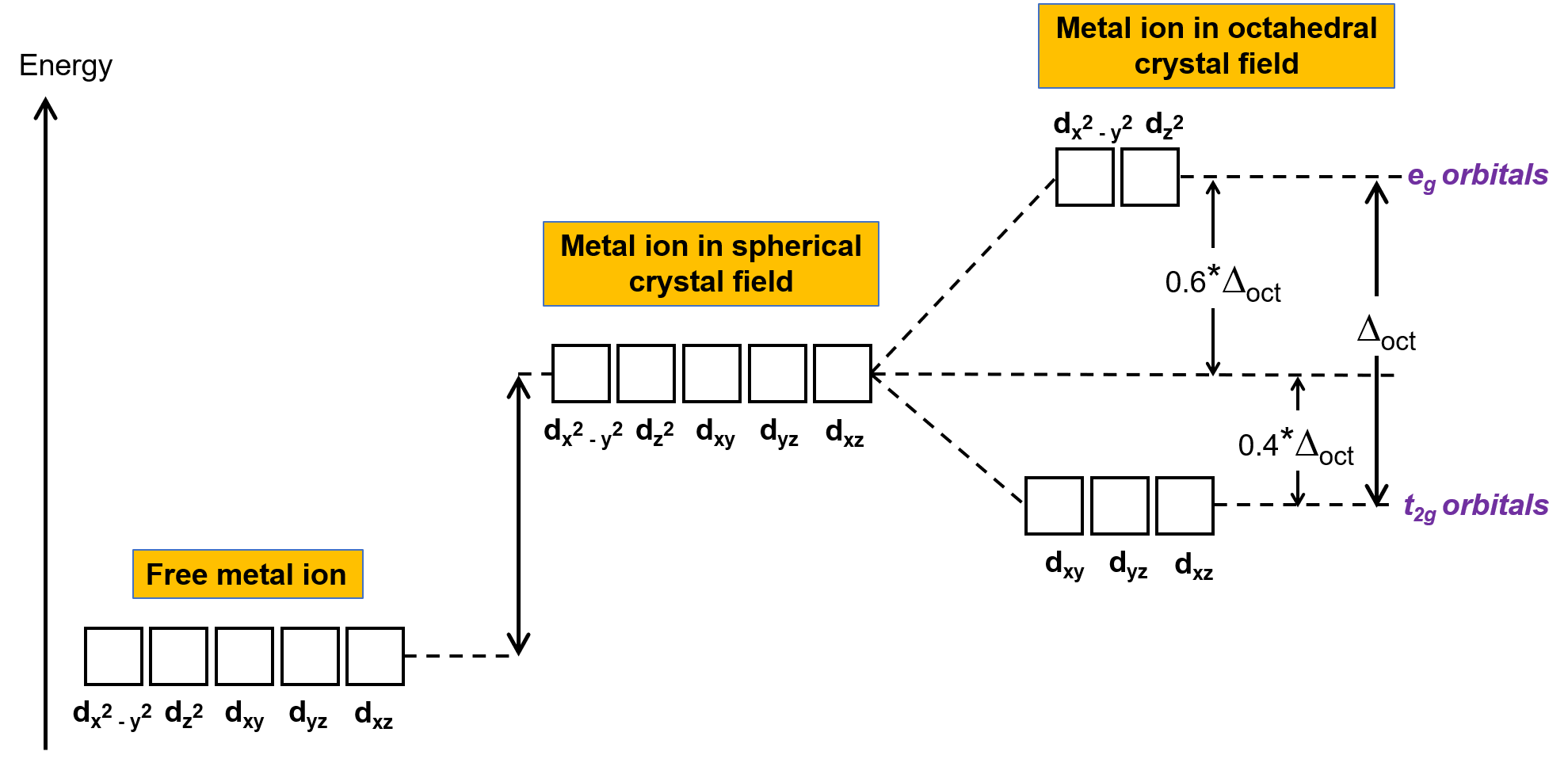
그림 2. 구형 결정장에서 금속 이온의 d 궤도는 복잡하지 않은 자유 금속 이온의 d 궤도에 비해 불안정 (에너지가 더 높다). 옥타히드랄 복합체에서, eg 궤도는 리간드가직접 가리키는 d 궤도와 더 강하게 상호 작용하기 때문에 t 2g 궤도에 비해 더 불안정 (에너지가 더 높다).
옥타히드랄 복합체에서, 5d 궤도의 두 에서 로브, dx2–y2 및 dz2 궤도, 리간드를 향해 가리킵니다 (그림 1). 이 두 궤도는 eg 궤도라고합니다 (기호는 궤도의 대칭을 의미합니다). 다른 세 궤도, dxy, dxz및 dyz 궤도는 리간드 사이를 가리키는 엽을 가지고 있으며 t2g 궤도라고합니다 (다시, 기호는 궤도의 대칭을 의미한다). 6개의 리간드가 옥타히드론의 축을 따라 금속 이온에 접근할 때, 그들의 포인트 충전은 금속 이온의 d 궤도에서 전자를 격퇴합니다. 그러나, 전자g 궤도(dx2-y2 궤도)와 리간드 내의 전자 사이의 반발은 t2g 궤도(d xy, dxz및 dyz orbitals)와 리간드의 전자 사이의 반발보다 크다. 이는 eg 궤도의 엽이 리간드에서 직접 가리키는 반면, t2g 궤도의 로브가 그들 사이의 지점을 가리키기 때문이다. 따라서, 옥타히드랄 복합체에서 금속 이온의 전자g 궤도내의 전자는 t2g 궤도에서 전자보다 더 높은 잠재적 에너지를 가지고 있다. 에너지의 차이는 도 2에 도시된 바와 같이 나타낼 수 있다.
eg와 t2g 궤도 사이의 에너지 차이는 결정필드 분할이라고 하며 옥타히드랄을 의미하는 Δoct에의해 상징된다. Δoct의 크기는 중앙 금속 이온 주위에 위치한 6개의 리간드의 특성, 금속의 전하 및 금속이3d,4d또는5d 궤도를 사용하고 있는지 여부를 포함하여 많은 요인에 따라 달라집니다. 다른 리간드들은 다른 크리스탈 필드 분할을 생성합니다. 리간드에 의해 생성 되는 증가 크리스탈 필드 분할 분광기 시리즈에 표현, 여기서 주어진 짧은 버전:
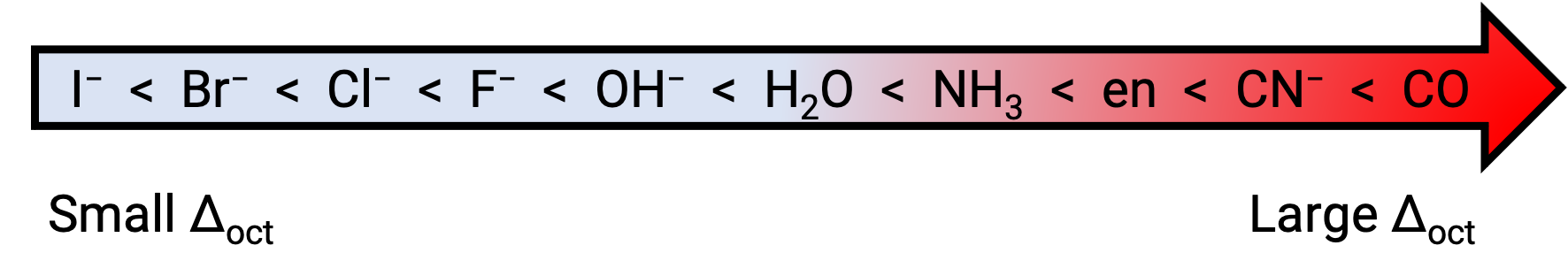
이 텍스트는 Openstax, 화학 2e, 섹션:19.3: 조정 화합물의 S펙트로스코픽 및 자기 특성에서 적용됩니다.
