10.8:
Teoría del Campo Cristalino - Complejos Octaédricos
10.8:
Teoría del Campo Cristalino - Complejos Octaédricos
Teoría del Campo Cristalino
Para explicar el comportamiento observado de los complejos metálicos de transición (como los colores), se ha desarrollado un modelo que involucra interacciones electrostáticas entre los electrones de los ligandos y los electrones en los orbitales d no hibridados del átomo metálico central. Este modelo electrostático es la teoría del campo cristalino (TCC). Esta ayuda a entender, interpretar y predecir los colores, el comportamiento magnético y algunas estructuras de los compuestos de coordinación de los metales de transición.
La TCC se enfoca en los electrones no enlazantes en el ion central de metal en los complejos de coordinación, no en los enlaces metal-ligando. Al igual que la teoría del enlace de valencia, la TCC cuenta sólo parte de la historia del comportamiento de los complejos. En su forma pura, la TCC ignora cualquier enlace covalente entre ligandos e iones metálicos. Tanto el ligando como el metal se tratan como cargas puntuales infinitesimalmente pequeñas.
Todos los electrones son negativos, por lo que los electrones donados de los ligandos repelen los electrones del metal central. Considere el comportamiento de los electrones en los orbitales d no hibridados en un complejo octaédrico. Los cinco orbitales d consisten en regiones con forma de lóbulo y están dispuestos en el espacio, como se muestra en la Figura 1. En un complejo octaédrico, los seis ligandos se coordinan a lo largo de los ejes.
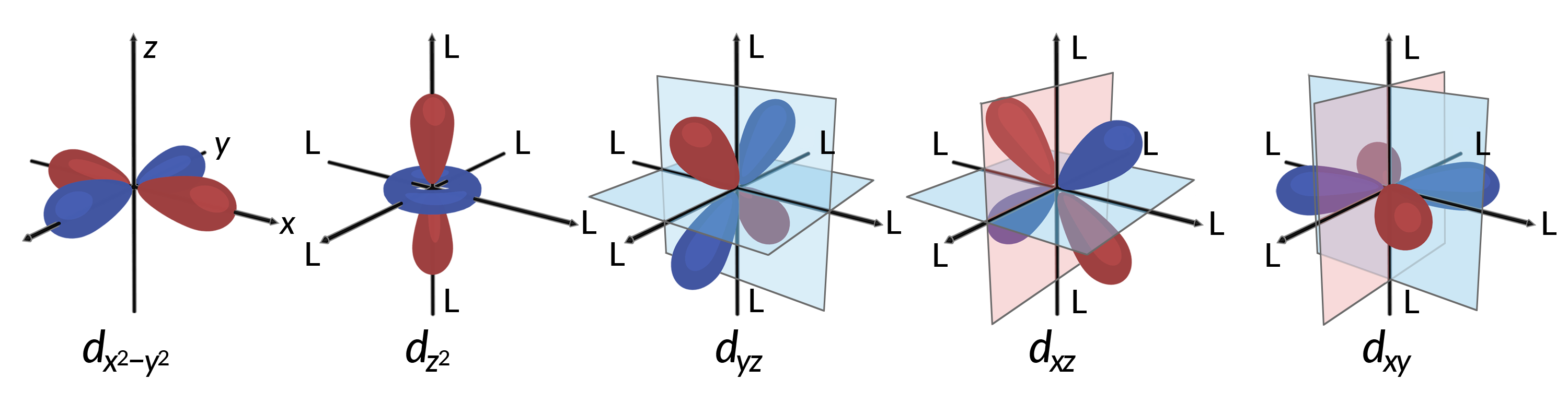
Figura 1. Las características direccionales de los cinco orbitales d se muestran aquí. Las partes sombreadas indican la fase de los orbitales. Los ligandos (L) se coordinan a lo largo de los ejes en los complejos octaédricos. Para mayor claridad, los ligandos se han omitido del orbital dx2−y2 para que se puedan mostrar las etiquetas de los ejes.
En un ion metal no complejo en la fase gaseosa, los electrones se distribuyen entre los cinco orbitales d de acuerdo con la regla de Hund, porque todos los orbitales tienen la misma energía. En los complejos metálicos de transición, las energías de los orbitales d de los átomos metálicos de transición se ven afectadas por el tipo de ligando y la geometría molecular. Si las moléculas de ligando están dispuestas uniformemente alrededor del ion metal, se crea un campo cristalino esférico. Este campo cristalino esférico eleva las energías de los orbitales d del ion metálico en una cantidad igual (Figura 2). Cuando los ligandos se coordinan con un ión metálico en una geometría octaédrica, las energías de los orbitales d ya no son las mismas.
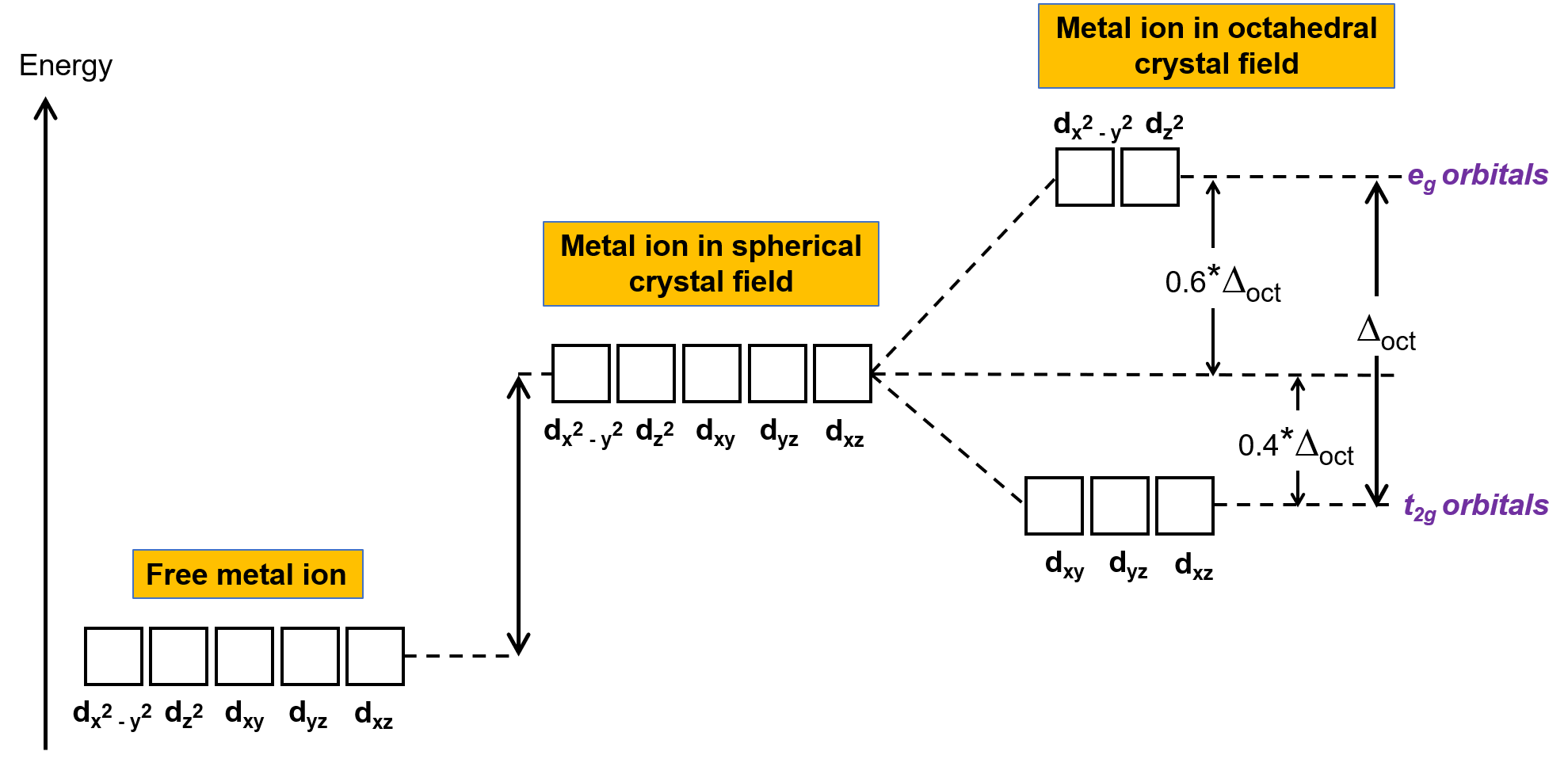
Figura 2. Los orbitales d ion metálico en un campo cristalino esférico se desestabilizan (mayores en energía) en comparación con los orbitales d del ion de metal libre sin complejo. En los complejos octaédricos, los orbitales eg se desestabilizan aún más (mayores en energía) en comparación con los orbitales t2g porque los ligandos interactúan más fuertemente con los orbitales d a los que se dirigen directamente.
En los complejos octaédricos, los lóbulos de dos de los cinco orbitales d, los orbitales dx2−y2 y dz2, apuntan hacia los ligandos (Figura 1). Estos dos orbitales se llaman orbitales eg (el símbolo se refiere a la simetría de los orbitales). Los otros tres orbitales, los orbitales dxy, dxz y dyz, tienen lóbulos que se diregen entre los ligandos y se llaman orbitales t2g (de nuevo, el símbolo se refiere a la simetría de los orbitales). A medida que seis ligandos se acercan al ion metal a lo largo de los ejes del octaedro, sus cargas puntuales repelen los electrones en los orbitales d del ion metal. Sin embargo, las repulsiones entre los electrones en los orbitales eg (los orbitales dx2–y2) y los ligandos son mayores que las repulsiones entre los electrones en los orbitales t2g (los orbitales dxy, dxz, and dyz) y los ligandos. Esto se debe a que los lóbulos de los orbitales eg apuntan directamente a los ligandos, mientras que los lóbulos de los orbitales t2g apuntan entre ellos. Por lo tanto, los electrones en los orbitales eg de un ion metal en un complejo octaédrico tienen energías potenciales más altas que las de los electrones en los orbitales t2g. La diferencia en energía puede ser representada como se muestra en la Figura 2.
La diferencia de energía entre el orbital eg y el orbital t2g se denomina división del campo cristalino y se simboliza con Δoct, donde oct significa octaédrica. La magnitud de la Δoct depende de muchos factores, incluyendo la naturaleza de los seis ligandos ubicados alrededor del ion central de metal, la carga sobre el metal, y si el metal está usando orbitales 3d, 4d, o 5d. Diferentes ligandos producen diferentes divisiones del campo cristalino. La división creciente del campo cristalino producido por ligandos se expresa en la serie espectroquímca, una versión corta de la cual se muestra aquí:
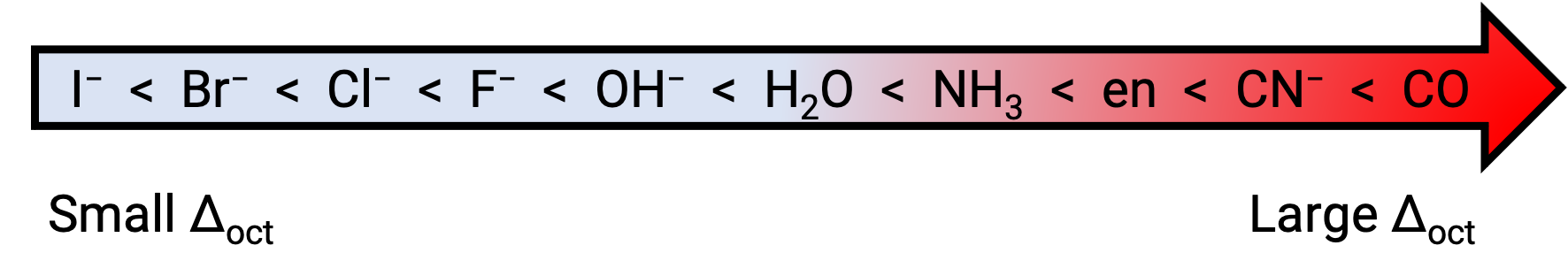
Este texto está adaptado de Openstax, Química 2e, Sección:19.3: Propiedades espectroscópicas y magnéticas de los compuestos de coordinación.
