10.8:
Теория кристаллического поля - октаэдрические комплексы
10.8:
Теория кристаллического поля - октаэдрические комплексы
Теория кристаллического поля
Для объяснения наблюдаемого поведения комплексов переходных металлов (таких как цвета) разработана модель, включающая электростатические взаимодействия между электронами из лигандов и электронами в негибридированных d орбит атома центрального металла. Эта электростатическая модель представляет собой теорию кристаллического поля (CFT). Это помогает понять, интерпретировать и предсказать цвета, магнитное поведение и некоторые структуры координационных соединений переходных металлов.
CFT фокусируется на несвязных электронах на центральном ионе металла в координационных комплексах, а не на металло-лигандовых связях. Как и теория валентных уз, CFT рассказывает только часть истории о поведении комплексов. В чистом виде CFT игнорирует любые ковалентные связи между лигандами и ионами металлов. Как лиганд, так и металл рассматриваются как бесконечно малые точечные заряды.
Все электроны отрицательны, поэтому электроны, подаренные из лигандов, отталкивают электроны центрального металла. Рассмотрим поведение электронов в негибридированные д орбит в октаэдричном комплексе. Пять d орбит состоят из лопастных областей и расположены в пространстве, как показано на рисунке 1. В октаэдрильном комплексе шесть лигандов координируют по осям.
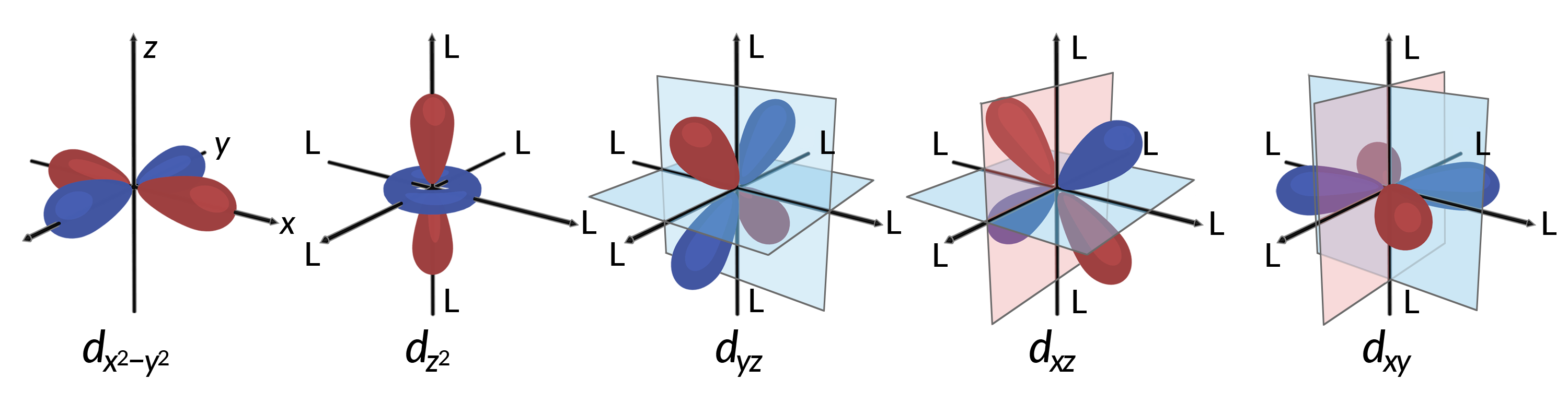
Рисунок 1. Здесь показаны направленные характеристики пяти d орбиталей. Закрашенные части обозначают фазу орбит. Лиганды (L) координируют по осям в октаэдрических комплексах. Для наглядности лиганды не показаны на орбитальной орбите dx2-Y2, чтобы можно было использовать метки осей.
В некомплексовом металле ион в газовой фазе электроны распределяются между пятью d орбиталями в соответствии с правилом Хунда, потому что орбит все имеют одинаковую энергию. В комплексах переходных металлов энергии d орбиталей атомов переходных металлов влияют на тип лигандов и молекулярную геометрию. Если молекулы лиганда равномерно расположены вокруг иона металла, создается сферическое кристаллическое поле. Это сферическое кристаллическое поле увеличивает энергии d орбиталей металлического иона на равное количество (рис. 2). Когда лиганды координируют с ионом металла в октаэдрической геометрии, энергии d орбиталей больше не совпадают.
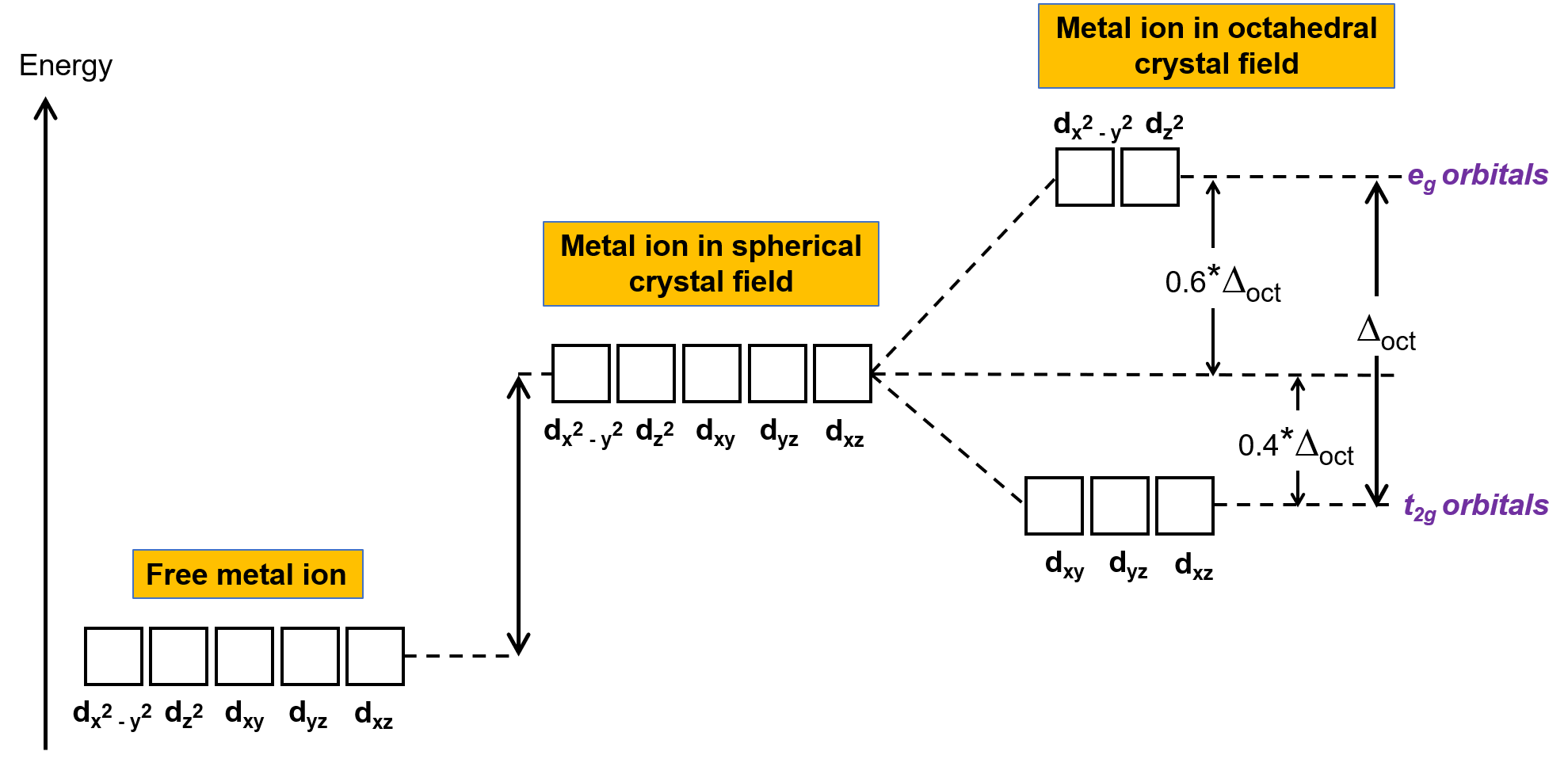
Рисунок 2. D орбитали иона металла в сферическом кристаллическом поле дестабилизируются (более высокие в энергии) по сравнению с d орбиталями некомплексованного свободного иона металла. В октаэдрических комплексах, например, орбит еще больше дестабилизируется (более высокая в энергии) по сравнению с битулами t2g, потому что лиганды более сильно взаимодействуют с д орбиталами, на которых они направлены напрямую.
В октаэдрических комплексах доли в двух из пяти d орбит, орбит dx2–y2 и dz2, указывают на лиганды (рис. 1). Эти два орбитала называются, например, орбит (символ относится к симметрии орбит). Остальные три орбита, dxy, dxz и diz orbitals, имеют доли, которые указывают между лигандами и называются орбит t2g (опять же, символ относится к симметрии орбит). Когда шесть лигандов приближаются к металлическому иону вдоль осей октаэдра, их точечные заряды отталкивают электроны в д орбитах металлического иона. Однако, репульсы между электронами в например, орбита (орбита dx2–y2) и лиганды больше, чем репульсы между электронами в орбитах t2g (докси, dxz, и дизорбит) и лигандах. Это связано с тем, что доли эг орбит указывают непосредственно на лиганды, тогда как доли торбитулов t2g указывают между ними. Таким образом, электроны в эг орбит иона металла в октаэдрическом комплексе имеют более высокие потенциальные энергии, чем электроны в двухграммовых орбиталях. Разность в энергии может быть представлена, как показано на рис. 2.
Разница в энергии между эг и торбилами t2g называется расщеплением кристаллического поля и символизирует Δoct, где окт расшифровывается как октаэдрический. Величина Δoct зависит от многих факторов, в том числе от примоль шести лигандов, расположенных вокруг центрального иона металла, заряда на металле, а также от того, использует ли металл трехмерные, 4d или 5d орбит. Различные лиганды производят разную кристаллические осколки. Возрастающее расщепление кристаллического поля, производимого лигандами, выражается в спектрохимической серии, краткая версия которой приводится здесь:
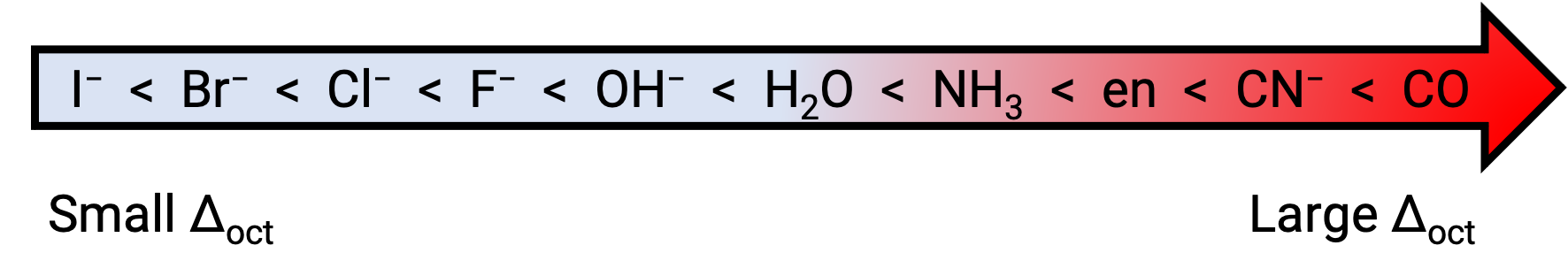
Этот текст адаптирован из Openstax, Химия 2е изд., раздел:19.3: Спектроскопические и магнитные свойства координационных соединений.
