10.8:
Teoria del campo cristallino - Complessi ottaedrici
10.8:
Teoria del campo cristallino - Complessi ottaedrici
Teoria dei campi cristallini
Per spiegare il comportamento osservato dei complessi metallici di transizione (come i colori), è stato sviluppato un modello che coinvolge interazioni elettrostatiche tra gli elettroni dei ligandi e gli elettroni negli orbitali d non ibridizzati dell’atomo metallico centrale. Questo modello elettrostatico è la teoria dei campi cristallini (CFT). Aiuta a comprendere, interpretare e prevedere i colori, il comportamento magnetico e alcune strutture di composti di coordinazione dei metalli di transizione.
La CFT si concentra sugli elettroni nonbonding sullo ione metallico centrale nei complessi di coordinazione non sui legami metallo-ligando. Come la teoria del legame di valenza, la CFT racconta solo una parte della storia del comportamento dei complessi. Nella sua forma pura, la CFT ignora qualsiasi legame covalente tra ligandi e ioni metallici. Sia il ligando che il metallo sono trattati come cariche infinitesimale a punti piccoli.
Tutti gli elettroni sono negativi, quindi gli elettroni donati dai ligandi respingeranno gli elettroni del metallo centrale. Si consideri il comportamento degli elettroni negli orbitali d non ibridati in un complesso ottaedro. I cinque orbitali d sono costituiti da regioni a forma di lobo e sono disposti nello spazio, come mostrato nella figura 1. In un complesso ottaedro, i sei ligandi si coordinano lungo gli assi.
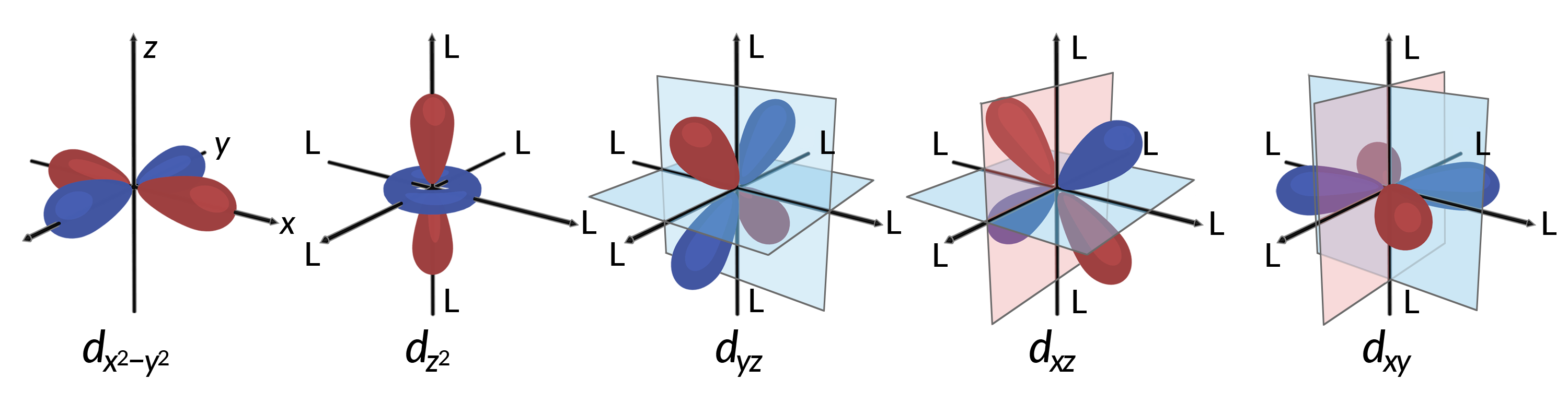
Figura 1. Le caratteristiche direzionali dei cinque orbitali d sono mostrate qui. Le porzioni ombreggiate indicano la fase degli orbitali. I ligandi (L) si coordinano lungo gli assi nei complessi ottaedri. Per chiarezza, i ligandi sono stati omessi dall’orbitale dx2−y2 in modo che le etichette dell’asse potessero essere mostrate.
In uno ione metallico non complesso nella fase gassosa, gli elettroni sono distribuiti tra i cinque orbitali d in accordo con la regola di Hund perché gli orbitali hanno tutti la stessa energia. Nei complessi metallici di transizione, le energie degli orbitali d degli atomi di metallo di transizione sono influenzate dal tipo di ligandi e dalla geometria molecolare. Se le molecole di ligando sono disposte uniformemente attorno allo ione metallico, viene creato un campo cristallino sferico. Questo campo cristallino sferico aumenta le energie degli orbitali d dello ione metallico di una quantità uguale (Figura 2). Quando i ligandi si coordinano con uno ione metallico in una geometria ottaedrica, le energie degli orbitali d non sono più le stesse.
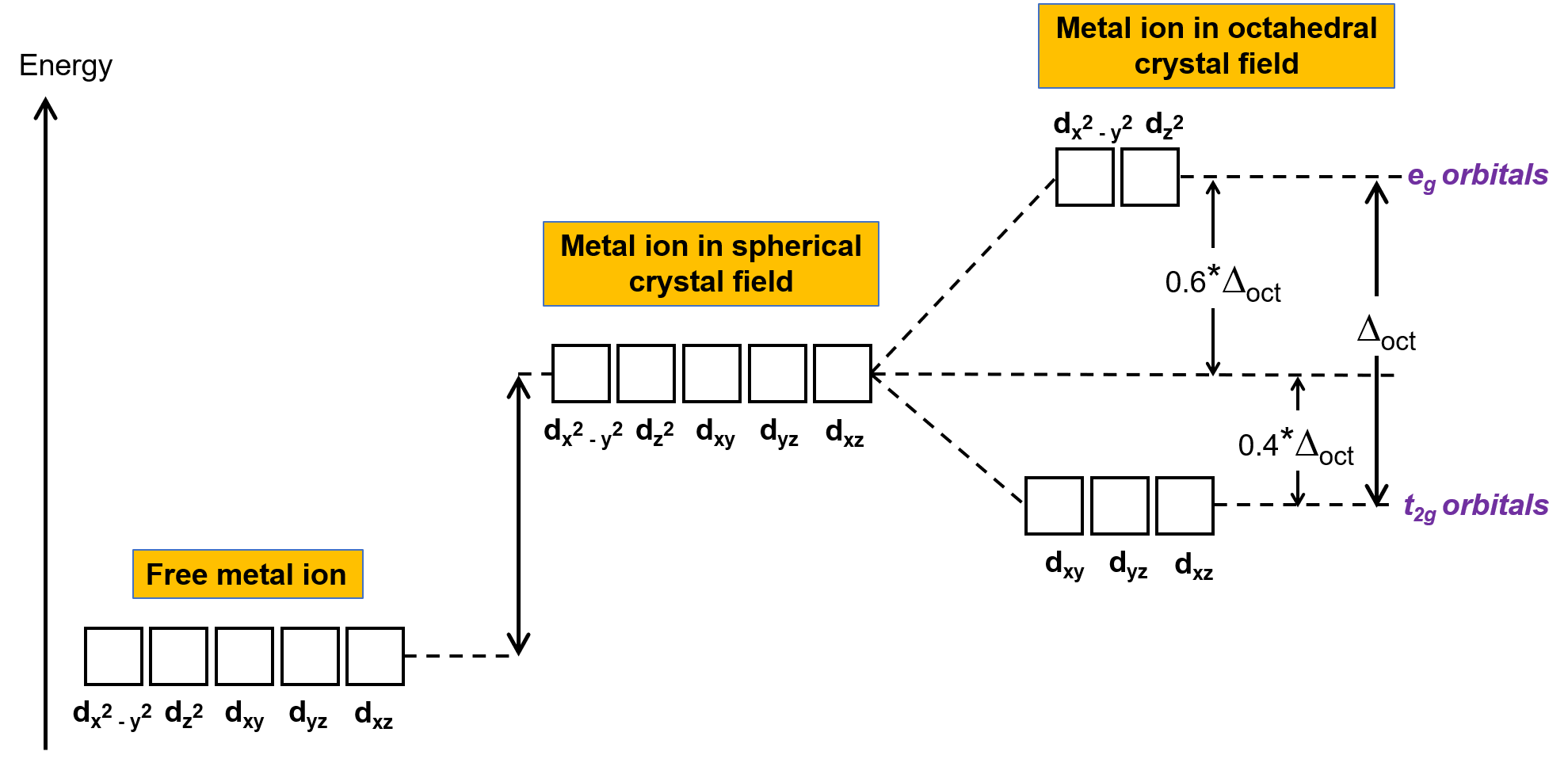
Figura 2. Gli orbitali d dello ione metallico in un campo cristallino sferico sono destabilizzati (più alti in energia) rispetto agli orbitali d dello ione metallico libero non complesso. Nei complessi ottaedri, gli orbitali eg sono ulteriormente destabilizzati (più alti in energia) rispetto agli orbitali t2g perché i ligandi interagiscono più fortemente con gli orbitali d a cui sono puntati direttamente.
Nei complessi ottaedri, i lobi in due dei cinque orbitali d, gli orbitali dx2−y2 e dz2, puntano verso i ligandi (Figura 1). Questi due orbitali sono chiamati orbitali e g (il simbolo si riferisce alla simmetria degli orbitali). Gli altri tre orbitali, gli orbitali dxy, dxze dyz, hanno lobi che puntano tra i ligandi e sono chiamati orbitali t2g (ancora una volta, il simbolo si riferisce alla simmetria degli orbitali). Mentre sei ligandi si avvicinano allo ione metallico lungo gli assi dell’ottaedro, le loro cariche puntili respingono gli elettroni negli orbitali d dello ione metallico. Tuttavia, le repulsioni tra gli elettroni negli orbitali eg (orbitali dx2–y2) e i ligandi sono maggiori delle repulsioni tra gli elettroni negli orbitali t2g (orbitali dxy, dxze dyz) e i ligandi. Questo perché i lobi degli orbitali eg puntano direttamente ai ligandi, mentre i lobi degli orbitali t2g puntano tra di loro. Così, gli elettroni negli orbitali e g dello ione metallico in un complesso ottaedro hanno energie potenziali più elevate di quelle degli elettroni negli orbitali t2g. La differenza di energia può essere rappresentata come mostrato nella figura 2.
La differenza di energia tra gli orbitali eg e t2g è chiamata divisione del campo cristallino ed è simboleggiata da Δoct, dove oct sta per octahedral. La magnitudine di Δoct dipende da molti fattori, tra cui la natura dei sei ligandi situati attorno allo ione metallico centrale, la carica sul metallo e se il metallo sta usandoorbitali3 d , 4do 5d. Ligandi diversi producono diverse divisioni del campo cristallino. L’aumento della divisione del campo cristallino prodotto dai ligandi è espresso nella serie spettrochimica, una versione breve della quale è data qui:
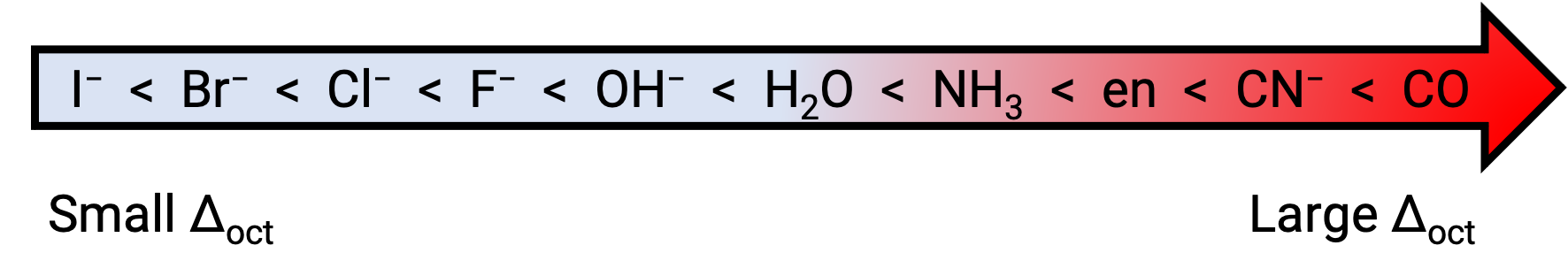
Questo testo è adattato da Openstax, Chimica 2e, Sezione:19.3: Proprietàpectroscopiche e magnetiche dei composti di coordinazione.
